14.1 Introduzione ai Neuropeptidi e all’Ossido Nitrico
I neurotrasmettitori classici (per esempio, glutammato e ACh) funzionano tramite il trasferimento direzionale di informazioni tra i siti di rilascio presinaptici e i gruppi postsinaptici di recettori. Il processo è generalmente ben organizzato spazialmente con alcuni, ma molto limitati, “spill-over” di trasmettitore tra sinapsi vicine. La situazione è molto diversa per la trasmissione mediata da neuropeptidi e ossido nitrico (NO). Queste molecole ignorano la direzionalità del flusso di informazioni e invece influenzano un volume di area dal loro punto di rilascio. Questa caratteristica è vagamente analoga al rilascio di ormoni peptidici nel flusso sanguigno, che possono essere trasportati in siti lontani per produrre i loro effetti. Per esempio, NO può essere prodotto in un neurone postsinaptico e diffondersi di nuovo al neurone presinaptico o ad altri neuroni vicini che influenzano il successivo rilascio del trasmettitore. Questa proprietà è chiamata trasmissione retrograda, poiché il segnale viaggia nella direzione opposta (da post a pre) rispetto alla classica direzionalità della neurotrasmissione.
14.2 Neuropeptidi
Molti neuropeptidi sono stati originariamente descritti come ormoni (ad esempio, somatostatina e colecistochinina), anche se una volta caratterizzati sono stati successivamente trovati anche nei neuroni del SNC. I neuropeptidi producono tipicamente risposte neuronali con insorgenza lenta e lunga durata (Figura 14.1), e ogni recettore neuropeptidico caratterizzato rientra nella classe GPCR (G-protein coupled receptor). Per confronto, la Figura 14.1 mostra le risposte tipiche prodotte dall’azione di un neurotrasmettitore classico (glutammato) che agisce su un recettore ionotropo e un neuropeptide. Un potenziale d’azione suscitato nel neurone 1 (in verde), un neurone che rilascia glutammato, produce il veloce (5 msec) EPSP tipico della trasmissione sinaptica mediata dal glutammato. Al contrario, un potenziale d’azione suscitato nel neurone 2 (in viola) che rilascia neuropeptide produce un EPSP ad insorgenza lenta (5 sec al picco) e di lunga durata (10 sec). Questi EPSP lenti sono tipici delle azioni dei neuropeptidi poiché tutti i recettori dei neuropeptidi sono accoppiati a proteine G.
Figura 14.1
Inoltre, molti neuropeptidi non producono un ovvio cambiamento elettrofisiologico nel neurone postsinaptico. Per esempio, un potenziale d’azione nel neurone 3 (Figura 14.1; rosa) non produce alcuna risposta nel neurone postsinaptico anche se si può confermare con altri mezzi che sono stati rilasciati neuropeptidi. Tuttavia, i cambiamenti si sono verificati nel neurone postsinaptico come rivelato nell’esempio mostrato nei pannelli etichettati “C”. Se si misura prima la risposta del glutammato (C1) stimolando il neurone 1, si vede una risposta tipica. La stimolazione del neurone 3 non produce alcuna risposta (C2) come prima. Tuttavia, se il neurone 1 è stimolato di nuovo dopo la stimolazione del neurone 3, l’EPSP misurato nel neurone postsinaptico è aumentato (C3) (l’EPSP originale è la linea continua e l’EPSP dopo la stimolazione del neurone 3 è la linea tratteggiata). Così, il neuropeptide rilasciato dal neurone 3 ha alterato la risposta del neurone postsinaptico a un altro neurotrasmettitore. Questi neuropeptidi sono detti neuromodulatori poiché i loro effetti sono quelli di potenziare o deprimere gli effetti di un secondo trasmettitore. Altri esempi di tale plasticità eterosinaptica sono descritti nel capitolo 7, parte 2.
14.3 Classificazione dei peptidi per famiglie
I neuropeptidi possono essere raggruppati in famiglie in base alle somiglianze nelle loro sequenze di aminoacidi (Tabelle I e II).
Tabella I
Famiglie di neuropeptidi
Tachichinine: sostanza P, bombesina, sostanza
Insuline: insulina, fattori di crescita insulino-simili
Somatostatine: somatostatina, polipeptide pancreatico
Gastrine: gastrina, colecistochinina
Opioidi: oppiocortine, encefaline, dinorfina
Per esempio, gli oppiacei sono raggruppati come una famiglia a causa dell’identica sequenza aminoacidica Tyr-Gly-Gly-Phe–(Tabella II) trovata al N-termine di ciascuno.
| Tabella II Identità di sequenza della famiglia degli oppiacei in corsivo |
|
| Nome | Sequenza di aminoacidi |
| Leu-encefalina | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-encefalina | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dinorfina | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosintesi e regolazione
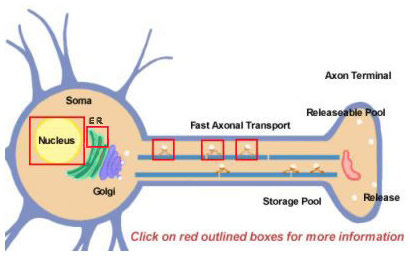
Figura 14.2
I neuropeptidi sono derivati da precursori più grandi tramite elaborazione proteolitica. Sono tutti inizialmente sintetizzati all’interno del soma (Figura 14.2). I precursori sono inizialmente formati dalla traduzione su poliribosomi attaccati al reticolo endoplasmatico vicino al corpo cellulare. Da lì, passano attraverso l’apparato di Golgi dove avvengono ulteriori modifiche, compresa la glicosilazione. Sono poi impacchettati in granuli secretori che vengono trasportati ai terminali dal trasporto assonale veloce. Veloce è un termine relativo, tuttavia, e a causa delle distanze relativamente lunghe che alcuni neuropeptidi devono viaggiare. Il rifornimento del pool di neuropeptidi rilasciabili potrebbe richiedere molte ore. Durante il trasporto al terminale nervoso, le proteasi che sono confezionate all’interno della vescicola iniziano a scindere il neuropeptide precursore nella sua forma matura finale. Questa elaborazione è essenziale per l’attivazione dei neuropeptidi, poiché i precursori sono biologicamente inattivi. All’interno delle vescicole si verificano almeno tre tipi di elaborazione (Figura 14.2; cliccare sulle caselle per maggiori dettagli). In primo luogo, un’endopeptidasi scinde il precursore per generare due nuovi prodotti (prima casella nell’assone). Per molti precursori questa scissione avviene dopo residui basici (come Lys e Arg) ed è compiuta da proteasi simili alla tripsina. Successivamente, anche se non per tutti i neuropeptidi, una carbossipeptidasi scinde i residui basici dal C-terminale del nuovo peptide (seconda casella nell’assone). Infine, un terzo enzima converte il gruppo COOH (carbossilico) di un residuo Gly, che si trova al C-terminale di molti neuropeptidi, in un gruppo NH2 (ammide) per produrre la forma matura e attiva del neuropeptide.
14.5 Meccanismi multipli sono utilizzati per produrre la diversità dei neuropeptidi
La maggior parte delle proteine sono prodotte da molecole di mRNA che vengono splicate da precursori di RNA nelle loro forme finali nel nucleo. Lo splicing differenziale è un modo che un neurone usa per diversificare la produzione di diversi tipi di neuropeptidi. Un esempio ben noto è l’mRNA della sostanza P che normalmente include anche l’mRNA che codifica la sostanza K. La porzione di mRNA che codifica la sostanza K può essere splicata differentemente in modo che l’mRNA risultante possa produrre solo la sostanza P (cliccare sulla casella sopra il nucleo nella Figura 14.2)
Figura 14.3
I neuropeptidi sono prodotti da un precursore proteico più lungo mediante elaborazione proteolitica. Un esempio eccellente è la famiglia dei peptidi oppioidi (per esempio, l’elaborazione della proopiomelanocorticotropina, POMC e Enkephalin; vedi Figura 14.3). Come notato, l’elaborazione proteolitica avviene all’interno delle vescicole di trasporto e il più delle volte avviene per scissione del precursore sul lato N-terminale dei residui basici (arginina e lisina), sebbene siano stati identificati anche altri siti di scissione. In alcuni casi, come la proteina precursore di Enkephalin, sono presenti più copie dello stesso peptide bioattivo finale. La molecola precursore mostrata nella parte superiore della Figura 14.3 contiene sei copie di Met-enkephalin (ME) e una copia di Leu-enkephalin (LE).
La diversità può quindi essere generata alterando la sequenza dei siti di scissione mediante splicing differenziale, producendo e/o confezionando diverse proteasi (che riconoscono diverse sequenze per la scissione) nelle vescicole di trasporto, o nascondendo un sito proteolitico mediante modifiche post-traslazionali. Un esempio di quest’ultimo è che uno specifico sito di scissione potrebbe essere nascosto dall’aggiunta di una catena laterale di carboidrati che blocca stericamente la proteasi dall’avere accesso a quel sito. Un’altra scoperta comune è che una singola molecola precursore conterrà diversi neuropeptidi (vedi Figura 14.3) e quindi i tipi di elaborazione che si verificano determinano alla fine quale neuropeptide viene rilasciato dal neurone. La proteina precursore POMC può essere scissa per formare ACTH (arancione) e β-lipoproteina (blu chiaro) che possono essere ulteriormente scisse per generare ulteriori neuropeptidi bioattivi (Figura 14.3). Per esempio, la β-lipoproteina (blu chiaro) può essere ulteriormente scissa in γ-lipoproteina (strisce verdi) e β-endorfina (blu scuro). Ancora una volta, a seconda dell’elaborazione che avviene, la stessa proteina precursore può essere modificata per produrre neuropeptidi con risposte biologiche drammaticamente diverse.
14.6 Rilascio
Figura 14.4
I peptidi sono rilasciati da esocitosi calcio-dipendente con alcune importanti differenze rispetto al rilascio dei neurotrasmettitori classici. In genere, le vescicole che rilasciano neuropeptidi sono molto più grandi di quelle che contengono neurotrasmettitori a piccola molecola (per esempio, il glutammato) e non richiedono una specializzazione presinaptica per il rilascio (vedi la micrografia elettronica nella Figura 14.4). In contrasto con le piccole vescicole che contengono glutammato, le grandi vescicole non appaiono agganciate alla membrana. Questa osservazione è coerente con l’idea che i neurotrasmettitori a piccole molecole producono effetti brevi e locali (nelle connessioni sinaptiche), mentre i neuropeptidi producono effetti lenti e duraturi che spesso comprendono un’area significativa intorno al sito di rilascio. Inoltre, ricordiamo che poiché i neuropeptidi sono sintetizzati nel soma della cellula e non localmente alla sinapsi, se la loro fornitura è esaurita dal rilascio prolungato, potrebbero essere necessarie diverse ore per ricostituire i pool rilasciabili. Per esempio, un motoneurone, con il suo corpo cellulare nel midollo spinale e la sinapsi nel piede, ha un assone lungo un metro. Utilizzando il trasporto assonale veloce, ci vorrebbe potenzialmente più di un giorno perché un neuropeptide appena sintetizzato arrivi a questa sinapsi dal soma. Dovrebbe anche essere evidente che i neuropeptidi endogeni che uccidono il dolore, come la beta-endorfina, potrebbero essere “esauriti” in tempi di stimolazione persistente, portando a situazioni in cui il dolore non può più essere controllato dai meccanismi endogeni.
Un tipico neurone maturo rilascerà spesso un neurotrasmettitore a piccole molecole e uno o più neuropeptidi (come nell’esempio mostrato nella figura 14.4). Se viene rilasciato più di un neuropeptide, questi spesso provengono dalla stessa singola molecola precursore. Un esempio è il rilascio congiunto di ACh e del peptide correlato al gene della calcitonina dai motoneuroni spinali. Il CGRP attiva l’adenilato ciclasi, aumentando i livelli di cAMP, e potenzia la forza di contrazione prodotta dall’attivazione di ACh del recettore nicotinico di ACh. In questo caso, il neuropeptide è modulatore come descritto nella Figura 14.1. Tuttavia, in questo caso, l’effetto potenzia la contrazione muscolare invece di aumentare la grandezza dell’EPSP. In entrambi gli esempi, la risposta potenziata è dovuta a una maggiore sensibilità del sistema a una quantità costante di neurotrasmettitore rilasciato.
14.6 Cessazione dell’azione
I neuropeptidi vengono lentamente rimossi dallo spazio extracellulare; una caratteristica che contribuisce anche ai loro effetti relativamente duraturi. L’inattivazione avviene sia per diffusione che per degradazione da parte delle proteasi extracellulari. Nessuna prova è stata trovata per il riassorbimento dei peptidi come mezzo per terminare la loro azione.
14.7 I recettori sono tutti legati a proteine G
Tutti i recettori noti dei neuropeptidi producono i loro effetti alterando i livelli dei secondi messaggeri intracellulari. Questi recettori sono sette proteine transmembrana che sono collegate attraverso le proteine G (GPCRs) per alterare l’attivazione di altri enzimi cellulari. Questa proprietà è coerente con i neuropeptidi che inducono una risposta più lenta e si adatta bene a un ruolo modulatorio. Una distinzione importante tra i trasmettitori di molecole piccole e neuropeptidi è che i recettori dei neuropeptidi hanno un’alta affinità di legame (nanomolare) in contrasto con le affinità micro- o millimolari misurate per i neurotrasmettitori di piccole molecole (come il glutammato). Poiché i neuropeptidi non sono rilasciati in modo direzionale nel volume confinato di una sinapsi, le loro concentrazioni non raggiungono livelli molto alti e i recettori devono quindi avere un’alta affinità per reagire a queste piccole concentrazioni. Questa alta affinità rallenta la dissociazione del neuropeptide dal suo recettore e contribuisce anche agli effetti persistenti di queste molecole.
14.8 Ossido nitrico (NO)
L’ossido nitrico ha guadagnato una grande attenzione come membro fondatore di una nuova classe di molecole messaggere gassose. NO è la molecola attiva che la nitroglicerina sublinguale produce per aumentare la vasodilatazione nel sollievo dell’angina. Altri importanti effetti biologici di NO sono ora riconosciuti. Per esempio, nel sistema nervoso, NO è importante nella regolazione del flusso sanguigno cerebrale, nella modulazione della neurotrasmissione e nella tossicità associata a vari stati patologici.
14.9 Caratteristiche di NO
Riassunto delle proprietà di NO
- Gas che si diffonde liberamente attraverso le membrane
- Vita breve con un’emivitavita misurata in secondi
- Radicale libero altamente reattivo
- Tossico ad alte concentrazioni
NO è un gas a vita breve da non confondere con il gas anestetico relativamente stabile ossido nitroso (gas esilarante). NO è in realtà un radicale libero ed è quindi un composto altamente reattivo. Alcuni dei suoi effetti tossici sono probabilmente dovuti a NO che reagisce con il superossido per produrre il radicale distruttivo perossinitrato. NO è considerato un neurotrasmettitore non convenzionale perché non è rilasciato dall’esocitosi e la sua azione non avviene attraverso molecole recettoriali convenzionali.
Come già detto, la descrizione tipica della comunicazione neuronale considera la trasmissione unidirezionale. Viene rilasciato un neurotrasmettitore presinaptico che produce cambiamenti nel neurone postsinaptico. Diversi composti (come i neuropeptidi e l’NO) prodotti nei neuroni postsinaptici si diffondono nell’ambiente locale e influenzano le cellule circostanti. Poiché NO è un gas liberamente diffusibile, ha il potenziale di viaggiare rapidamente in qualsiasi direzione dal suo punto di produzione. Per esempio, se prodotto in una cellula postsinaptica a causa della stimolazione del recettore del glutammato, l’NO potrebbe essere rilasciato nell’ambiente locale e inviare un segnale al neurone presinaptico (Figura 14.5). Questo tipo di attività viene definito segnalazione retrograda, poiché il segnale viaggia in direzione retrograda dal neurone postsinaptico a quello presinaptico.
Figura 14.5
Figura 14.6
Le figure 14.5, 14.6 e 14.7 riassumono gli aspetti principali della sintesi di NO. In questo esempio, il glutammato viene rilasciato dal terminale presinaptico che si lega ai recettori NMDA sulla membrana postsinaptica, causandone l’apertura e permettendo l’afflusso di Ca2+. Il Ca2+ attiva la calmodulina che si lega e attiva l’enzima ossido nitrico sintasi (NOS). Usando l’arginina come substrato, il NOS produce NO e un secondo prodotto di reazione, la citrullina. L’NO è quindi libero di diffondersi nell’ambiente e di interagire con il terminale presinaptico che inizialmente ha rilasciato il glutammato o qualsiasi altra cellula nell’ambiente locale. Riconoscere che qualsiasi processo che eleva il Ca2+ intracellulare attiverà potenzialmente la NOS. L’attivazione del glutammato dei recettori NMDA è solo un esempio ben documentato.
Figura 14.7
14.10 Sintesi da ossido nitrico sintasi (NOS) e rilascio
NO è prodotto dall’enzima ossido nitrico sintasi (NOS). Questo enzima si trova in una sottopopolazione di neuroni (1-2% dei neuroni nella corteccia) e si trova nella maggior parte delle cellule endoteliali. Almeno una forma di NOS in queste cellule dipende dal calcio e dalla calmodulina per l’attivazione, come indicato nelle figure 14.5, 14.6 e 14.7. Contiene anche cofattori simili al citocromo P-450. Questi cofattori sono NADPH (nicotinamide adenina dinucleotide fosfato, FAD (flavin adenina mononucleotide) e FMN (flavin mononucleotide). Questi cofattori sono essenziali per il trasferimento di elettroni che produce il prodotto instabile e di breve durata NO. Il substrato in questa reazione è il comune aminoacido arginina e i prodotti sono citrullina e NO (Figura 14.5). A causa della breve vita dell’NO è straordinariamente difficile da misurare direttamente. Tuttavia, in preparazioni sperimentali, c’è un’eccellente correlazione tra l’applicazione di NMDA, che aumenta il Ca2+ intraneuronale e attiva la NOS, con la produzione dell’ulteriore prodotto dell’attività enzimatica della NOS, la citrullina (vedi Figura 14.8). La produzione di citrullina è un indicatore affidabile della produzione di NO. È anche possibile bloccare la produzione di citrullina (e di NO) somministrando alle cellule il substrato non metabolizzabile per la NOS chiamato metil arginina (Figura 14.9), e tali composti sono stati usati per ridurre la produzione di NO e terminare i suoi effetti biologici.
|
Figura 14.8 |
Figura 14.9 |
14.11 “Recettori” per l’NO
Figura 14.10
Uno dei principali bersagli dell’NO sembra essere l’enzima guanilciclasi. Questa scoperta è stata fatta indirettamente monitorando l’accumulo del prodotto NOS citrullina mentre si controllava anche la produzione di cGMP, il prodotto dell’enzima guanilil ciclasi (figure 14.8 e 14.9). In questo esperimento NMDA è stato aggiunto a una preparazione neuronale per attivare il NOS. Il NOS utilizza l’arginina come substrato per produrre NO e, come menzionato, se un analogo non idrolizzabile come la metil-arginina viene aggiunto al sistema, l’accumulo di citrullina e cGMP sono risultati terminare nella stessa maniera dose-dipendente. Queste forti correlazioni hanno portato alla scoperta che la guanilciclasi è un bersaglio principale di NO.
La guanilciclasi è un enzima insolito perché ha un anello eme con una molecola di ferro associata come parte della sua struttura. NO attiva questo enzima legandosi al ferro nell’eme, iniziando la produzione di GMP ciclico dal GTP (Figura 14.10) attraverso cambiamenti conformazionali nell’enzima. cGMP attiva poi una protein chinasi cGMP-dipendente e altri enzimi descritti di seguito. Lo spettro degli effetti prodotti dall’attivazione della proteina chinasi cGMP-dipendente sta venendo compreso solo ora.
14.12 Effetti biologici di NO
NO produce un’ampia varietà di effetti biologici. Purtroppo, siamo particolarmente ignoranti sul ruolo di NO nella modulazione dei processi cellulari nel sistema nervoso. Il ruolo di NO nella regolazione dei vasi è ben documentato e sembra avere un ruolo altrettanto importante nel sistema nervoso.
14.13 Vasodilatatore
Figura 14.11
Clicca qui per vedere una vista ingrandita di questa immagine.
In circostanze normali, NO contribuisce al controllo del flusso sanguigno attraverso la cerebrovascolatura. Esiste necessariamente un meccanismo di feedback rapido per fornire alle aree più attive del cervello i nutrienti necessari. Questo meccanismo è necessario a causa della debole riserva di energia del cervello. L’NO viene prodotto nei neuroni contenenti NOS che sono sottoposti a un’attività sostenuta. Queste condizioni favoriscono l’attivazione dei recettori NMDA, che è noto per causare la produzione di NO. NO si diffonde da queste aree localizzate di alta attività neuronale alla microvasculatura circostante (Figura 14.11) causando vasodilatazione e aumento del flusso sanguigno.
Anche se i meccanismi esatti con cui NO produce la vasodilatazione non sono ancora definiti, è noto che l’attivazione della protein chinasi cGMP-dipendente nelle cellule muscolari lisce causa un rilassamento dei vasi. Poiché uno dei principali bersagli di NO è la guanililciclasi (che produce cGMP e attiva la protein chinasi cGMP-dipendente), si presume che uno dei principali percorsi per le azioni vasodilatatorie di NO sia attraverso la protein chinasi cGMP-dipendente. L’attivazione di questa chinasi porta indirettamente alla diminuzione dei livelli di Ca2+ nelle cellule muscolari lisce e successivamente alla defosforilazione dell’apparato contrattile della miosina che provoca il rilassamento (Figura 14.12). Nelle cellule muscolari lisce, NO sembra anche iperpolarizzare direttamente le cellule probabilmente attivando i canali K+, portando alla chiusura secondaria dei canali del Ca2+ che produce anche il rilassamento muscolare. In conclusione, una delle funzioni principali di NO sembra essere l’integrazione del livello di attività neuronale con le alterazioni locali del flusso sanguigno cerebrale per mantenere un’adeguata perfusione del tessuto metabolicamente attivo.
Figura 14.12
14.14 Neuromodulatore
Si pensa che NO agisca anche come messaggero diffusibile localmente. Viene prodotto da qualsiasi azione che eleva il Ca2+ nelle cellule contenenti NOS, come la stimolazione del glutammato dei recettori NMDA. Attraverso la successiva attivazione della guanilciclasi e la produzione di cGMP, la produzione di NO influenza una varietà di processi secondari. Questi includono la modulazione diretta dei canali ionici, la stimolazione della protein chinasi cGMP-dipendente e la up-regolazione o down-regolazione della cAMP-fosfodiesterasi. Gli effetti a valle sono poi numerosi e comprendono la regolazione verso l’alto o verso il basso dei canali del Ca2+, l’aumento dell’eccitabilità (aumenta il tasso di accensione dei neuroni), l’aumento o la diminuzione del rilascio di neurotrasmettitori e i cambiamenti nella morfologia dei neuroni.
14.15 Tossicità
NO in eccesso è tossico per le cellule. Tuttavia, esiste un paradosso per la tossicità di NO. Le cellule che producono alti livelli di NO sono resistenti ai suoi effetti tossici. Per esempio, la tossicità di NO è usata dai macrofagi e dai neutrofili come meccanismo per uccidere le cellule tumorali e i batteri. Tuttavia, nessuno dei due tipi di cellule che producono NO è suscettibile ai suoi effetti dannosi. Questo risultato è vero anche per i neuroni del sistema nervoso centrale. L’eccesso di glutammato induce neurotossicità nel cervello e si pensa che sia la causa principale della morte neuronale in malattie come l’Huntington o l’Alzheimer o dopo un ictus acuto o un trauma. Si pensa che l’eccesso di produzione di NO abbia un ruolo in questa perdita neuronale a causa della sua tossicità quando viene prodotto in eccesso. È interessante notare che le cellule che si colorano di positivo per l’enzima NOS sono risparmiate nelle aree degeneranti del cervello colpite da queste malattie. La resistenza di queste cellule sembra essere simile alla resistenza delle cellule immunitarie descritte sopra.
Testa la tua conoscenza
- Questione 1
- A
- B
- C
- D
- E
I neuropeptidi sono presenti nei terminali sinaptici perché sono:
A. Sintetizzati nel terminale.
B. Trasportati dal trasporto assonale veloce
C. Trasportato per diffusione
D. Trasportato per trasporto assonale lento
E. Assunto dallo spazio extracellulare
I neuropeptidi sono presenti nei terminali sinaptici perché sono:
A. Sintetizzati nel terminale. Questa risposta è INCORRETTA.
Il macchinario sintetico necessario per la sintesi dei peptidi e delle proteine non si trova nel terminale dell’assone.B. Trasportato dal trasporto assonale veloce
C. Trasportato per diffusione
D. Trasportato per trasporto assonale lento
E. Assunto dallo spazio extracellulare
I neuropeptidi sono presenti nei terminali sinaptici perché sono:
A. Sintetizzati nel terminale.
B. Trasportati dal trasporto assonale veloce Questa risposta è CORRETTA!
I neuropeptidi sono sintetizzati nel corpo cellulare e sono elaborati in vescicole che sono trasportate ai terminali assonali lungo i microtubuli attraverso il trasporto assonale veloce.C. Trasportati per diffusione
D. Trasportato per trasporto assonale lento
E. Assunto dallo spazio extracellulare
I neuropeptidi sono presenti nei terminali sinaptici perché sono:
A. Sintetizzati nel terminale.
B. Trasportati dal trasporto assonale veloce
C. Trasportato per diffusione Questa risposta è INCORRETTA.
Anche la diffusione è un eccellente meccanismo per spostare molecole su brevi distanze (pochi micron) ma è inefficiente per spostare molecole su distanze che tipicamente separano il soma neuronale dai terminali dell’assone.D. Trasportato dal trasporto assonale lento
E. Assorbiti dallo spazio extracellulare
I neuropeptidi sono presenti nei terminali sinaptici perché sono:
A. Sintetizzati nel terminale.
B. Trasportati dal trasporto assonale veloce
C. Trasportato per diffusione
D. Trasportato dal trasporto assonale lento Questa risposta è INCORRETTA.
Inoltre, è importante rifornire il più rapidamente possibile i terminali di neuropeptidi. In questo caso, più veloce è meglio.E. Assunto dallo spazio extracellulare
I neuropeptidi sono presenti nei terminali sinaptici perché sono:
A. Sintetizzati nel terminale.
B. Trasportati dal trasporto assonale veloce
C. Trasportato per diffusione
D. Trasportato per trasporto assonale lento
E. Assunto dallo spazio extracellulare Questa risposta è INCORRETTA.
Non è noto alcun meccanismo di assorbimento per rimuovere i neuropeptidi dallo spazio extracellulare. Il loro meccanismo d’azione è terminato per diffusione e per degradazione enzimatica da parte delle proteasi extracellulari.
- Questione 2
- A
- B
- C
- D
- E
Ossido nitrico:
A. Ha una lunga durata
B. È permeabile alla membrana.
C. Non è reattivo
D. È anche conosciuto come gas esilarante.
E. Non è tossico per le cellule.
Ossido nitrico:
A. Ha una lunga vita Questa risposta è INCORRETTA.
NO ha un’emivita misurata in secondi ed è altamente instabile.B. È permeabile alla membrana.
C. Non è reattivo
D. È anche conosciuto come gas esilarante.
E. Non è tossico per le cellule.
Ossido nitrico:
A. Ha una lunga durata
B. È permeabile alla membrana. Questa risposta è CORRETTA!
NO è liberamente permeabile alle membrane e colpisce tutte le cellule entro un certo raggio dal suo punto di produzione.C. Non è reattivo
D. È anche conosciuto come gas esilarante.
E. Non è tossico per le cellule.
Ossido nitrico:
A. Ha una lunga durata
B. È permeabile alla membrana.
C. Non è reattivo Questa risposta è INCORRETTA.
NO è un radicale libero altamente reattivo. Reagisce con proteine, lipidi e acido nucleico e ha un’affinità particolarmente alta per i metalli ridotti (come Fe2+ nel gruppo eme della guanilciclasi).D. È anche conosciuto come gas esilarante.
E. Non è tossico per le cellule.
Ossido nitrico:
A. Ha una lunga durata
B. È permeabile alla membrana.
C. Non è reattivo
D. È anche conosciuto come gas esilarante. Questa risposta è INCORRETTA.
Il gas esilarante è ossido nitroso e non ossido nitrico. Non è reattivo e non è tossico, ma influisce sulle proprietà della membrana.E. Non è tossico per le cellule.
Ossido nitrico:
A. Ha una lunga durata
B. È permeabile alla membrana.
C. Non è reattivo
D. È anche conosciuto come gas esilarante.
E. Non è tossico per le cellule. Questa risposta è INCORRETTA.
NO è altamente tossico per le cellule quando è prodotto in eccesso. Infatti, si pensa che la sovrapproduzione di NO causi alcune malattie neurodegenerative. NO è anche prodotto dai macrofagi come prodotto tossico per uccidere i batteri invasori.