L’elemento chimico idrogeno è classificato come un non metallo. Può diventare metallico a pressioni molto elevate. Fu scoperto nel 1766 da Henry Cavendish.

Data Zone
| Classificazione | L’idrogeno è un non metallo. Può diventare metallico a pressioni molto alte. |
| Colore | incolore |
| Peso atomico | 1.0079 |
| Stato | gas |
| Punto di fusione | -259.14 oC, 14.01 K |
| Punto di ebollizione | -252.87 oC, 20.28 K |
| Elettroni: | 1 |
| Protoni: | 1 |
| Neutroni nell’isotopo più abbondante: | 0 |
| Gusci di elettroni | 1 |
| Configurazione degli elettroni | 1s1 |
| Densità a 20oC | 0.0000899 g/cm3 |
Mostra di più, incluso: Calori, Energie, Ossidazione,
Reazioni, Composti, Raggi, Conducibilità
| Volume atomico | 14.4 cm3/mol |
| Struttura | hcp: esagonale ravvicinata (come solido a basse temperature) |
| Durezza | – |
| Capacità termica specifica | 14.304 J g-1 K-1 |
| Calore di fusione | 0,117 kJ mol-1 di H2 |
| Calore di atomizzazione | 218 kJ mol-1 |
| Calore di vaporizzazione | 0.904 kJ mol-1 di H2 |
| 1a energia di ionizzazione | 1312 kJ mol-1 |
| 2a energia di ionizzazione | kJ mol-1 |
| 3a energia di ionizzazione | 11815.0 kJ mol-1 |
| Affinità degli elettroni | 72.7711 kJ mol-1 |
| Numero minimo di ossidazione | -1 |
| Numero minimo di ossidazione comune | -1 |
| Numero massimo di ossidazione | 1 |
| Numero massimo di ossidazione comune. | 1 |
| Elettronegatività (Scala Pauling) | 2.18 |
| Volume di polarizzabilità | 0.7 Å3 |
| Reazione con aria | vigorosa, ⇒ H2O |
| Reazione con 15 M HNO3 | nessuno |
| Reazione con 6 M HCl | nessuno |
| Reazione con 6 M NaOH | nessuno |
| Ossido(i) | H2O |
| Idruro(i) | H2 |
| Cloruro(s) | HCl |
| Raggio atomico | 25 pm |
| Raggio ionico (ione 1+) | – |
| Raggio ionico (ione 2+) | – |
| Raggio ionico (ione 3+) | – |
| Raggio ionico (1- ione) | – |
| Raggio ionico (2-ione) | – |
| Raggio ionico (3-ione) | – |
| Conducibilità termica | 0.1805 W m-1 K-1 |
| Conducibilità elettrica | – |
| Punto di congelamento/fusione: | -259.14 oC, 14.01 K |

Immagine NASA: Vaste quantità di idrogeno in galassie remote.

Teofrasto Paracelso – Il primo a generare idrogeno: “L’aria nasce e si sprigiona come un vento.”
Scoperta dell’idrogeno
Un esperimento scolastico preferito di chimica è aggiungere un metallo come il magnesio ad un acido. Il metallo reagisce con l’acido, formando un sale e rilasciando idrogeno dall’acido. L’idrogeno gassoso sale dal liquido e gli studenti lo raccolgono in piccole quantità per ulteriori esperimenti, come il “pop-test”.
Il primo caso registrato di idrogeno prodotto dall’azione umana fu nella prima metà del 1500, con un metodo simile a quello usato nelle scuole ora. Teofrasto Paracelso, un medico, sciolse il ferro in acido solforico e osservò il rilascio di un gas. Si dice che abbia detto dell’esperimento: “L’aria nasce e si sprigiona come un vento”. Tuttavia, non scoprì nessuna delle proprietà dell’idrogeno.(1)
Turquet De Mayerne ripeté l’esperimento di Paracelso nel 1650 e trovò che il gas era infiammabile.(2) Né Paracelso né De Mayerne proposero che l’idrogeno potesse essere un nuovo elemento. Infatti, Paracelso credeva che ci fossero solo tre elementi – i tria prima – sale, zolfo e mercurio – e che tutte le altre sostanze fossero fatte di diverse combinazioni di questi tre. (3) (La chimica aveva ancora molta strada da fare!)
Nel 1670, lo scienziato inglese Robert Boyle aggiunse ferro all’acido solforico. Mostrò che il gas (idrogeno) risultante bruciava solo se era presente l’aria e che una frazione dell’aria (che oggi chiameremmo ossigeno) veniva consumata dalla combustione.(4)
L’idrogeno fu riconosciuto come elemento distinto per la prima volta nel 1766 dallo scienziato inglese Henry Cavendish, quando lo preparò facendo reagire l’acido cloridrico con lo zinco. Descrisse l’idrogeno come “aria infiammabile dai metalli” e stabilì che era lo stesso materiale (dalle sue reazioni e dalla sua densità) indipendentemente da quale metallo e quale acido usava per produrlo.(1) Cavendish osservò anche che quando la sostanza veniva bruciata, produceva acqua.
Lo scienziato francese Antoine Lavoisier nominò più tardi l’elemento idrogeno (1783). Il nome deriva dal greco ‘hydro’ che significa acqua e ‘genes’ che significa formare – l’idrogeno è uno dei due elementi che formano l’acqua.
Nel 1806, con l’idrogeno ben stabilito come elemento, il chimico inglese Humphry Davy spinse una forte corrente elettrica attraverso acqua purificata.
Ha trovato che si sono formati idrogeno e ossigeno. L’esperimento dimostrò che l’elettricità poteva separare le sostanze nei loro elementi costitutivi. Davy si rese conto che le sostanze erano legate insieme da un fenomeno elettrico; aveva scoperto la vera natura del legame chimico.(5)
Visita la pagina dei fatti sull’idrogeno di Chemicool.

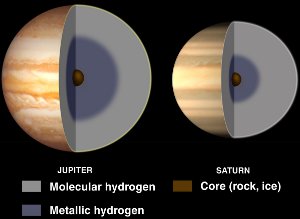
Interni di Giove e Saturno, con idrogeno metallico liquido. Cortesia NASA/JPL-Caltech.

Nasa: Il serbatoio esterno dello Space Shuttle (arancione) riempito con idrogeno liquido e ossigeno.

Le auto a idrogeno emettono acqua piuttosto che sostanze inquinanti.

L’elettrolisi in laboratorio dell’acqua. L’energia elettrica è usata per dividere l’acqua. L’idrogeno si raccoglie in una provetta, l’ossigeno nell’altra.
Apparenza e caratteristiche
Effetti nocivi:
L’idrogeno è altamente infiammabile e ha una fiamma quasi invisibile, che può portare a ustioni accidentali.
Caratteristiche:
L’idrogeno è l’elemento più semplice di tutti, e il più leggero. È anche l’elemento di gran lunga più comune nell’universo. Oltre il 90% degli atomi nell’universo sono idrogeno.
Nella sua forma più comune, l’atomo di idrogeno è fatto di un protone, un elettrone e nessun neutrone. L’idrogeno è l’unico elemento che può esistere senza neutroni.
L’idrogeno è un gas incolore e inodore che esiste, a temperatura e pressione standard, come molecole biatomiche, H2.
Brucia e forma miscele esplosive in aria e reagisce violentemente con gli ossidanti.
Sulla Terra, la posizione principale dell’idrogeno è in acqua, H2O. C’è poco idrogeno libero sulla Terra perché l’idrogeno è così leggero che non è trattenuto dalla gravità del pianeta. Qualsiasi idrogeno che si forma alla fine sfugge dall’atmosfera nello spazio.
Anche se l’idrogeno è di solito un non metallo, diventa un metallo liquido quando gli vengono applicate enormi pressioni.
Tali pressioni si trovano nei pianeti giganti gassosi come Giove e Saturno. L’alto campo magnetico di Giove (14 volte quello terrestre) si crede sia causato da un effetto dinamo risultante dall’idrogeno metallico elettricamente conduttore che circola mentre il pianeta ruota.
Usi dell’idrogeno
Grandi quantità di idrogeno sono usate nel processo Haber (produzione di ammoniaca), idrogenazione di grassi e oli, produzione di metanolo, idrocracking e idrodesolforazione. L’idrogeno è anche usato nella raffinazione dei metalli.
L’idrogeno liquido è usato come carburante per razzi, per esempio per alimentare il decollo e l’ascesa in orbita dello Space Shuttle. L’idrogeno liquido e l’ossigeno sono contenuti nel grande serbatoio esterno dello Shuttle. (Vedi immagine a sinistra.)
I due isotopi più pesanti dell’idrogeno (deuterio e trizio) sono usati nella fusione nucleare.
L’economia dell’idrogeno è stata proposta come sostituzione della nostra attuale economia basata sugli idrocarburi (petrolio, gas e carbone).
La base dell’economia dell’idrogeno è che l’energia viene prodotta quando l’idrogeno brucia con l’ossigeno e l’unico sottoprodotto della reazione è l’acqua.
Al momento, tuttavia, l’idrogeno per le auto a idrogeno è prodotto dagli idrocarburi. Solo quando l’energia solare o eolica, per esempio, potrà essere usata commercialmente per scindere l’acqua in idrogeno e ossigeno, sarà possibile una vera economia dell’idrogeno.
Abbondanza e isotopi
Abbondanza crosta terrestre: 1400 parti per milione in peso (0,14%), 2,9% per mole
Abbondanza sistema solare: 75% in peso, 93% per mole
Costo, puro: $12 per 100g
Costo, sfuso: $ per 100g
Fonte: L’idrogeno è preparato commercialmente facendo reagire il vapore surriscaldato con il metano o il carbonio. In laboratorio, l’idrogeno può essere prodotto dall’azione di acidi su metalli come lo zinco o il magnesio, o dall’elettrolisi dell’acqua (mostrato a sinistra).
Isotopi: L’idrogeno ha tre isotopi, 1H (protio), 2H (deuterio) e 3H (trizio). I suoi due isotopi più pesanti (deuterio e trizio) sono usati per la fusione nucleare. Il prozio è l’isotopo più abbondante e il trizio il meno abbondante. Il trizio è instabile con un tempo di dimezzamento di circa 12 anni e 4 mesi. L’idrogeno naturale è una miscela dei due isotopi 1H e 2H con abbondanze naturali del 99,99% e 0,01% rispettivamente.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s “The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Citare questa pagina
Per il collegamento online, si prega di copiare e incollare uno dei seguenti:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
o
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Per citare questa pagina in un documento accademico, utilizzare la seguente citazione conforme a MLA:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.