INTRODUZIONE
L’amiloidosi è una malattia da deposito causata dall’accumulo extracellulare di fibrille la cui origine è costituita da proteine con una struttura instabile che si piegano, si aggregano e vanno incontro a deposito.1 Tale deposito può alterare la struttura dei tessuti e compromettere la funzione di vari organi e sistemi.2
Le fibrille amiloidi sono insolubili e resistenti alla proteolisi e sono tipicamente colorate con rosso Congo, mostrando un’intensa birifrangenza giallo-verde sotto luce polarizzata.3 Più di 30 proteine possono causare depositi amiloidi, ma solo 5 causano depositi significativi nel tessuto cardiaco1:
- –
Catene leggere, che causano l’amiloidosi primaria (AL).
- –
Transtiretina (TTR), che causa l’amiloidosi TTR (ATTR).
- –
Apolipoproteina A.
- –
Fibrinogeno.
- –
Proteina A amiloide del siero, che produce l’amiloidosi secondaria.
L’amiloidosi primaria e ATTR sono le forme più comuni di amiloidosi cardiaca, la forma AL è storicamente considerata più comune nei paesi sviluppati.3
La maggior parte delle informazioni sull’amiloidosi cardiaca si è basata sulla AL. Tuttavia, sebbene il numero di pazienti con AL sia rimasto stabile, il numero di diagnosi di ATTR è recentemente aumentato e si pensa ora che ATTR possa essere molto più prevalente di AL.2
L’amiloidosi transtiretinica è stata molto spesso oggetto di diagnosi errata o di ritardi significativi fino alla sua corretta diagnosi. Le ragioni includono l’eterogeneità delle sue forme, la necessità di una conferma istologica, la carenza di attrezzature specializzate e le convinzioni errate di alcuni cardiologi che si tratta di una malattia rara senza opzioni di trattamento.2,3
Tuttavia, questi aspetti stanno cambiando. La diagnosi ha implicazioni per la gestione del paziente. Sono state sviluppate terapie specifiche che possono ritardare o stabilizzare la deposizione e che sono più efficaci nelle fasi iniziali. La diagnosi precoce è quindi cruciale. Questa revisione descrive i recenti progressi significativi nella diagnosi e nel trattamento di ATTR, offrendo speranza per i pazienti con questa condizione.
AMILIDOSI CARDIACA DI TRANSTYRETIN
Transtiretina è una proteina plasmatica tetramerica responsabile del trasporto della tiroxina e delle proteine legate al retinolo. È sintetizzata principalmente nel fegato e secondariamente nel plesso coroideo e nell’epitelio pigmentato retinico.4
La transtiretina tende a dissociarsi in dimeri e monomeri, che si assemblano male in fibrille e subiscono la deposizione. Mutazioni puntiformi o l’effetto dell’età possono aumentare questa tendenza, dando origine alle 2 forme cliniche di ATTR: mutante (ATTRm) e wild-type (ATTRwt).
Amiloidosi della transtiretina mutante
Sono attualmente note oltre 120 mutazioni che causano ATTRm. Queste mutazioni presentano un modello di eredità autosomica dominante, con penetranza variabile.4 A causa della sua ampia diversità geografica, è difficile stabilire la prevalenza di ATTR, ma è considerata una malattia rara con una prevalenza inferiore a 1/100 000 abitanti2 (Tabella 1).
Caratteristiche cliniche e diagnostiche principali della transtiretina mutante e selvaggia.Type Transthyretin Cardiac Amyloidosis
| ATTRwt | ATTRm | |
|---|---|---|
| Prevalenza | Non nota. Apparentemente molto frequente | |
| Studio genetico | Assenza di mutazioni in TTR | Mutazione in TTR |
| Età tipica alla presentazione | > 60 anni | Variabile secondo la mutazione causale |
| Sesso | Prevalenza maschile. 80% dei pazienti | Prevalenza maschile, con fenotipo più aggressivo |
| Manifestazioni extracardiache | – Sindrome del tunnel carpale (33%-49%) – Stenosi spinale lombare – Rottura traumatica del tendine del bicipite (32%) |
– Polineuropatia sensomotoria bilaterale ascendente – Disautonomia: ipotensione ortostatica, diarrea- costipazione, disfunzione erettile – Coinvolgimento degli occhi: glaucoma, deposizione intravitreale, pupille smerlate |
| Compromissione cardiaca | Costante | Variabile secondo la mutazione causale |
| Uscita cardiaca | – Insufficienza cardiaca (53%-86%) – Disturbi della conduzione – FA (43%-67%) – AoS degenerativo |
– Disturbi della conduzione – Insufficienza cardiaca – FA infrequente (10%) |
| Tecniche diagnostiche | ||
| ECG | – Pattern pseudoinfartuale (63%-66%) – Basso voltaggio (22%-33%) – Sokolow LVH (6%-13%) |
– Modello pseudoinfartuale (18%-69%) – Basso voltaggio (2%-25%) – Sokolow LVH (3%-8%) |
| ECHO | – Ipertrofia moderata-grave – LVEF depressa lieve-moderata (30%) |
– Ipertrofia moderata – LVEF, tipicamente conservato |
| Risonanza magnetica cardiaca | – Valorizzazione tardiva – T1 ed EV nativi elevati |
|
| Scintigrafia 99mTc DPD | – Grado 2-3 | – Grado 0: portatori asintomatici – Grado 1: coinvolgimento cardiaco iniziale – Grado 2-3: Coinvolgimento cardiaco significativo |
AF, fibrillazione atriale; AoS, stenosi aortica; ATTRm, amiloidosi transtiretina mutante; ATTRwt, amiloidosi transtiretina wild-type; ECG, elettrocardiogramma; ECO, ecocardiogramma; EV, volume extracellulare; LVEF, frazione di eiezione ventricolare sinistra; LVH, ipertrofia ventricolare sinistra; TTR, transtiretina.
Le prime mutazioni TTR sono state riportate come polineuropatia amiloide familiare (o malattia di Andrade), e di conseguenza ATTRm è stata considerata fino a poco tempo fa una malattia neurologica. Tuttavia, recenti scoperte mostrano un coinvolgimento cardiaco in più della metà dei casi.3
C’è una forte correlazione genotipo-fenotipo, con mutazioni associate a malattia puramente neurologica o puramente cardiaca.3 Tuttavia, la divisione dell’ATTRm in malattia cardiaca o neurologica può essere una semplificazione eccessiva, poiché c’è una notevole sovrapposizione tra le 2 forme cliniche nello spettro della malattia.
La mutazione Val30Met (ora conosciuta come Val50Met dopo che 20 posizioni sono state aggiunte al nome della mutazione tradizionale in ATTRm) è la mutazione più frequente in tutto il mondo ed è endemica in Portogallo, Giappone e Svezia. La sua incidenza stimata in Portogallo è di 1 ogni 538 abitanti.2 Anche Mallorca (Spagna) e Valverde del Camino (Huelva, Spagna) sono considerate aree in cui l’ATTRm è endemica. La prevalenza stimata a Maiorca in pazienti sintomatici è di 3/100 000 abitanti.5
La mutazione Val30Met causa una condizione prevalentemente neurologica con polineuropatia sensitivo-motoria simmetrica, che inizia negli arti inferiori e segue un andamento ascendente. Può essere associata a disautonomia con ipotensione ortostatica, disfunzione erettile, incontinenza urinaria e sintomi gastrointestinali. Inizia tipicamente alla fine della seconda o terza decade di vita, e fino al 43% dei pazienti ha un coinvolgimento cardiaco che è una frequente causa di morte4 (Tabella 1).
Di particolare rilevanza è la mutazione Val122Ile (p. Val142Ile), che è presente nel 3% al 4% della popolazione nera nordamericana.3 Sebbene la sua penetranza sia incompleta,3 questa mutazione è stata associata a un rischio aumentato del 47% di sviluppare insufficienza cardiaca (HF).6 Uno studio recente ha dimostrato che l’amiloidosi Val122Ile è la quarta causa più comune di HF nella popolazione britannica afro-caraibica.7 Anche se fino al 30% dei pazienti con questa mutazione può avere caratteristiche di lieve neuropatia,6 il fenotipo clinico è solitamente simile a quello di ATTRwt.4 Val122Ile non dovrebbe essere considerata una mutazione esclusiva della popolazione nera, perché può essere presente anche nella popolazione bianca. Per esempio, abbiamo identificato questa mutazione in 4 famiglie bianche spagnole senza antenati neri.
AMILOIDOSI TRANSTIRETINA DI TIPO SELVAGGIO
L’amiloidosi transtiretinica di tipo selvaggio fu descritta per la prima volta nel 1876. In passato era chiamata amiloidosi senile, ma la sua diagnosi in pazienti di età compresa tra 40 e 60 anni ha reso questo termine obsoleto. È interessante notare che il primo caso conosciuto di questa mutazione è stato trovato in un paziente americano di 47 anni.8
L’esatta prevalenza di ATTRwt rimane sconosciuta. Tuttavia, gli studi suggeriscono che è sottodiagnosticata e che può essere la forma più frequente di amiloidosi cardiaca.2,3 I seguenti risultati supportano questa ipotesi:
- –
In pazienti di età superiore a 80 anni, la prevalenza di deposito di TTR è del 25% all’autopsia.3
- –
Nei pazienti con HF con frazione di eiezione preservata (HFpEF), il deposito moderato-grave di TTR è del 5% all’autopsia.9
- –
Nei pazienti di età superiore ai 60 anni ricoverati per HFpEF e ipertrofia ventricolare sinistra (LVH) ≥ 12mm, il nostro gruppo ha recentemente trovato una prevalenza del 13%.10
A differenza di ATTRm, ATTRwt è una malattia sporadica che inizia tipicamente dopo i 70 anni.4 Si trova principalmente negli uomini e le serie pubblicate hanno riportato tassi che vanno dall’89% al 98%.11,12 Tuttavia, in una recente serie di pazienti con diagnosi di ATTRwt in 2 ospedali (Madrid, Spagna e Bologna, Italia), il nostro gruppo ha scoperto che il 20% erano donne. Inoltre, altri studi autoptici hanno suggerito che l’ATTRwt nelle donne potrebbe essere più diffuso di quanto riportato in precedenza. Pertanto il sesso femminile non dovrebbe diminuire il sospetto clinico di ATTRwt (Tabella 1).13
I risultati dell’autopsia mostrano che il deposito di TTR è disperso in diversi organi in ATTRwt. Tuttavia, il deposito è molto maggiore nel cuore a causa del tropismo cardiaco di TTR, e il coinvolgimento cardiaco è la principale manifestazione clinica.4 I pazienti possono presentare sintomi di deposito extracardiaco TTR come stenosi del canale lombare, rottura atraumatica del tendine del bicipite o “segno di Popeye”, e sindrome del tunnel carpale (CTS)3 (Figura 1). Tutte queste caratteristiche possono aiutare a guidare e stabilire prontamente la diagnosi. La CTS può accompagnare altri sottotipi di amiloidosi, ma è più comune in ATTRwt. La deposizione può precedere le manifestazioni cardiache di diversi anni.6 Può essere usata come indicazione nei pazienti anziani con LVH, soprattutto se hanno CTS bilaterale non associata a specifiche attività lavorative e sono in classe funzionale New York Heart Association ≥ II (dati non pubblicati).
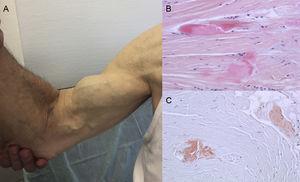
Segni e sintomi dell’amiloidosi transtiretinica. A: rottura non traumatica del tendine del bicipite destro (“segno di Popeye”). B e C: colorazione con ematossilina-eosina (B) e rosso Congo (C), entrambi ×200, di un campione di legamento carpale che mostra fasci di collagene densi con materiale non cellulare. Per gentile concessione della dottoressa Clara Salas Antón.
DIAGNOSI DELL’AMILOIDOSI TRANSTIRETINAPresentazione clinica
L’amiloide può infiltrarsi in qualsiasi struttura cardiaca.1 Tipicamente, la deposizione aumenta lo spessore della parete ventricolare, che causa una graduale diminuzione della distensibilità che porta a una grave disfunzione diastolica. ATTR è stato quindi tradizionalmente incluso come causa di cardiomiopatia restrittiva.
Tuttavia, lo spettro clinico di ATTR è molto più ampio ed eterogeneo. Il sintomo più comune di ATTR è l’HF. Come accennato, uno studio pubblicato dal nostro gruppo nel 2015 ha suggerito che un protocollo basato sulla scintigrafia 99mTc-3,3-difosfono-1,2-propanodicarbossilico (99mTc-DPD) può essere utile per la diagnosi di ATTRwt in una percentuale significativa (13%) di pazienti di età superiore ai 60 anni ricoverati per HFpEF.10 Sulla base di questo risultato, la scintigrafia 99mTc-DPD è stata inclusa nelle linee guida europee del 2016 sulla HF come strumento utile per l’identificazione dei pazienti con ATTR.14 Tuttavia, l’ATTR non dovrebbe essere sospettata esclusivamente nei pazienti con HFpEF perché, con l’avanzare della deposizione amiloidea la funzione contrattile peggiora, e di conseguenza l’ATTR può essere associata a diversi gradi di disfunzione sistolica.
L’amiloidosi transtiretinica è un fenotipo della cardiomiopatia ipertrofica (HCM) e può essere confusa con essa. Un recente studio multicentrico francese ha riportato che il 5% dei pazienti con HCM hanno ATTRm.15 Tuttavia, i nostri risultati non sono in linea con questo alto tasso, che potrebbe essere legato alla grande popolazione nera in Francia.
Anomalie della conduzione cardiaca possono essere la prima manifestazione di ATTR. L’infiltrazione amiloidea del seno e dei nodi atrioventricolari1 può indicare la necessità di un impianto di pacemaker (Tabella 1). Lo studio precedentemente menzionato condotto in Spagna e in Italia ha trovato che i disturbi della conduzione erano la prima manifestazione di ATTRwt nel 7% dei pazienti con questa malattia.13
Anche le aritmie atriali sono molto comuni nei pazienti con ATTRwt13 (Figura 2A), e la prima manifestazione della malattia può essere l’ictus.4 Infatti, il gruppo della Mayo Clinic ha recentemente suggerito che ATTRwt dovrebbe essere escluso nel contesto di una diagnosi di fibrillazione atriale non valvolare (FA) nei pazienti anziani.8 Al contrario, la FA è molto meno comune nei pazienti con ATTRm (Tabella 1).
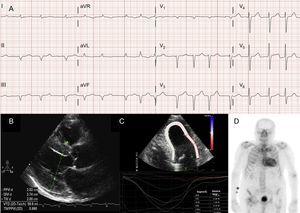
Tecniche diagnostiche nell’amiloidosi cardiaca transtiretinica (ATTR). A: elettrocardiogramma di un paziente con amiloidosi transtiretinica wild-type (ATTRwt), che mostra fibrillazione atriale e pattern pseudoinfartuale nelle derivazioni inferiori. B: ecocardiogramma di un paziente con amiloidosi della transtiretina mutante con mutazione Val30Met, con marcata ipertrofia ventricolare sinistra concentrica e lieve versamento pericardico. C: ceppo regionale longitudinale del paziente con ATTRwt, che mostra valori conservati nel segmento apicale e valori depressi nei segmenti basale e medioventricolare. D, 99mTc-DPD (99mTc-3,3-difosfono-1,2-propanodicarbossilico) scansione di un paziente con ATTRwt, mostrando uptake biventricolare superiore a quello osseo, corrispondente al grado Perugini 3.
Infine, notiamo che ATTR e stenosi aortica degenerativa possono coesistere nello stesso paziente. Nel 2016, diversi studi hanno richiamato l’attenzione su questa possibilità, e uno studio prospettico ha riportato che ATTRwt aveva una prevalenza del 6% nei pazienti di età superiore ai 65 anni sottoposti a sostituzione della valvola aortica.16 Questo studio ha suggerito che i pazienti con entrambe le entità avevano una prognosi postoperatoria molto peggiore di quelli senza ATTRwt (mortalità 50% vs 6,9% dopo un follow-up mediano di 2,3 anni).16 Un altro studio recente con scintigrafia 99mTc-DPD in 43 pazienti con stenosi aortica a basso flusso/basso gradiente ha identificato 5 pazienti con ATTRwt (prevalenza 12%). 17 I pazienti con stenosi aortica grave e ATTRwt condividono lo stesso profilo demografico, e il trattamento appropriato per i pazienti con entrambe le malattie deve ancora essere determinato.
Utilità delle tecniche diagnostiche
La diagnosi di ATTR è una sfida nella pratica clinica quotidiana. Anche se l’elettrocardiografia e l’ecocardiografia hanno un ruolo nella diagnosi, le nuove tecniche non invasive hanno acquisito un ruolo chiave nella valutazione dei pazienti con ATTR.
Elettrocardiogramma
L’associazione tra bassa tensione e amiloidosi cardiaca è stata a lungo considerata indiscutibile.3 I criteri più utilizzati nella pratica clinica sono l’ampiezza del QRS 1 Sebbene i bassi voltaggi elettrocardiografici in presenza di LVH dovrebbero stabilire il sospetto, la prevalenza in una serie contemporanea di ATTR è stata del 20%-25%.3,4,13 La prevalenza varia anche in base ai criteri applicati. Per esempio, l’uso del criterio di Sokolow (onda S nella derivazione V1 + onda R nella derivazione V5 o V6
1,5 mV) può aumentare la prevalenza calcolata tra il 46% e il 58%.13 Il rapporto tra lo spessore della parete ventricolare sinistra e il voltaggio QRS totale è stato raccomandato per valutare meglio le disparità tra i risultati delle 2 tecniche.2,3 Tuttavia, fino al 20% dei pazienti con ATTR può soddisfare i criteri elettrocardiografici per LVH.2,3
Nella maggior parte delle serie di pazienti con amiloidosi cardiaca, il pattern pseudoinfartuale è il reperto elettrocardiografico più comune2,3,13 (Figura 2A). A causa del possibile coinvolgimento del sistema di conduzione, sono comuni anche blocchi di branca completi o incompleti.3
Ecocardiografia
Anche se l’ecocardiografia è la pietra miliare della diagnosi iniziale di ATTR, nessun risultato è specifico.3 L’amiloidosi transtiretinica è stata tipicamente associata a un ventricolo sinistro normale o piccolo con ipertrofia concentrica.3 Il 10° Simposio Internazionale sull’Amiloide e l’Amiloidosi tenutosi nel 2004 ha stabilito il criterio ecocardiografico della cardiopatia dovuta alla AL in assenza di altre cause di LVH come presenza di LVH con un cutoff di 12 mm per lo spessore della parete del setto interventricolare.4 Questo criterio è stato successivamente estrapolato ad altre forme di amiloidosi (Figura 2B), che ha conferito un alto grado di specificità ma una bassa sensibilità.
Anche se l’LVH concentrico è stato classicamente descritto, le serie attuali suggeriscono che circa il 20% ha un LVH asimmetrico.13
Nonostante la classica associazione tra una frazione di eiezione ventricolare sinistra (LVEF) normale o leggermente diminuita e l’amiloidosi cardiaca,2 il range LVEF è altamente variabile.8 In un recente studio condotto presso la Mayo Clinic, una LVEF 8 mentre nella nostra serie una LVEF 13 Inoltre, l’uso della LVEF nella valutazione della funzione sistolica nell’amiloidosi cardiaca è limitato, perché valori leggermente depressi sono già indicativi di una malattia cardiaca rilevante. Questa limitazione può essere superata con l’uso delle velocità Doppler dei tessuti, dell’imaging della deformazione e della frazione di contrazione miocardica, che sono stati proposti come indici più appropriati per valutare la funzione cardiaca.2
Altri segni ecocardiografici classici sono l’ipertrofia ventricolare destra, la dilatazione biatriale, il lieve versamento pericardico, l’ispessimento della valvola atrioventricolare, l’ispessimento della parete del setto atriale e l’aspetto granulare del miocardio.3,6 Tuttavia, poiché alcune di queste caratteristiche sono state osservate in una serie altamente selezionata di pazienti in fasi avanzate della malattia, non tutte devono essere presenti per stabilire il sospetto.1
L’imaging delle deformazioni regionali è una tecnica molto utile per la diagnosi precoce dei pazienti con ATTR. Nei pazienti con ATTR, la deformazione longitudinale è depressa nei segmenti basali e medioventricolari ma è conservata nei segmenti apicali18 (Figura 2C). Questo modello tipico può essere utile nella diagnosi differenziale di ATTR da altre malattie cardiache.4
Biomarcatori
Ci sono meno dati sul ruolo del pro-ormone N-terminale del propeptide natriuretico cerebrale (NT-proBNP) e della troponina in ATTR rispetto a quelli presenti in AL.4 I livelli di NT-proBNP in ATTR sono tipicamente più bassi che in AL,4 riflettendo 2 diversi meccanismi fisiopatologici: tossicità diretta della catena leggera in AL vs danno tissutale indotto dalle protofibrille in ATTR.
Di recente, il gruppo della Mayo Clinic ha proposto un sistema di stratificazione simile a quello in vigore per AL. In una coorte di 360 pazienti con ATTRwt, entrambi i biomarcatori hanno dimostrato di essere predittori di mortalità. I pazienti dello stadio III (NT-proBNP > 3000 pg/mL e troponina T > 0,05 ng/mL) avevano una sopravvivenza mediana di 20 mesi, mentre i pazienti dello stadio I e II avevano una sopravvivenza mediana di 66 mesi e 40 mesi (nessun biomarcatore o solo 1 biomarcatore sopra i punti di cutoff stabiliti, rispettivamente).
Risonanza magnetica cardiaca
La risonanza magnetica cardiaca (CMRI) può essere utilizzata per ottenere informazioni strutturali e funzionali e caratterizzare la composizione del tessuto miocardico.3 La CMRI è essenziale nell’identificazione precoce dell’ATTR, e nella sua diagnosi differenziale da altre malattie cardiache.
La caratterizzazione del tessuto tramite CMRI si basa sulle seguenti caratteristiche:
- –
L’enhancement tardivo: Un pattern globale subendocardico è praticamente patognomonico dell’amiloidosi cardiaca, ma è presente solo in circa un quarto dei pazienti. Altri modelli, come transmurale (il più comune) o patching, sono anche compatibili (Figura 3). Nonostante la sua alta sensibilità e specificità, si deve tener conto che ci può essere una possibile assenza di enhancement tardivo (15% dei pazienti) e, nella nostra esperienza, una percentuale non trascurabile di falsi negativi per motivi tecnici.3 Il pattern di enhancement transmurale è associato a una prognosi peggiore ed è un predittore indipendente di mortalità.19
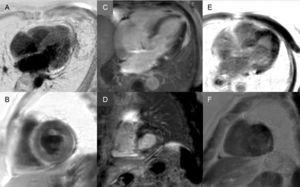 Figura 3.
Figura 3.Diversità dei modelli di valorizzazione tardiva con risonanza magnetica cardiaca nell’amiloidosi transtiretinica. A e B: sequenze di valorizzazione tardiva, piano 4 camere e asse corto a livello medio, rispettivamente, di un paziente con amiloidosi mutante della transtiretina (ATTRm), che mostra un diffuso deposito patologico transmurale di gadolinio. C e D: sequenze di potenziamento tardivo, 4 camere e livello basale dell’asse corto, rispettivamente, di pazienti con ATTRm che mostrano deposizione patologica di gadolinio con un modello a chiazze, con area focale inferiore inferoseptale e inferolaterale basale. E e F, sequenze di potenziamento tardivo, piano 4-camera e asse corto a livello apicale, rispettivamente, di pazienti con ATTRm, mostrando ampia deposizione patologica transmurale, tranne nei segmenti basale e medio anterolaterale. Per gentile concessione del Dr Jesús González Mirelis.
(0.15MB). - –
Tempo T1 lungo: La mappatura T1 è una tecnica in cui un segnale miocardico quantitativo viene misurato prima (T1 nativo) o dopo la somministrazione del contrasto. I tempi T1 nativi sono molto lunghi nell’amiloidosi cardiaca.3 La mappatura T1 non richiede la somministrazione di contrasto e quindi può essere utilizzata nell’insufficienza renale. I tempi T1 possono anche essere anormale prima LVH è osservato.3 tempi T1 sono più lunghi in ATTR che in HCM e controlli (1097ms ± 43 ms vs 1026ms ± 64 ms vs 9.67ms ± 34ms, rispettivamente; P
ms ± 68 ms; P = 0,01).20
La somministrazione di contrasto può essere utilizzato per calcolare il volume extracellulare (ECV) e valutare gli aumenti di spazio extracellulare. I valori di ECV nell’amiloidosi cardiaca sono più alti che in altre malattie cardiache, tranne che nelle zone di infarto miocardico.21 Nel 2016, il nostro gruppo, in collaborazione con altri centri nazionali, ha riferito che la quantificazione dell’ECV può identificare il coinvolgimento cardiaco nell’ATTRm e, per la prima volta, lo ha correlato con il grado di compromissione neurologica, sostenendo l’uso di questa tecnica nella diagnosi precoce e nel monitoraggio dell’ATTRm.22
La mappatura T1 quantitativa e le tecniche di calcolo dell’ECV possono essere molto utili in ATTR per la diagnosi precoce, il follow-up clinico e la valutazione della risposta al trattamento (Figura 4).
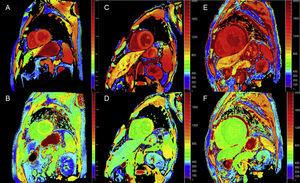
Mappatura T1, prima e dopo il contrasto, con modified look-locker inversion-recovery (MOLLI) in risonanza magnetica cardiaca 3T in controllo sano, paziente con amiloidosi di transtiretina, e paziente con amiloidosi primaria a catena leggera. A e B: mappatura T1 nativa e volume extracellulare (EV), rispettivamente, in un controllo sano, mostrando valori normali (EV = 0,214). C e D: mappatura T1 nativa ed EV, rispettivamente, in un paziente con amiloidosi mutante della transtiretina con danno neurologico e coinvolgimento cardiaco incipiente, T1 nativo elevato e EV leggermente elevato (0,361). E e F: mappatura T1 nativa ed EV, rispettivamente, in un paziente con amiloidosi cardiaca da transtiretina wild-type, T1 nativa elevata ed EV molto elevata (0,626), che riflette una massiccia infiltrazione amiloide. Per gentile concessione del Dr Jesús González Mirelis.
Scintigrafia cardiaca
Negli anni ’80, l’osservazione della captazione cardiaca di diversi traccianti a base di difosfonato osseo è stata istologicamente correlata alla presenza di amiloidosi cardiaca.23 Il meccanismo di captazione non è ben caratterizzato, ma potrebbe essere correlato al contenuto di calcio dei depositi amiloidi.
Un primo studio del gruppo di Bologna utilizzando il 99mTc-DPD ha trovato la captazione cardiaca in 15 pazienti con ATTR e la sua assenza in 10 pazienti con AL, utilizzando un punteggio basato sulla captazione biventricolare uguale o superiore alla captazione ossea (punteggio Perugini)24 (Figura 2D). Risultati simili sono stati successivamente riportati dal nostro gruppo e da altri.25 Un lieve assorbimento (punteggio 1) e un moderato assorbimento (punteggio 2) possono essere riscontrati rispettivamente nel 30% e nel 10% dei pazienti con AL.24
Data la sua elevata sensibilità e specificità, questa tecnica è estremamente utile per stabilire una diagnosi di ATTR e può mostrare un coinvolgimento cardiaco anche quando l’ecocardiografia e la risonanza magnetica sono ancora normali. Infatti, dopo la scintigrafia per indicazioni oncologiche o reumatologiche, i risultati incidentali di ATTR non sono rari.26
La Tc-DPD non è disponibile negli Stati Uniti, ma risultati simili sono stati riportati utilizzando l’imaging 99mTc-PYP (pirofosfato).27
Altri radiotraccianti sono attualmente allo studio. Per esempio, il 18F-florbetapir, che è già stato approvato per l’imaging della beta-amiloide cerebrale,4 è stato studiato in pazienti con AL e ATTR. I risultati mostrano che il 18F-florbetapir può rilevare i depositi miocardici di AL e ATTR.28 Sebbene i dati disponibili siano stati ottenuti in studi di casi29 e il costo elevato di questo radiotracciante ne limiti l’uso, sono in corso diversi studi sul potenziale vantaggio del suo uso rispetto a quello della Tc-DPD come tecnica di screening per i 2 tipi più comuni di amiloidosi.
Diagnosi invasiva
La diagnosi definitiva di ATTR si basa sulla dimostrazione istologica di fibrille amiloidi. Anche se ci può essere deposizione extracardiaca, la probabilità di dimostrare l’amiloide per istologia varia in base all’organo.2 Ci sono pochi studi sul rapporto costo-efficacia della biopsia extracardiaca (ad esempio, grasso addominale, gengiva, ghiandola salivare, gastrointestinale) in ATTR, che è maggiore in ATTRm che in ATTRwt. Tuttavia, una biopsia negativa di un organo clinicamente non colpito non esclude una diagnosi di ATTR.4
Come nell’ATTRwt, la biopsia endomiocardica è indicata nei pazienti senza coinvolgimento extracardiaco o con sola malattia cardiaca.3,4 La biopsia endomiocardica è una procedura a basso rischio (soprattutto nei centri esperti) e gli errori di campionamento sono improbabili.6
Dopo la conferma istologica dell’amiloidosi, che a volte può richiedere l’interpretazione da parte di personale esperto,6 la corretta classificazione del sottotipo è fondamentale.4 Attualmente, la classificazione dipende da una combinazione di immunoistochimica, analisi genetica e proteomica:
- –
L’immunoistochimica si basa sull’uso di anticorpi specifici contro proteine amiloidi note. Anche se i risultati di questa tecnica sono tipicamente definitivi, è meno sensibile nel riconoscimento delle catene leggere.4
- –
Questa limitazione può essere superata dall’uso della spettrometria di massa, che fornisce risultati definitivi ed è il criterio standard nella conferma del sottotipo amiloide.2 Anche se questa tecnica è disponibile solo in centri specializzati, è particolarmente utile nei casi inconcludenti o nei casi che sono positivi per diversi anticorpi all’immunoistochimica, che nella nostra esperienza si verifica in circa il 20% al 30% dei casi. 4
- –
Poiché le tecniche cliniche o istologiche non possono distinguere ATTRm da ATTRwt, gli studi genetici sono raccomandati in tutti i casi di ATTR. La scoperta di una mutazione causale può essere importante per offrire consulenza genetica e follow-up ai portatori asintomatici, 4,30 che potrebbero beneficiare delle prossime terapie che ritardano o addirittura prevengono l’insorgenza della malattia.31
Diagnosi non invasiva
Fino a poco tempo fa, gli studi istologici erano considerati essenziali nella diagnosi di ATTR.3 Tuttavia, per facilitare la diagnosi, nel 2016 uno studio multicentrico internazionale ha proposto un nuovo algoritmo per la diagnosi non invasiva di ATTR.32
Lo studio ha analizzato i risultati di 1217 pazienti. La presenza di segni classici di amiloidosi cardiaca mediante tecniche di imaging, l’uptake di grado 2 o 3 di Tc-DPD/PYP alla scintigrafia e l’assenza di una proteina monoclonale avevano una specificità e un valore predittivo positivo per ATTR del 100%32 (Figura 5).
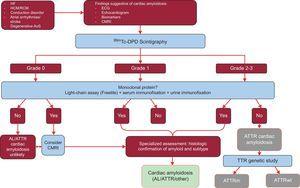
Algoritmo diagnostico per pazienti con sospetta amiloidosi cardiaca. Sistema di classificazione della scintigrafia 99mTc-DPD: grado 0, nessun uptake cardiaco; grado 1, uptake leggermente inferiore a quello dell’osso; grado 2, uptake moderato uguale a quello dell’osso; grado 3, uptake grave superiore a quello dell’osso. ACV, ictus; AL, amiloidosi primaria a catena leggera; AoS, stenosi aortica; ATTR, amiloidosi da transtiretina; ATTRm, amiloidosi da transtiretina mutante; ATTRwt, amiloidosi da transtiretina wild-type; CMRI, risonanza magnetica cardiaca; ECG, elettrocardiogramma; HCM, cardiomiopatia ipertrofica; HF, insufficienza cardiaca; RCM, cardiomiopatia restrittiva; TTR, transtiretina.
Una caratteristica fondamentale di questo algoritmo è l’assenza di una proteina monoclonale che potrebbe causare AL sul test della catena del siero (Freelite, The Binding Site, UK) e sull’elettroforesi di immunofissazione di sangue e urina. La presenza di una proteina monoclonale è un’indicazione per la biopsia endomiocardica per distinguere tra ATTR e AL.32 Fino al 5% della popolazione con più di 65 anni ha una gammopatia monoclonale di significato indeterminato.2 Negli individui anziani, un aumento moderato delle catene leggere circolanti non dovrebbe portare direttamente a una diagnosi di AL. È stato riportato che fino al 10% dei pazienti anziani con ATTRwt e gammopatia monoclonale di significato indeterminato nei centri di riferimento aveva precedentemente ricevuto una diagnosi errata di AL.3,33 Una diagnosi corretta è necessaria per evitare una chemioterapia inappropriata. È interessante notare che il nostro ospedale ha documentato 2 casi di pazienti con mieloma multiplo e ATTRwt concomitante sulla spettrometria di massa.
Trattamento dell’amiloidosi cardiaca transtirrenica
Il trattamento dei pazienti con ATTR ha 2 obiettivi: fornire supporto medico e, se possibile, fermare o ritardare la deposizione di amiloide con l’uso di trattamenti specifici.
Trattamento medico
Le seguenti sezioni descrivono la cura cardiaca di supporto per i pazienti con ATTR.
Gestione dell’insufficienza cardiaca
L’evolemia deve essere mantenuta nei pazienti con amiloidosi cardiaca. La dieta e lo stile di vita sono molto importanti. I diuretici sono fondamentali per il trattamento dell’HF in ATTR. Tuttavia, poiché l’uso eccessivo di diuretici può portare all’ipotensione (frequentemente a causa della disfunzione autonomica) e peggiorare la situazione clinica, soprattutto in ATTRm, deve essere esercitata estrema attenzione nella sua gestione.
Nel trattamento dell’HF in ATTR, deve essere preso in considerazione che la disfunzione diastolica compromessa e il volume ridotto dello stroke portano alla tachicardia compensatoria per mantenere la portata cardiaca. Pertanto, i beta-bloccanti devono essere utilizzati con cura e individualizzati per ogni paziente. La pratica standard è quella di rimuoverli in assenza di difficoltà nel controllo della frequenza cardiaca. Questo approccio è ancora più importante, se possibile, in ATTRwt a causa della frequente presenza di disturbi della conduzione.6 I calcio antagonisti e la digossina possono legarsi alle fibrille amiloidi e sono quindi controindicati in ATTR a causa del rischio di tossicità anche a dosi terapeutiche.6
Al contrario della HF con disfunzione sistolica dovuta ad altre eziologie, non ci sono prove a sostegno di un beneficio prognostico dovuto all’uso di beta-bloccanti, inibitori dell’enzima di conversione dell’angiotensina o antagonisti del recettore dell’angiotensina II nell’amiloidosi cardiaca. Infatti, il loro uso può portare ad un peggioramento clinico dovuto all’ipotensione e alla bassa produzione: una recente pubblicazione ha riportato una prognosi peggiore in ATTRm e un effetto neutro in ATTRwt.34
Gestione delle aritmie atriali
La gestione della FA in ATTR è una sfida. Il mantenimento del ritmo sinusale a lungo termine è difficile. Tuttavia, la cardioversione elettrica può essere tentata perché può portare ad un miglioramento clinico.
Il rischio tromboembolico nei pazienti con ATTR è molto alto. Inoltre, l’infiltrazione amiloidea cronica può portare a una disfunzione atriale meccanica, che può essere la causa sottostante allo sviluppo di un trombo atriale in alcuni pazienti senza FA. La terapia anticoagulante in ATTR non dovrebbe essere basata sul punteggio CHADS2-VASC e dovrebbe essere la terapia standard nella FA. Gli eventi emorragici sono meno comuni che nell’AL, e quindi alcuni ospedali raccomandano la terapia anticoagulante nei pazienti con ritmo sinusale se c’è una scarsa funzione atriale secondo le velocità Doppler transmitrali. Anche se non ci sono studi comparativi sull’efficacia degli anticoagulanti orali diretti rispetto agli antagonisti della vitamina K, il nostro ospedale ha somministrato anticoagulanti orali diretti a pazienti selezionati.
Ruolo dei dispositivi
Le attuali raccomandazioni per l’impianto di pacemaker sono le stesse in ATTR e nella popolazione generale. Tuttavia, alcuni gruppi favoriscono l’impianto profilattico, soprattutto nei pazienti con ATTRm e disturbi della conduzione.35 Noi non favoriamo questa strategia preventiva e non abbiamo trovato un tasso così alto di disturbi della conduzione da giustificare l’impianto profilattico nei pazienti con ATTRm.
Il ruolo dell’uso del cardioverter-defibrillatore impiantabile (ICD) in ATTR non è ben stabilito. In una piccola serie, l’impianto dell’ICD non ha migliorato significativamente la sopravvivenza, anche se ha avuto un effetto appropriato in più pazienti durante i primi 2 anni.36
Trapianto di cuore
Il trapianto di cuore ha giocato un ruolo minore nell’ATTR perché l’ATTRm può coinvolgere vari organi e l’ATTRwt colpisce tipicamente pazienti anziani. Tuttavia, l’assenza di coinvolgimento extracardiaco nei pazienti con ATTRwt li rende buoni candidati per la procedura. La letteratura fornisce esempi di trapianti riusciti in pazienti di età inferiore ai 70 anni con ATTRwt o con ATTRm e coinvolgimento cardiaco predominante.4
Trattamento specifico dell’amiloidosi cardiaca da transtiretina
Al momento non esiste una terapia approvata per il trattamento specifico dell’amiloidosi cardiaca ATTR, sebbene il trapianto di fegato (TxH) da solo o in combinazione con il trapianto di cuore sia stato usato nell’ATTRm dagli anni ’90 come un modo per eliminare la fonte principale di precursore TTR.4
Trapianto di fegato
Il Registro Mondiale dei Trapianti di Polineuropatia Amiloidotica Familiare37 ha riportato che più di 2000 pazienti con ATTRm sono stati sottoposti a TxH in 20 paesi.4 I pazienti con la mutazione Val30Met e un quadro clinico prevalentemente neurologico hanno un tasso di sopravvivenza superiore al 50% a 20 anni.3 Questi risultati promettenti si basano su una rigorosa selezione dei pazienti in base all’età, al tipo di mutazione e allo stadio della malattia. L’indicazione più comunemente accettata per la TxH è la combinazione di giovane età, mutazione Val30Met e stadio iniziale della malattia.
Tuttavia, le principali limitazioni di questa tecnica sono la carenza di donatori, la necessità di immunosoppressione cronica, l’età avanzata al momento della presentazione e i risultati peggiori ottenuti nei pazienti con mutazioni diverse dalla mutazione Val30Met.
Inoltre, la soppressione teorica della produzione della proteina mutata è contrastata dal deposito progressivo di TTR nativa post-impianto,4,6 il cui meccanismo non è completamente compreso. Infatti, la deposizione di TTR cardiaca dopo la TxH influisce sulla morbilità e la mortalità.
La necessità di comprendere meglio la patogenesi dell’ATTR e i limiti della TxH ha stimolato lo sviluppo di diversi farmaci.
Questi nuovi composti agiscono in diversi punti della cascata di amiloidogenesi della TTR (Figura 6). Il trattamento comporterà sempre la riduzione della proteina precursore, anche se evitare i depositi ed eliminare quelli esistenti sarà altrettanto importante. Pertanto, crediamo che, in futuro, l’approccio a questa malattia sarà sotto forma di trattamento combinato.
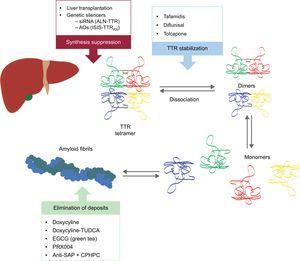
Terapie specifiche nell’amiloidosi cardiaca da transtiretina e obiettivi principali. AntiSAP + CPHPC, antisiero componente amiloide P + (R)-1–6-oxo-esanoil]acido pirrolidin-2-carbossilico; AOs, oligonucleotidi antisenso; EGCG, epigallocatechina-3 gallato; siRNA, small interfering RNA; TTR, transtiretina; TUDCA, acido tauroursodesossicolico.
Suppressione della sintesi della transtiretina
Sono in corso due linee di ricerca sull’inibizione dell’espressione epatica della TTR: l’uso di piccoli RNA interferenti (siRNA) e l’uso di farmaci oligonucleotidi antisenso (AO).
- –
I siRNA sono molecole di RNA a doppio filamento che mettono a tacere le sequenze di RNA messaggero legandosi specificamente ad esse, impedendo la formazione di proteine. Si è scoperto che Patisiran (ALN-TTR02) riduce la produzione di TTR dell’80%.38 Nei pazienti con ATTRm, la riduzione di TTR era dell’87%.39 Uno studio di fase 2 ha mostrato risultati promettenti, dimostrando parametri ecocardiografici, funzionali e analitici stabili a 12 mesi e 24 mesi.40 I risultati dello studio neurologico di fase 3 nei pazienti con ATTRm e una sottoanalisi dei pazienti con coinvolgimento cardiaco sono attesi nel 2017 (Tabella 2). Un altro farmaco, revusiran (ALN-TTR01), viene somministrato per via sottocutanea e differisce da patisiran per le nanoparticelle lipidiche che incapsulano il siRNA. Questo farmaco è stato oggetto di uno studio clinico di fase III in pazienti con ATTRm che hanno malattie cardiache. Lo studio è stato interrotto l’anno scorso a causa di un aumento inaspettato della mortalità nel gruppo di trattamento (Tabella 2).
Tabella 2.Principali studi clinici in corso nell’amiloidosi cardiaca transtiretinica
Meccanismo d’azione Composto Trial Design Pazienti (N) e sottotipo ATTR Intervento Esiti primari Situazione/risultati Sopressione della sintesi TTR Patisiran (ALN-TTR02) NCT01961921 Studio di fase II, multicentrico 27
ATTRm (11 coinvolgimento del cuore)Patisiran 0.30 mg/kg IV ogni 3 settimane per 2 anni Sicurezza a lungo termine. Punti finali secondari: effetto su disturbi neurologici e parametri cardiaci Farmaco ben tollerato, con profilo di sicurezza simile nel fenotipo neurologico e cardiaco
Troponina I, NT-proBNP e dati ecocardiografici sono rimasti stabili a 12 mo e 24 moNCT01960348 (APOLLO) Fase III, randomizzata, in doppio cieco, controllata con placebo, multicentrica 225
ATTRm con coinvolgimento neurologicoPatisiran infusione IV vs placebo 2:1 Cambiamenti in mNIS+7 Previsto novembre 2017
Sottoanalisi dei pazienti con coinvolgimento cardiaco previstoNCT02510261 Studio di estensione diAPOLLO Patisiran infusione IV vs placebo 2:1 per 52 settimane Sicurezza ed effetti avversi a lungo termine In corso Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Fase III, randomizzato, in doppio cieco, controllato con placebo 206
ATTRm con coinvolgimento del cuoreRevusiran 500mg 5 d, poi settimanalmente per 2 anni vs placebo Cambiamenti nel test del cammino di 6 metri e nei valori plasmatici di TTR Cessato a causa dell’aumento della mortalità nel braccio revusiran ISIS-TTRRX NCT01737398 Fase II/III, randomizzato, in doppio cieco, controllato con placebo, multicentrico 172
ATTRm con neuropatia; 50% di coinvolgimento cardiaco concomitanteISIS-TTRRX 300mg SC ogni 12 h per 1 settimana, poi settimanalmente per 64 settimane vs placebo Cambiamenti nel mNIS+7 e nel questionario Norfolk sulla qualità della vita Atteso per settembre 2017
Segnalati casi di grave trombocitopenia e sanguinamento
Analisi dei parametri ecocardiografici e NT-proBNP previsto in pazienti senza ipertensione con LVH > 12 mmTrattamento della cardiomiopatia TTR con oligonucleotide antisenso specifico TTR Fase II, open-label, non randomizzato 20
ATTRm con coinvolgimento cardiaco e ATTRwtISIS-TTRRX 300mg SC ogni 12 h/settimana Parametri ecocardiografici e MRI cardiaca vs controlli storici Nessun deterioramento dello sforzo e diminuzione della massa LV di circa 5%
6 pazienti hanno completato 12 mo; 15 pazienti 6 mo; 1 paziente TxCNCT02627820 Fase II, in aperto, non randomizzato 50
ATTRwtISIS-TTRRX 300mg SC ogni 12 h per 1 settimana, poi 1 settimana per 18 settimane Cambiamenti nella deformazione misurata dallo speckle tracking Cancellato senza iniziare il reclutamento dei pazienti Studio di fase III con ISIS-TTRRX per il trattamento della cardiopatia da amiloide TTR Fase III, randomizzato, in doppio cieco, controllato con placebo, multicentrico 490
ATTRwt e ATTRm con coinvolgimento del cuoreISIS-TTRRX 300mg SC ogni 12 h per 1 settimana, poi settimanale per 16 settimane con placebo, poi settimanalmente per 24 mo Morte, TxC, o ricovero per cause cardiovascolari In attesa Stabilizzazione di TTR Tafamidis NCT01994889 Fase III, randomizzato, in doppio cieco, controllato con placebo, multicentrico 441
ATTRwt e ATTRm con coinvolgimento cardiacoTafamidis 20mg o 80mg per via orale ogni 24 h per 30 mesi vs placebo Mortalità per tutte le cause emortalità per cause e ospedalizzazione cardiovascolare Fine febbraio 2018 NCT02791230 Estensione Fase III NCT01994889 330
ATTRwt e ATTRm con coinvolgimento cardiacoTafamidis 20 mg o 80 mg per via orale ogni 24 h per 60 mo Tutti-mortalità per tutte le cause e incidenza di effetti avversi Previsto per dicembre 2021 NCT00935012 Fase II, in aperto, studio di efficacia e sicurezza 31
ATTRwt o ATTRm p.Val122Ile con coinvolgimento cardiacoTafamidis 20mg per via orale Sicurezza ed efficacia In corso fino a dicembre 2021 Diflunisal NCT00294671 Fase III, randomizzato, doppio cieco, controllato con placebo, multicentrico 130
ATTRm con fenotipo neurologico (50% con coinvolgimento cardiaco)Diflunisal 250mg per via orale ogni 12 h vs placebo oltre 24 mo NIS+7 a 24 mo NIS+7 diflunisal vs placebo 16.3 (P Nessuna riduzione dello spessore ventricolare o dello sforzo nei pazienti con coinvolgimento del cuore vs placebo Eliminazione dei depositi Doxycycline + TUDCA/UDCA NCT01171859 Fase II, open-label, non randomizzato, prospettico 40
ATTR (25 ATTRm, 13 ATTRwt, e 2 destinatari di trapianto di fegato domino)Dossiclina 100 mg ogni 12 h + TUDCA 250 mg ogni 8 h per 12 mo, poi 6 mo senza terapia Aumento 14 pazienti si sono ritirati
Reazioni cutanee avverse, 16 pazienti
68% dei 25 pazienti valutabili ha soddisfatto l’endpoint primario
Miglioramento complessivo della tensione a 12 mo e peggioramento dopo 6 mo senza terapiaNCT01855360 Fase II, open-label, non randomizzato, prospettico vs controlli storici 30
Amiloidosi ATTR cardiaca (27 ATTRwt e 3 ATTRm). Controlli storici, 14 pazienti ATTRwtDossiciclina 100 mg ogni 12 h + TUDCA 250 mg ogni 8h per 18 mo Cambiamenti nella deformazione longitudinale ogni 6 mo 22 pazienti hanno completato lo studio e sono stati valutabili
Maggiore deterioramento della deformazione nei controlli vs gruppo di trattamento
Incremento di NT-proBNP nel gruppo di trattamento; non misurato nei controlliNCT01677286 Fase II, open-label, non randomizzato, prospettico 25
Amiloidosi sistemica (6 ATTRwt e 3 ATTRm)Dossiclina 100 mg ogni 12 h per 12 mesi Sicurezza del farmaco
Risposta degli organi interessatiPeggioramento di NT-proBNP e funzione renale
Nessun miglioramento in altri parametri studiati
Il 60% dei pazienti ha avuto complicazioni cutanee e il 30% si è ritirato a causa di problemi cutanei o gastrointestinaliNCT01171859 Fase II, open-label, non randomizzato, prospettico 45
35 con coinvolgimento del cuore; 25 ATTRm; 5 ATTRm con TxH; 13 ATTRwt; e 2 destinatari di trapianto di fegato dominoDossiciclina 100 mg ogni 12 h + TUDCA 250 mg ogni 8 h per 12 mo
Successiva fase di follow-up senza trattamento per 6 moRisposta al farmaco definita come una Risposta cardiaca valutata in 25 pazienti
68% ha avuto risposta cardiaca
Incremento di NT-proBNP e deterioramento dello sforzo durante il follow-up senza trattamento
Alto numero di ritiri a causa di effetti avversi
14 ritirati nella fase di trattamento e 5 interrotti nella fase senza trattamentoEffetto della doxiciclina + UDCA su ATTR Fase II, in aperto, non randomizzato, prospettico 28
ATTR con coinvolgimento cardiaco (27 ATTRm e 1 ATTRwt)Dossiclina 200 mg/d per 4 settimane, poi sospesa 2 settimane, poi UDCA 750 mg/d per 12 mo
Fase successiva di follow-up senza trattamento per 6 moCambiamenti in NT-proBNP e punteggio Kumamoto Solo il 14% ha completato lo studio e il 36% ha completato 12 mo
Nessun cambiamento in NT-proBNP a 6 mesi e peggioramento a 12 mesi
LVH stabile
Peggioramento del punteggio Kumamoto a 12 mesiEGCG NCT01171859 Fase II, open-label, non randomizzato, prospettico 25
ATTRwt600 mg, EGCG per 12 mo Cambiamenti in ECHO e risonanza magnetica cardiaca (n = 14) Riduzione della massa LV del 6% con risonanza magnetica cardiaca (P = 0.03)
LVEF, spessore miocardico e MAPSE da ECHO invariatoAntiSAP + CPHPC NCT03044353 Fase II, open-label, randomizzato 40
Corte 1: amiloidosi ATTR cardiaca
Corte 2: amiloidosi primaria dopo 6 mo di chemioterapiaAnti-SAP + CPHPC mensilmente per 6 mo Riduzione del carico amiloide tramite RM cardiaca e ECHO Inizio nel 2017 AntiSAP + CPHPC, antisiero componente amiloide P + (R)-1–6-oxo-esanoil]acido pirrolidin-2-carbossilico; ATTRm, amiloidosi mutante della transtiretina; ATTRwt, amiloidosi della transtiretina wild-type; BNP, peptide natriuretico cerebrale; ECHO, ecocardiogramma; EGCG, epigallocatechina-3 gallato; IV, intravenosa; LV, ventricolo sinistro; LVEF, frazione di eiezione ventricolare sinistra; LVH, ipertrofia ventricolare sinistra; MAPSE, escursione sistolica piano mitrale anulare; mNIS, Modified Neuropathy Impairment Score; MRI, risonanza magnetica; NIS, Neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, amino-terminal pro-brain natriuretic peptide; SC, subcutaneous; TTR, transthyretin; TUDCA, tauroursodeoxycholic acid; TxC, heart transplant; TxH, liver transplant; UDCA, ursodeoxycholic acid.
- –
Gli AO sono brevi filamenti di oligonucleotidi che si legano specificamente all’RNA, impedendo la traduzione e la sintesi delle proteine target.4 ISIS-TTRRX è un AO sottocutaneo, con dimostrate riduzioni dose-dipendenti dei valori di TTR dal 75% al 90% in volontari sani.4 La sperimentazione di fase III in pazienti con ATTRm e fenotipo neurologico è terminata a marzo 2017 e i suoi risultati sono attesi entro la fine del 2017. Tuttavia, la US Food and Drug Administration ha posticipato l’inizio di uno studio di fase III in pazienti con ATTRwt e ATTRm con malattia cardiaca a causa di casi di grave trombocitopenia nello studio neurologico (Tabella 2). Poiché il 50% dei partecipanti allo studio neurologico aveva una malattia cardiaca, i risultati di questo sottostudio cardiaco determineranno se la sperimentazione di fase III verrà ripresa. D’altra parte, ci sono dati preliminari da uno studio di fase II in aperto. In questo studio, 22 pazienti con ATTRwt e ATTRm con malattia cardiaca hanno ricevuto un’iniezione settimanale di ISIS-TTRRX. Secondo il rapporto, il profilo di sicurezza del farmaco è molto favorevole e i dati intermedi sulla progressione della malattia cardiaca tramite CMR, NT-proBNP e test dei 6 minuti sono positivi.41
Stabilizzazione della transtiretina
La dissociazione del tetramero TTR in subunità è un passo cruciale nella formazione delle fibrille ATTR. Diflunisal e tafamidis sono 2 stabilizzatori TTR con efficacia dimostrata nella polineuropatia ATTRm.
- –
Tafamidis è una piccola molecola somministrata per via orale che si lega a TTR nei siti di legame T4 stabilizzando la proteina e impedendo la sua dissociazione. Dopo la pubblicazione dei risultati di uno studio randomizzato in doppio cieco in 125 pazienti con ATTRm e la mutazione Val30Met nelle fasi iniziali della malattia neurologica,42 l’Agenzia Europea dei Medicinali ha approvato il suo uso nel 2011 come medicinale orfano per ritardare la progressione neurologica. Dati recenti dimostrano l’efficacia del farmaco per raggiungere la stabilità neurologica in almeno il 60% dei partecipanti dopo più di 4 anni di follow-up. Ad oggi, ha un uso limitato nella malattia ATTR e cardiologica. Uno studio di fase II in 21 pazienti con ATTRm e diverse mutazioni ha mostrato che l’NT-proBNP e i parametri ecocardiografici sono rimasti stabili a 12 mesi.43 I dati di uno studio di coorte a 5 anni hanno confermato che il farmaco è ben tollerato alla dose di 20 mg, anche se pochi pazienti con ATTRwt sono rimasti stabili a 3,5 anni.44 Lo studio ATTR-ACT è uno studio di fase III della durata di 30 mesi che valuta l’efficacia, la sicurezza e la tollerabilità delle dosi di 20 mg e 80 mg di tafamidis rispetto al placebo in 440 pazienti con ATTRm, ATTRwt e HF. L’endpoint primario comprende la mortalità e il ricovero in ospedale. I suoi risultati sono attesi nel 2018.3,27
- –
Diflunisal è un agente antinfiammatorio non steroideo che stabilizza le molecole TTR in vitro. Non è disponibile in Spagna, ma può essere richiesto all’estero per uso compassionevole. Uno studio di fase III di ATTRm in pazienti con coinvolgimento prevalentemente neurologico, più della metà dei quali aveva una malattia cardiaca, non ha riscontrato differenze significative nei parametri ecocardiografici durante il periodo di studio (Tabella 2).45 Il suo potenziale di effetti avversi gastrointestinali, insufficienza renale, ritenzione idrica e ipertensione lo rendono inadatto ai pazienti con malattia cardiaca. L’evidenza sul diflunisal nei pazienti con ATTR è molto limitata. C’è uno studio, ma è stato limitato dal suo avere un disegno non randomizzato in un solo centro con poco follow-up e pochi pazienti (n = 13). Non ci sono stati ricoveri per HF scompensata, ma c’è stato un significativo peggioramento della funzione renale.46
- –
Più recentemente, un gruppo spagnolo ha dimostrato che il tolcapone (un inibitore orale della catecol-O-metiltransferasi usato nel trattamento della malattia di Parkinson) ha la capacità di legarsi in vitro alla TTR di pazienti con ATTRwt e Val122Ile con maggiore affinità di altri stabilizzatori.47
Eliminazione dei depositi di amiloide
I depositi di amiloide sono molto stabili e sembra che l’organismo umano abbia poca capacità di eliminarli. Tuttavia, i trattamenti che impediscono la produzione di nuova amiloide, come la chemioterapia nella SLA, possono eliminare gradualmente i depositi a diversi tassi organo-specifici. La clearance cardiaca è particolarmente bassa e finora le prove di regressione sono scarse. Diverse molecole sono attualmente allo studio per accelerare la clearance cardiaca dell’amiloide nell’ATTR:
- –
La doxiciclina (un antibiotico comunemente usato) interrompe la formazione di fibrille amiloidi. L’effetto sinergico della doxiciclina combinata con l’acido bile tauroursodesossicolico (TUDCA), usato nel trattamento delle malattie epatiche, ha dimostrato di eliminare i depositi di TTR nei modelli animali. Uno studio di fase II su 20 pazienti non ha mostrato alcuna progressione cardiaca o neurologica dopo 1 anno di trattamento con doxiciclina/TUDCA, con un profilo di sicurezza e tollerabilità accettabile.4 Altri studi di fase II hanno cercato di confermare questi risultati usando doxiciclina/TUDCA combinata, doxiciclina/acido ursodesossicolico, o doxiciclina da sola.48-50 I risultati preliminari di uno di questi studi suggeriscono un effetto protettivo, con un minore peggioramento della funzione cardiaca dovuto allo sforzo nel gruppo di trattamento. Un altro di questi studi ha ottenuto risultati simili in 40 pazienti con ATTR: i parametri NT-proBNP, classe funzionale, LVEF e spessore miocardico, tra gli altri, sono rimasti stabili a 12 mesi (Tabella 2). Tuttavia, tutti questi studi hanno avuto un alto tasso di abbandono (35%-44%), principalmente a causa di effetti avversi, in particolare ipersensibilità solare e disturbi gastrointestinali (fino al 30%).48-50
- –
L’EGCG (epigallocatechina-3 gallato) è la catechina più abbondante nel tè verde, e ha dimostrato in vitro e in un modello murino di inibire la formazione di amiloide ed eliminare i depositi esistenti.4 Il CMRI ha mostrato che la somministrazione giornaliera di 600 mg di EGCG era associata alla stabilizzazione della massa ventricolare sinistra in un gruppo di 25 pazienti (Tabella 2).51
- –
Il PRX004 è un anticorpo monoclonale che agisce legandosi a epitopi specifici del monomero e al misfolded TTR. In questo modo provoca l’eliminazione dei depositi attivando la fagocitosi.52 La base del suo meccanismo d’azione è simile a quella di un anticorpo usato nella SLA. Gli studi di fase II su questo anticorpo stanno dando risultati promettenti. Una sperimentazione di fase I-II di questo nuovo anticorpo dovrebbe iniziare nel 2017.
- –
A prescindere dal tipo di proteina precursore dell’amiloide, tutti i depositi contengono la componente sierica dell’amiloide P (SAP). Usando questa molecola come bersaglio, gli anticorpi anti-SAP hanno dimostrato di provocare una reazione mediata dai macrofagi e dipendente dal complemento che ha causato un’importante eliminazione dei depositi amiloidi viscerali in un modello murino. Il composto bis-D-prolina CPHPC può neutralizzare la SAP plasmatica, e la co-somministrazione con IgG anti-SAP permette all’anticorpo di raggiungere i depositi contenenti SAP nei tessuti.53 Uno studio di fase I pubblicato nel 2015 ha dimostrato l’eliminazione dei depositi epatici in 15 pazienti con amiloidosi sistemica senza coinvolgimento cardiaco, con pochi effetti avversi.53 Uno studio di fase II su pazienti con amiloidosi cardiaca ATTR e AL dovrebbe iniziare nel 2017 (Tabella 2).
CONCLUSIONI
L’amiloidosi cardiaca transtiretinica viene diagnosticata con frequenza crescente. La scintigrafia 99mTc-DPD e la CMRI sono esempi di tecniche che possono essere utilizzate per l’identificazione semplice e precoce dei pazienti con ATTR.
Diversi farmaci ATTR-specifici sono attualmente nelle fasi finali della ricerca. Pertanto, crediamo che l’amiloidosi cardiaca ATTR sarà presto considerata un’entità trattabile piuttosto che una malattia mortale.
FINANZIAMENTO
Questo lavoro è stato condotto con l’assistenza parziale dell’Istituto della Salute Carlos III e della Società Spagnola di Cardiologia (borsa di ricerca 2016 a E. González-López). L’assistenza dell’Istituto della Salute Carlos III è finanziata dal Fondo europeo di sviluppo regionale “Un altro modo per fare l’Europa”.
CONFLITTI DI INTERESSE
E. González-López ha partecipato come relatore ad attività organizzate da Pfizer. P. Garcia-Pavia ha ricevuto pagamenti come relatore in attività organizzate da Pfizer e come consulente di Alnylam, Prothena e Pfizer. E. González-López, A. López-Sainz, e P. Garcia-Pavia dichiarano che Pfizer ha finanziato progetti di ricerca della loro istituzione.