Ciclopentano Proprietà chimiche, usi, produzione
Proprietà fisiche e chimiche
Il ciclopentano, noto anche come “pentametilene”, è un tipo di cicloalcano con la formula di C5H10. Ha un peso molecolare di 70,13. Esiste come una specie di liquido infiammabile. Ha un punto di fusione di 94,4 °C, un punto di ebollizione di 49,3 °C, una densità relativa di 0,7460 e un indice di rifrazione di 1,4068. È solubile in alcool, etere e idrocarburi e non è solubile in acqua. Il ciclopentano non è un anello planare e ha due conformazioni: conformazioni a busta e conformazioni a semi-cavo. L’angolo di legame carbonio-carbonio è vicino a 109 ° 28 ‘ con la tensione molecolare non grande e l’anello è relativamente stabile. Ha una proprietà chimica simile a quella degli alcani. La concentrazione letale nell’aria per i ratti era 3,8 × 10-2. Presenta un colore rosso-giallo quando ha reazione con acido solforico fumante mentre genera nitro ciclopentano e acido glutarico attraverso la reazione con acido nitrico. Metodo: può essere ottenuto dal distillato di etere di petrolio, tramite cracking ad alta pressione sul cicloesano in presenza di alluminio o idrogenazione catalitica di ciclopentene e ciclopentadiene. Scopi: principalmente usato come solvente.
Figura 1 la struttura del ciclopentano.
Cicloalcani
I cicloalcani sono idrocarburi saturi in cui gli atomi di carbonio della molecola sono disposti ad anello e un numero sufficiente di atomi di idrogeno è combinato. I cicloalcani presenti nel petrolio sono principalmente ciclopentano e cicloesano.
I cicloalcani hanno un punto di fusione, un punto di ebollizione e una densità relativa più alti dei corrispondenti alcani a catena lineare. Possiamo usare il petrolio greggio aromatico naftenico per produrre benzina ad alto numero di ottano e a corsa rettilinea, la cui resistenza all’esplosione è migliore della paraffina normale. Il petrolio greggio naftenico a basso contenuto di zolfo, non solo è facile da lavorare, ma è anche un’eccellente materia prima per la produzione di lubrificanti avanzati. Il petrolio che contiene relativamente molti composti naftenici policiclici a catena laterale lunga è un materiale ideale per lubrificanti di alta qualità.
A temperatura ambiente e pressione atmosferica, i cicloalcani contenenti quattro o meno atomi di carbonio sono in forma di gas con quelli contenenti più di quattro carboni esistenti in forma liquida. Il ciclopropano e il ciclobutano appaiono come gas, il ciclopentano fino al cicloundecano appare come liquido; il ciclododecano e oltre appare come solido.
La natura chimica del cicloalcano è legata al numero di atomi di carbonio che formano l’anello. Ci si riferisce all’anello a tre e quattro membri, come piccolo anello; l’anello da cinque a sette membri come anello normale; l’anello da otto a undici come anello normale; l’anello da dodici membri in su come anello grande. Le linee dei nuclei di carbonio nei piccoli anelli non sono coerenti con l’asse dell’orbitale di legame. Nel ciclopropano, l’anello formato dalle linee dei nuclei degli atomi di carbonio è un triangolo equilatero con ogni angolo di 60° mentre l’angolo dell’asse dell’orbitale ibrido sp3 dei legami singoli carbonio-carbonio formato da ogni carbonio è di 104° (vedi figura 2 sotto). Pertanto, l’orbita non è riuscita a raggiungere il massimo grado di sovrapposizione, causando una grande tensione angolare. Anche il ciclobutano ha una tensione angolare, ma essendo più piccola. Questo porta alla scarsa stabilità del piccolo anello, causando la sua proprietà chimica simile alle olefine che possono avere reazione di addizione ad apertura di anello con molti reagenti. L’altro anello ha una tensione angolare minore o nulla. I cicloalcani e gli alcani hanno proprietà chimiche simili, meno inclini ad avere reazioni di ring-opening come la reazione con l’idrogeno. Il cicloesano e i cicloalcani superiori sono più difficili da sottoporre a idrogenazione.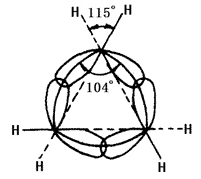
La figura 2 è una rappresentazione schematica della sovrapposizione degli orbitali di ibridazione sp3 nel ciclopropano.
Il ciclopropano (a temperatura ambiente) e il ciclobutano (alle condizioni di riscaldamento) possono avere reazioni di addizione con alogeni e alogenuri di idrogeno.
L’anello aperto si verifica tra i due atomi che collegano il numero maggiore e minore di idrogeni. L’addizione soddisfa la regola markoviana. Mentre l’anello normale, sotto la stimolazione della luce o del calore può avere reazione di sostituzione con l’alogeno.
A temperatura ambiente, il cicloalcano non può essere ossidato dal permanganato di potassio.
Ciclopentano, cicloesano e i suoi prodotti alchil sostituiti sono presenti in alcuni oli di petrolio. I cicloalcani possono anche essere sintetizzati con metodi adatti, come la ciclizzazione dihaloalkane e l’idrogenazione di idrocarburi aromatici.
Questa informazione è stata modificata da Xiaonan da Chemicalbook (2015-08-17).
Situazione pericolosa
L’ingestione e l’inalazione sono moderatamente tossiche. (2) Essere infiammabile con maggiore rischio di combustione. La concentrazione consentita nell’aria è di 600ppm (1720mg/m3) negli Stati Uniti.
Effetti nocivi e sintomi di avvelenamento
L’inalazione di alte concentrazioni di ciclopentano può causare inibizione del sistema nervoso centrale, sebbene la sua tossicità acuta sia bassa. I sintomi dell’esposizione acuta includono l’eccitazione all’inizio, seguita dalla comparsa di disturbi dell’equilibrio e persino stupore, coma. Raramente ci sono casi di morte per insufficienza respiratoria. È stato riportato che gli animali nutriti con questa merce possono avere una grave diarrea, che porta al collasso vascolare di cuore, polmoni e fegato e alla degenerazione del cervello.
Misure protettive
Può essere usato per migliorare le attrezzature di produzione. Usare creme o guanti protettivi per proteggere la pelle.
Cura medica
All’esame fisico regolare, prestare attenzione al potenziale effetto di irritazione della pelle e delle vie respiratorie, nonché alle complicazioni di reni e fegato.
Requisiti per il trasporto
Liquido infiammabile di grado I. Codice dei regolamenti di pericolo: 61013. Il contenitore deve essere contrassegnato con un marchio “liquido infiammabile” durante il trasporto.
Agente estinguente
Vedere “cicloesano”.
Metodi di smaltimento raccomandati
Incenerimento;
Proprietà chimiche
Si presenta come un liquido incolore con un punto di fusione di-93,9 °C, il punto di ebollizione di 49,26 ° C, la densità relativa di 0,7460 (20/4 ° C), l’indice di rifrazione di 1,4068 e il punto di flash di-37 °C. È miscibile con alcool, etere e altri solventi organici, non essendo facile da sciogliere in acqua.
Usi
(1) può essere usato come solvente per la polimerizzazione della soluzione della gomma del poliisoprene e dell’etere di cellulosa. Può essere usato come sostituto del Freon come materiale isolante in frigoriferi e congelatori, così come agenti schiumogeni per altre schiume PU dure, e standard di analisi cromatografica.
(2) Usato come sostanza standard per analisi cromatografica, solventi, carburanti per motori, agenti di distillazione azeotropica.
Metodo di produzione
Il ciclopentano è un componente dell’etere di petrolio nell’intervallo di punto di ebollizione 30-60 °C con il contenuto che è generalmente 5%-10%. Applicare la distillazione atmosferica; con un rapporto di riflusso di 60: 1 ed effettuare in una torre di 8 m di altezza; distillare prima l’isopentano e l’n-pentano; continuare il frazionamento per ottenere un ciclopentano con purezza superiore al 98%. Il ciclopentano può anche essere ottenuto tramite riduzione del ciclopentanone o idrogenazione catalitica del ciclopentadiene.
Pericoli &Informazioni sulla sicurezza
Categoria Liquidi infiammabili
Grado di tossicità: Bassa tossicità
Tossicità acuta: orale-ratto LD50: 11400 mg/kg; orale-topo LD50: 12800 mg/kg
Proprietà pericolosa degli esplosivi: essere esplosivo su mescolato con aria
Infiammabilità e situazioni pericolose: essere infiammabile in caso di incendio, alta temperatura e ossidante con combustione rilasciando fumo irritante
Caratteristiche di stoccaggio: Magazzino: ventilato, a bassa temperatura e asciutto; Conservare con ossidante separatamente
Agente estinguente: Polvere secca, anidride carbonica, schiuma, agente estinguente 1211
Standard occupazionale: TWA 1720 mg/m3; STEL 2150 mg/kg
Proprietà chimiche
liquido incolore con odore di benzina
Proprietà chimiche
Il ciclopentano è un liquido incolore.
Proprietà fisiche
Liquido incolore, mobile, infiammabile con un odore simile al cicloesano.
Usi
Il ciclopentano è un prodotto del petrolio. Si forma dal cracking catalitico ad alta temperatura del cicloesano o dalla riduzione del ciclopentadiene. È presente nelle frazioni di etere di petrolio e in molti solventi commerciali; è usato come solvente per vernici, nell’estrazione di cera e grasso e nell’industria delle scarpe.
Usi
Come reagente di laboratorio; nella fabbricazione di prodotti farmaceutici; si trova nei solventi e nell’etere di petrolio; agente di pressurizzazione dei propellenti.
Metodi di produzione
Il ciclopentano si trova nelle frazioni di etere di petrolio ed è preparato per cracking del cicloesano in presenza di allumina ad alta temperatura e pressione o per riduzione del ciclopentadiene.
Definizione
ChEBI: Un cicloalcano che consiste di cinque carboni ognuno legato con due idrogeni sopra e sotto il piano. Il capostipite della classe dei ciclopentani.
Descrizione generale
Un liquido incolore chiaro con un odore simile al petrolio. Punto di infiammabilità di -35°F. Meno denso dell’acqua e insolubile in acqua. I vapori sono più pesanti dell’aria.
Aria &Reazioni con l’acqua
Altamente infiammabile. Insolubile in acqua.
Profilo di reattività
Il ciclopentano è incompatibile con forti agenti ossidanti come cloro, bromo, fluoro.
Rischio per la salute
L’inalazione causa vertigini, nausea e vomito; il vapore concentrato può causare incoscienza e collasso. Il vapore causa un leggero bruciore agli occhi. Il contatto con il liquido causa irritazione agli occhi e può irritare la pelle se lasciato inalterato. L’ingestione causa irritazione allo stomaco. L’aspirazione produce grave irritazione polmonare ed edema polmonare a rapido sviluppo; eccitazione del sistema nervoso centrale seguita da depressione.
Pericolo per la salute
Il ciclopentano è un tossico a bassa acuità. La sua esposizione ad alte concentrazioni può produrre una depressione del sistema nervoso centrale con sintomi di eccitabilità, perdita di equilibrio, stupore e coma. L’insufficienza respiratoria può verificarsi nei ratti da 30-60 minuti di esposizione a 100.000-120.000 ppm in aria. È un irritante per il tratto respiratorio superiore, la pelle e gli occhi. Non ci sono informazioni disponibili in letteratura sugli effetti cronici dell’esposizione prolungata al ciclopentano.
Pericolo di incendio
Comportamento in caso di incendio: I contenitori possono esplodere.
Reattività chimica
Reattività con acqua Nessuna reazione; Reattività con materiali comuni: Nessuna reazione; Stabilità durante il trasporto: Stabile; Agenti neutralizzanti per acidi e caustici: Non pertinente; Polimerizzazione: Non pertinente; Inibitore della polimerizzazione: Non pertinente.
Profilo di sicurezza
Lievemente tossico per ingestione e inalazione. Alte concentrazioni hanno azione narcotica. Pericolo di incendio molto pericoloso se esposto a calore o fiamme; può reagire con gli ossidanti. Per combattere il fuoco, usare schiuma, CO2, prodotti chimici secchi. Se riscaldato fino alla decomposizione emette fumo acre e fumi.
Esposizione potenziale
Il ciclopentano è usato come solvente.
Fonte
Componente della benzina ad alto numero di ottani (citato, Verschueren, 1983). Harley et al. (2000) hanno analizzato i vapori dello spazio di testa di tre tipi di benzina senza piombo in cui è stato aggiunto etanolo per sostituire l’etere metilterbutilico. Il ciclopentano è stato rilevato a una concentrazione identica dell’1,4% in peso nei vapori dello spazio di testa per i gradi normali, medi e premium.
Schauer et al. (1999) hanno riportato ciclopentano nello scarico di un camion medio alimentato a diesel con un tasso di emissione di 410 μg/km.
La benzina riformulata California Phase II conteneva ciclopentano a una concentrazione di 4,11g/kg. I tassi di emissione allo scarico in fase gassosa da automobili a benzina con e senza convertitori catalitici erano rispettivamente 0,78 e 85,4 mg/km (Schauer et al., 2002).
Destino ambientale
Biologico. Il ciclopentano può essere ossidato da microbi a ciclopentanolo, che può ossidare il tocyclopentanone (Dugan, 1972).
Fotolitico. Le seguenti costanti di velocità sono state riportate per la reazione di ottano e OHradicals nell’atmosfera: 3,7 x 10-12 cm3/molecola?sec a 300 K (Hendry e Kenley, 1979); 5,40x 10-12 cm3/molecola?sec (Atkinson, 1979); 4,83 x 10-12 cm3/molecola.sec a 298 K (DeMore e Bayes, 1999); 6,20 x 10-12, 5,24 x 10-12, e 4.43 x 10-12 cm3/molecola?sec a 298, 299 e 300 K, rispettivamente (Atkinson, 1985), 5,16 x 10-12 cm3/molecola?sec a 298 K (Atkinson, 1990) e 5,02x 10-12 cm3/mol-sec a 295 K (Droege e Tilly, 1987). Il ciclopentano non si idrolizza perché non ha un gruppo funzionale idrolizzabile. La combustione completa in aria produce anidride carbonica e acqua.
A temperature elevate, la rottura dell’anello avviene formando etilene e presumibilmente allene e idrogeno (Rice e Murphy, 1942).
Spedizione
UN1146 Ciclopentano, Classe di pericolo: 3; Etichette:3-Liquido infiammabile.
Metodi di purificazione
Liberarlo dal ciclopentene con due passaggi attraverso una colonna di gel di silice attivato accuratamente essiccato e degassato. Si trova nel petrolio ed è ALTAMENTE INFIAMMABILE.
Incompatibilità
Può formare una miscela esplosiva con l’aria, può accumulare cariche elettriche statiche e può causare l’accensione dei suoi vapori. Il contatto con forti ossidanti può causare incendi ed esplosioni.
Smaltimento dei rifiuti
Sciogliere o mescolare il materiale con un solvente combustibile e bruciare in un inceneritore chimico dotato di postbruciatore e scrubber. Devono essere rispettate tutte le normative ambientali federali, statali e locali.