Carcinoma in situ in un paziente con eritroleucoplachia: sfide nella diagnosi e nella scelta terapeutica
Titolo breve: Carcinoma in situ nell’eritroleucoplachia
Willian Pecin JacomacciI; Liogi Iwaki FilhoII; Lilian Cristina Vessoni IwakiII; Mariliani Chicarelli da SilvaII; Neli PielarisiII; Vanessa Cristina VeltriniII; Rafael de Oliveira LazarinIII; Elen de Souza TolentinoIV
I Studente universitario presso l’Università statale di Maringá, Maringá-PR, Brasile.
II DDS, MA, PhD, Professore Associato, Dipartimento di Odontoiatria, Università Statale di Maringá, Maringá-PR, Brasile.
III DDS, MA candidato in Odontoiatria all’Università Statale di Maringá, Maringá-PR, Brasile.
IV DDS, MA, PhD, professore assistente, Dipartimento di Odontoiatria, Università Statale di Maringá, Maringá-PR, Brasile.
Endereço para correspondência
ABSTRACT
Un fumatore maschio caucasico di 41 anni ha presentato una placca rossa e bianca sulla mucosa jugale sinistra suggestiva di eritroleucoplachia orale (OEL). La biopsia seguita da un esame microscopico ha rivelato un carcinoma in situ. Poiché la OEL è considerata una lesione precancerosa con un alto potenziale di trasformazione maligna, il presente caso si propone di discutere le sfide nella diagnosi della condizione e nella scelta del trattamento più appropriato. La discussione affronta questioni come l’esistenza di un limite per la scelta di un approccio radicale o più conservativo al trattamento e l’importanza di utilizzare una procedura che consenta un esame microscopico dell’intera lesione. Il carcinoma in situ associato a OEL ha reso la pianificazione del trattamento ancora più complessa nel caso in questione. Al fine di evitare un approccio mutilante, sono state eseguite escissioni multiple con margini di sicurezza, e il paziente è stato istruito a non fumare. Un rigoroso follow-up di 12 mesi non mostra segni di recidiva del LEP.
Descrittori: Eritroplasia; Leucoplachia; Trattamento Primario.
INTRODUZIONE
L’eritroleucoplachia orale (OEL), talvolta paragonata alla leucoplachia maculata o nodulare, è una placca rossa e bianca con un rischio relativamente alto di trasformazione maligna.1 Il tabacco e l’alcol sono i principali fattori di rischio associati al suo potenziale maligno.2,3
Il LEO mostra un potenziale di trasformazione maligna più elevato rispetto alla leucoplachia omogenea,2-4 che può essere parzialmente dimostrato da esami istologici e immunoistochimici e da studi di coorte. Il tasso di trasformazione maligna dei LEP varia dal 18% al 47%, mentre è intorno all’1-7% per la leucoplachia orale omogenea spessa (OL), e al 4-15% per la OL granulare o verruciforme.5 Istologicamente, le lesioni LEP sono caratterizzate da cambiamenti epiteliali di ipercheratosi, iperplasia, atrofia, un certo grado di displasia epiteliale, carcinoma in situ, o carcinoma superficialmente invasivo. Inoltre, le lesioni OEL hanno indici mitotici e apoptotici più elevati rispetto alle lesioni OL omogenee e nodulari6.
La gestione dei disturbi potenzialmente maligni può essere impegnativa. Il trattamento clinico consiste nell’eliminazione dei fattori di rischio,7 nel follow-up,8 nell’uso di retinoidi,9 vitamine A, C, E, ketorolac, celecoxib, tè verde, fenretinide, licopene,10 e terapia fotodinamica.5,11-14 Il trattamento chirurgico consiste nella rimozione delle lesioni, nella criochirurgia e nell’ablazione laser.15
Gli obiettivi di questo studio erano (1) riportare i dettagli clinici e istologici di OEL sulla mucosa jugal, e (2) rivedere la letteratura riguardante le caratteristiche demografiche, cliniche e istologiche di OEL, così come la sua prognosi e il trattamento.
RAPPORTO DEL CASO
Un fumatore maschio caucasico di 41 anni si è presentato alla Clinica di Medicina Orale dell’Università Statale di Maringá, Brasile, riportando una lesione asintomatica sul lato sinistro della mucosa jugale di epoca sconosciuta. L’esame intraorale ha mostrato una placca rossa vicino alla regione premolare e una placca bianca nodulare intorno alla regione molare (Fig. 1).
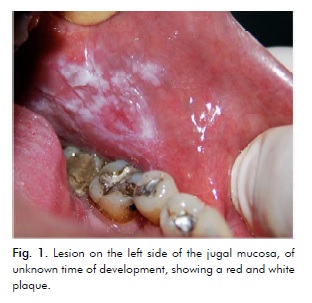
La diagnosi presuntiva era o OEL o carcinoma a cellule squamose. I campioni bioptici sono stati raccolti dalla regione nodulare bianca più posteriore e dalla regione rossa più anteriore.
L’esame istopatologico mediante colorazione con ematossilina ed eosina ha rivelato ipercheratosi e atrofia, con carcinoma focale in situ nella regione rossa più anteriore, compatibile con il carcinoma in situ nel LEP. L’esame ha anche rivelato ipercheratosi con displasia moderata nella regione bianca più posteriore, compatibile con una diagnosi di OL. L’epitelio squamoso stratificato che ricopre la mucosa ha mostrato vari gradi di orto e parakeratosi, con cellule della cresta romboidale che mostrano ipercromatismo e pleomorfismo in circa la metà dello spessore epiteliale. Tuttavia, un’area più piccola mostrava caratteristiche displastiche più evidenti in tutto l’epitelio, ma senza segni di un modello infiltrativo (Fig. 2A). Le caratteristiche consistevano in una stratificazione disorganizzata e alterata, proiezioni di gocce alternate ad atrofia (Fig. 2A e 2B), un insolito rapporto nucleocitoplasmatico, ipercromatismo, pleomorfismo, perdita di adesione intercellulare con rare figure mitotiche (Fig. 2C), e foci discheratotici (Fig. 2D). Il tessuto connettivo sottostante queste aree ha mostrato cambiamenti infiammatori più intensi.
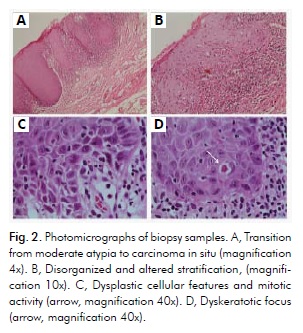
Le caratteristiche cliniche e microscopiche erano coerenti con una diagnosi di OEL associato ad un carcinoma focale in situ. A questo punto, al paziente è stata data una spiegazione approfondita sulle sue opzioni di trattamento: (1) poteva essere indirizzato a un chirurgo del collo e della testa, che avrebbe probabilmente utilizzato un approccio invasivo, associato o meno alla radioterapia; (2) poteva sottoporsi a un trattamento ambulatoriale presso la Clinica di Medicina Orale con un approccio più conservativo che avrebbe preservato gli aspetti estetici e funzionali. Il paziente scelse la seconda opzione e firmò l’apposito modulo di consenso informato (Appendice A).
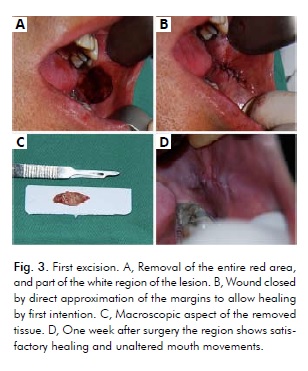
A causa delle dimensioni estese della lesione e del fatto che una singola grande escissione potrebbe limitare i movimenti della bocca, le procedure chirurgiche consistevano in tre escissioni multiple con bisturi, eseguite in un periodo di 2 mesi, con un intervallo di 30 giorni tra ogni procedura. A causa della presenza di un carcinoma in situ nella regione rossa, la prima procedura consisteva nella sua intera escissione, così come parte dell’area bianca della lesione, utilizzando un margine di sicurezza di 5 mm (Fig. 4). Inoltre, il paziente è stato istruito a smettere di fumare.
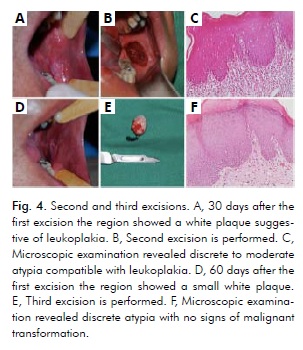
L’esame clinico un mese dopo la prima escissione ha mostrato una placca bianca suggestiva di leucoplachia (Fig. 4A). La seconda escissione è stata eseguita (Fig. 4B), e l’esame microscopico ha rivelato un’atipia da discreta a moderata (Fig. 4C). L’esame intraorale due mesi dopo la prima escissione ha mostrato una piccola placca bianca ancora più localizzata posteriormente di prima (Fig. 4D). Successivamente, è stata eseguita la terza escissione (Fig. 4E), che ha rivelato una discreta atipia (Fig. 4F). Sia la seconda che la terza escissione sono state eseguite nella regione molare più posteriore usando lo stesso margine di sicurezza di 5 mm. I tessuti di queste due escissioni erano compatibili con la leucoplachia senza segni di trasformazione maligna (Fig. 4C, Fig. 4F).
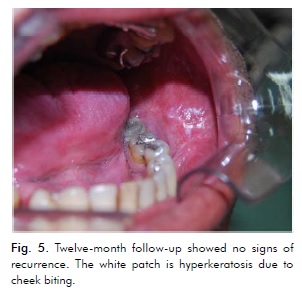
Il paziente ha smesso di fumare ed è sotto stretto controllo, essendo stato visto settimanalmente durante i primi tre mesi, mensilmente fino a un anno, e poi ogni tre mesi. Nessun segno di recidiva è stato osservato 15 giorni dopo la terza e ultima escissione, confermata all’appuntamento di follow-up di 12 mesi (Fig. 5).
DISCUSSIONE
Il LEP è considerato una leucoplachia non omogenea con placche miste bianche e rosse e ha un alto rischio di trasformazione maligna.2-4 Le aree rosse o eritroplastiche sembrano avere maggiori probabilità di subire cambiamenti displastici rispetto a quelle bianche ipercheratotiche,7 come riscontrato nel presente caso, le cellule più atipiche sono state osservate nella regione rossa. Yen et al. (2008)16 hanno scoperto che l’uso di betel quid e sigarette comportava un rischio del 42,2% di sviluppare leucoplachia e del 95,0% di sviluppare il LEP dopo 20 anni di follow-up. Il paziente in questo caso aveva fumato circa dieci sigarette al giorno per 20 anni e la biopsia iniziale ha rivelato un carcinoma in situ associato a OEL.
Perché le modalità di trattamento del LEP sono variabili, la scelta della terapia appropriata può essere difficile. Prendendo in considerazione il suo stadio di sviluppo e il suo alto potenziale maligno, ci si potrebbe chiedere se il trattamento debba essere conservativo o invasivo. Al fine di verificare le modalità di trattamento più utilizzate, abbiamo esaminato la letteratura su questo argomento. Le fonti erano i database Medline e Lilacs, i testi dovevano essere scritti in inglese, e i termini di ricerca erano oral AND nonhomogeneous OR no homogeneous AND leukoplakia OR erythroleukoplakia. La leucoplachia non omogenea è stata usata, poiché molti autori la considerano un sinonimo di eritroleucoplachia. Sono stati trovati otto studi sul trattamento della LEP,5,7,14,16-19 pubblicati tra il 1987 e il 2010. Dei 226 casi totali, 211 sono stati trattati con un approccio clinico (terapia fotodinamica e follow-up clinico), e 15 sono stati trattati con l’escissione chirurgica (Tabella 1).
Per quanto riguarda l’approccio clinico, la terapia fotodinamica (PDT) è utilizzata nel trattamento dei disturbi potenzialmente maligni perché non è invasiva, è ben tollerata dai pazienti, può essere utilizzata ripetutamente senza effetti collaterali cumulativi e comporta una scarsa formazione di cicatrici. 5,11,13,14 Tuttavia, questa tecnica ha mostrato un successo variabile, risultati di follow-up incoerenti e recidive.17 Infatti, la recidiva della malattia utilizzando la PDT può variare tra il 21%5 e il 29%14.
Uno studio in doppio cieco controllato con placebo 17 ha trovato che la vitamina A e il beta-carotene, entrambi usati da soli, hanno mostrato risultati migliori sulle leucoplachie omogenee e sulle lesioni più piccole. Quindi, l’uso della vitamina A o del betacarotene era discutibile nel caso in questione, a causa delle dimensioni della lesione e del carcinoma in situ associato.
Il trattamento tradizionale per i LEP consiste nella loro completa escissione,15,21,22 soprattutto per le lesioni con displasia grave.21,22 L’escissione completa permette l’analisi istologica dell’intera lesione, che può rivelare alterazioni non diagnosticate nella biopsia preoperatoria.8 Inoltre, per quanto ne sappiamo, gli studi a lungo termine non hanno ancora dimostrato se la recidiva si verifichi o meno dopo il trattamento non chirurgico.20,23 Due degli otto studi esaminati hanno utilizzato l’escissione chirurgica per trattare i LEP,8,19 con tassi di recidiva che variano dal 10,1%19 al 20%8.
Il presente studio ha optato per un approccio chirurgico poiché la biopsia aveva rivelato una trasformazione maligna iniziale. Inoltre, sono state scelte escissioni multiple associate a margini di sicurezza a causa delle grandi dimensioni della lesione, poiché una grande ferita potrebbe limitare i movimenti della bocca e complicare il recupero post-operatorio. Questa opzione ha anche permesso di effettuare esami microscopici supplementari, che hanno rivelato diversi gradi di atipia, che hanno guidato il trattamento. Durante le procedure chirurgiche si è prestata particolare attenzione a non coprire l’apertura del dotto parotideo per prevenire l’atrofia ghiandolare ed evitare ulteriori complicazioni come il mucocele o la riduzione del flusso salivare. La ferita è stata chiusa per approssimazione diretta dei margini, permettendo la guarigione per prima intenzione, e nessuna riduzione significativa dell’apertura della bocca.
Vedtofte et al (1987)8 affermano che il difetto mucosale causato dalle escissioni può essere riparato per seconda intenzione o chiuso con altre tecniche, come l’approssimazione diretta dei margini della ferita, la trasposizione con un lembo mucosale locale, l’innesto libero di mucosa e il trapianto libero di pelle divisa. Per quanto ne sappiamo, non esiste alcuno studio che utilizzi innesti alloplastici su lesioni potenzialmente maligne il cui trattamento può causare grandi difetti. Sebbene i trapianti possano essere utilizzati per recuperare ampi siti chirurgici, come sostenuto da diversi autori,8,24 essi possono essere infettati da Candida sp, subire contrazioni postoperatorie, deformità e mascherare i segni precoci di recidiva8.
Il laser e la crioterapia possono essere utilizzati da soli o associati ai metodi chirurgici tradizionali per il trattamento dei LEP. Cantarelli Morosolli et al. (2006)7 riportano un caso di successo della malattia trattato con escissione e radiazione laser al biossido di carbonio. Studi di coorte hanno trovato che la chirurgia laser gioca un ruolo importante nella diagnosi e nel trattamento delle lesioni potenzialmente maligne.10,18,25,26 L’uso della criochirurgia, sebbene riportato in letteratura,9 condivide con l’ablazione laser lo svantaggio principale di non fornire l’intera lesione per l’esame istologico.27,28 Inoltre, la crioterapia causa un considerevole dolore e gonfiore postoperatorio, e le lesioni potenzialmente maligne sono raramente completamente distrutte.10
Vedtofte et al. (1987)8 hanno scoperto che le lesioni premaligne trattate con l’escissione chirurgica mostravano un tasso di recidiva generale del 20%, spesso diagnosticato entro il primo anno post-operatorio. La maggior parte delle recidive di LEP sono state trovate nelle aree adiacenti alla lesione precedentemente trattata. La recidiva dell’eritroplachia e della leucoplachia verrucosa era rispettivamente del 40% e del 55,6%. La leucoplachia non ha mostrato alcuna recidiva. Due casi di OEL si sono trasformati in carcinoma, così come un caso di leucoplachia verrucosa. Le recidive di lesioni potenzialmente maligne erano spesso adiacenti alla lesione escissa, forse perché il margine di sicurezza di 3-5 mm non ha rimosso l’intero tessuto patologicamente modificato. Gli autori considerano l’escissione chirurgica un trattamento soddisfacente per le lesioni potenzialmente maligne e sottolineano l’importanza di utilizzare una tecnica che permetta l’esame istologico dell’intera lesione.
Le difficoltà nel determinare il margine esatto di una lesione sono particolarmente frequenti per l’eritroplachia o l’OEL,8 il che può spiegare l’alto tasso di recidiva di queste lesioni. Per evitare di lasciare tessuti patologici nel sito chirurgico e minimizzare il rischio di recidiva, il presente studio ha optato per escissioni multiple. I movimenti della bocca sono normali e non ci sono segni di recidiva. Inoltre, il rischio di recidiva e di trasformazione maligna è ridotto con l’eliminazione dei fattori di rischio, come la cessazione del tabacco e dell’alcol. Il paziente è stato istruito a smettere di fumare, e ha smesso di fumare, essendo attualmente sotto stretto controllo.
Nel presente case report, è stata proposta una modalità conservativa di trattamento chirurgico di OEL. Sebbene sia ancora una procedura chirurgica, è minimamente invasiva rispetto agli approcci tradizionali utilizzati sia dai chirurghi della testa e del collo che dagli oncologi. Il loro approccio tipico consiste in escissioni più radicali ed estese che di solito si traducono in mutilazioni e compromissione sia dell’aspetto estetico che della funzione. La decisione se adottare un approccio radicale o più conservativo è difficile da prendere, poiché la ricerca finora non ha stabilito un protocollo unico per trattare questi casi. La scelta del trattamento di casi come questo richiede un’attenta valutazione delle circostanze individuali, tenendo conto del grado di atipia cellulare, della localizzazione e dell’accesso alla lesione, nonché delle sue dimensioni. Crediamo che, in linea di principio, queste lesioni non debbano essere trattate come maligne, permettendo così di evitare il protocollo di routine di grandi resezioni e terapie adiuvanti, come la radioterapia. Inoltre, crediamo che si debba tenere presente che il carcinoma in situ non è invasivo. La sua rimozione chirurgica, insieme alla cessazione dei fattori di rischio, come il tabacco, così come il monitoraggio costante può tradursi in un trattamento di successo. Inoltre, gli interventi chirurgici multipli hanno permesso molteplici indagini microscopiche, che hanno offerto al paziente una prospettiva più rassicurante e la certezza che non ci fossero cellule maligne nella regione.
REFERÊNCIAS
1. Küffer R, Lombardi T. Lesioni premaligne della mucosa orale. Una discussione sul posto della neoplasia intraepiteliale orale (OIN). Oral Oncol. 2002;38:125-30.
2. Van der Waal I. Patologie potenzialmente maligne della mucosa orale e orofaringea; terminologia, classificazione e concetti attuali di gestione. Oral Oncol. 2009;45:317-23.
3. Van der Waal I. Patologie potenzialmente maligne della mucosa orale e orofaringea; concetti attuali di gestione. Oral Oncol. 2010;46423-5.
4. Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclatura e classificazione dei disturbi potenzialmente maligni della mucosa orale. J Oral Pathol Med. 2007;36:575-80.
5. Yu CH, Lin HP, Chen HM, Yang H, Wang YP, Chiang CP. Confronto dei risultati clinici dell’eritroleucoplachia orale trattata con la terapia fotodinamica utilizzando il diodo emettitore di luce o la luce laser. Lasers Surg Med. 2009;41:628- 33.
6. Kövesi G, Szende B. Cambiamenti nell’apoptosi e nell’indice mitotico, espressione di p53 e Ki67 in vari tipi di leucoplachia orale. Oncologia. 2003;65:331-6.
7. Cantarelli Morosolli AR, Schubert MM, Niccoli- Filho W. Trattamento chirurgico dell’eritroleucoplachia del labbro inferiore con radiazione laser ad anidride carbonica. Lasers Med Sci. 2006;21:181-4.
8. Vedtofte P, Holmstrup P, Hjørting-Hansen E, Pindborg JJ. Trattamento chirurgico delle lesioni premaligne della mucosa orale. Int J Oral Maxillofac Surg. 1987;16:656-64.
10. Thomson P. Oral Precancer – Diagnosi e gestione dei disturbi potenzialmente maligni. Hoboken: Wiley-Blackwell: 2012; p. 107-136.
11. Dolmans DE, Fukumura D, Jain RK. Terapia fotodinamica per il cancro. Nat Rev Cancer. 2003;3:380-7.
12. Lee MR, Ryman W. Eritroplasia del Queyrat trattata con terapia fotodinamica topica del metil aminolevulinato. Australas J Dermatol. 2005;46:196-8.
13. Chen HM, Yu CH, Tsai T, Hsu YH, Kuo RC, Chiang CP. Terapia fotodinamica topica mediata dall’acido 5-aminolevulinico per l’iperplasia verrucosa orale, leucoplachia orale ed eritroleucoplachia orale. Photodiagn Photodyn Ther. 2007;4:44-52.
14. Lin HP, Chen HM, Yu CH, Yang H, Wang YP, Chiang CP. La terapia fotodinamica topica è molto efficace per l’iperplasia verrucosa orale e l’eritroleucoplachia orale. J Oral Pathol Med. 2010;39:624-30.
15. Reichart PA, Philipsen P. Eritroplachia orale: una revisione. Oral Oncol. 2005; 41:551-61.
16. Yen AM, Chen SC, Chang SH, Chen TH. L’effetto del betel quid e della sigaretta sulla progressione multistatale della pre-malignità orale. J Oral Pathol Med. 2008;37: 417-22.
17. Sankaranarayanan R, Mathew B, Varghese C, Sudhakaran PR, Menon V, Jayadeep A, Nair MK, Mathews C, Mahalingam TR, Balaram P, Nair PP. Chemoprevenzione della leucoplachia orale con vitamina A e beta carotene: una valutazione. Oral Oncol 1997; 33: 231-6.
18. Schoelch ML, Sekandari N, Regezi JA, Silverman S Jr. Gestione laser delle leucoplachie orali: uno studio di follow-up di 70 pazienti. Laryngoscope 1999; 109: 949-53.
19. Pandey M, Thomas G, Somanathan T, Sankaranarayanan R, Abraham EK, Jacob BJ, Mathew B. Valutazione dell’escissione chirurgica della leucoplachia orale non omogenea in uno studio di intervento di screening, Kerala, India. Oral Oncol. 2001;37:103-9.
20. Spinola Ribeiro A, Ribeiro Salles P, da Silva TA, Alves Mesquita R. Una revisione del trattamento non chirurgico della leucoplachia orale. Int J Dent 2010; Articolo ID 186018, 10 pagine, 2010. doi:10.1155/2010/186018.
21. Marley JJ, Cowan CG, Lamey PJ, Linden GJ, Johnson NW, Warnakulasuriya KA. Gestione delle lesioni potenzialmente maligne della mucosa orale da parte di consulenti di chirurgia orale e maxillofacciale del Regno Unito. Br J Oral Maxillofac Surg. 1996;34:28-36.
22. Marley JJ, Linden GJ, Cowan CG, Lamey PJ, Johnson NW, Warnakulasuriya KAAS, Scully C. Un confronto della gestione delle lesioni potenzialmente maligne della mucosa orale da parte di medici orali e chirurghi orali e maxillofacciali nel Regno Unito. J Oral Pathol Med. 1998;27: 489-95.
23. Lodi G, Sardella A, Bez C, Demarosi F, Carrasi A. Interventi per il trattamento della leucoplachia orale. Cochrane Database Syst Ver. 2006;4:CD001929.
24. Frame JW, Das Gupta AR, Dalton GA, Evans EH. Uso del laser ad anidride carbonica nella gestione delle lesioni premaligne della mucosa orale. J Laryngol Otol. 1984;98:1251-60.
25. Stocker J, Thomson PJ, Hamadah O. Chirurgia laser in oncologia orale – l’esperienza di Newcastle. The Surgeon 2005; Suppl 3: S32-33.
26. Hamadah O, Thomson PJ. Fattori che influenzano il trattamento laser ad anidride carbonica per il precanceroma orale: uno studio di coorte di pazienti. Lasers Surg Med 2009; 41: 17-25.
28. Sako K, Marchetta FC, Hayes RL Crioterapia della leucoplachia intraorale. Am. J. Surg. 1972:124:482-4.