Come abbiamo visto, la nostra dieta comprende molti carboidrati, e ci si potrebbe chiedere se c’è un modo per analizzare un campione per dire se è saccarosio, o uno dei dolcificanti sintetici come il sorbitolo o lo sciroppo di mais ad alto contenuto di fruttosio, o anche un composto come la vitamina C, che è sintetizzata da zuccheri e come loro, contiene solo C, H e O. Un modo c’è, ed è una delle forme di analisi più fondamentali, chiamata analisi elementare. È uno dei primi metodi che i ricercatori usano per identificare un nuovo composto.
Fino a questo punto abbiamo ottenuto tutti i rapporti stechiometrici dai coefficienti delle equazioni chimiche bilanciate. Tuttavia, le formule chimiche indicano anche quantità relative di sostanze, e i rapporti stechiometrici possono essere derivati anche da esse. Per esempio, la formula CO2 ci dice che non importa quanto grande sia il campione di anidride carbonica che abbiamo, ci saranno sempre 2 mol di atomi di ossigeno per ogni mole di atomi di carbonio. Cioè, dalla formula CO2 abbiamo il rapporto stechiometrico
\
Potremmo anche determinare che per la CO2
\
\
(I reciproci di questi rapporti stechiometrici sono validi anche per la CO2.)
I rapporti stechiometrici derivati da formule invece di equazioni sono coinvolti nella procedura più comune per determinare le formule empiriche dei composti che contengono solo C, H e O. Una quantità pesata della sostanza da analizzare è posta in un treno di combustione e riscaldata in un flusso di O2 secco. Tutto l’H nel composto è convertito in H2O(g) che è intrappolato selettivamente in un tubo di assorbimento precedentemente pesato. Tutto il C viene convertito in CO2(g) e questo viene assorbito selettivamente in un secondo tubo. L’aumento di massa di ogni tubo dice, rispettivamente, quanta H2O e CO2 sono state prodotte dalla combustione del campione
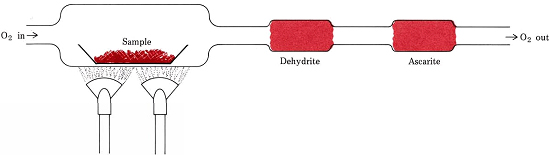
Figura \(\PageIndex{1}) Un treno di combustione. H2O e CO2, prodotti dalla combinazione di O2 con H e C nel campione, sono assorbiti selettivamente da tubi contenenti deidrite e ascarite (NaOH su amianto).
Esempio \(\PageIndex{1}): Formula empirica dell’acido ascorbico
Un campione di 6,49 mg di acido ascorbico (vitamina C) è stato bruciato in un treno di combustione. Si sono formati 9,74 mg di CO2 e 2,64 mg di H2O. Determinare la formula empirica dell’acido ascorbico.
Soluzione Dobbiamo conoscere la quantità di C, la quantità di H, e la quantità di O nel campione. Il rapporto di questi dà i pedici nella formula. I primi due possono essere ottenuti dalle masse di CO2 e H2O usando le masse molari e i rapporti stechiometrici
Così
Il composto potrebbe anche aver contenuto ossigeno. Per vedere se lo fa, calcola le masse di C e H e sottrai dalla massa totale del campione
\
Quindi abbiamo
\
e
\
I rapporti delle quantità degli elementi nell’acido ascorbico sono quindi
\
\
Siccome nC:nH:nO è 3 mol C:4 mol H:3 mol O, la formula empirica è C3H4O3.
Si riporta il disegno di una molecola di acido ascorbico. Si può determinare contando gli atomi che la formula molecolare è C6H8O6 – esattamente il doppio della formula empirica. È anche evidente che c’è più da sapere su una molecola che non solo quanti atomi di ogni tipo sono presenti. Nell’acido ascorbico, come in altre molecole, il modo in cui gli atomi sono collegati insieme e la loro disposizione nello spazio tridimensionale sono abbastanza importanti. Un’immagine che mostra quali atomi sono collegati a quali è chiamata formula strutturale. Le formule empiriche possono essere ottenute dalla composizione percentuale o da esperimenti di combustione, e, se il peso molecolare è noto, le formule molecolari possono essere determinate dagli stessi dati. Per trovare le formule strutturali sono necessari esperimenti più complicati. Nell’esempio 2 abbiamo ottenuto la massa di O sottraendo le masse di C e H dalla massa totale del campione. Questo presupponeva che fossero presenti solo C, H e O. A volte tale presupposto può essere errato. Quando la penicillina fu isolata e analizzata per la prima volta, il fatto che contenesse zolfo non fu notato. Questo errore non fu scoperto per qualche tempo perché il peso atomico dello zolfo è quasi esattamente il doppio di quello dell’ossigeno. Due atomi di ossigeno furono sostituiti al posto di un atomo di zolfo nella formula.
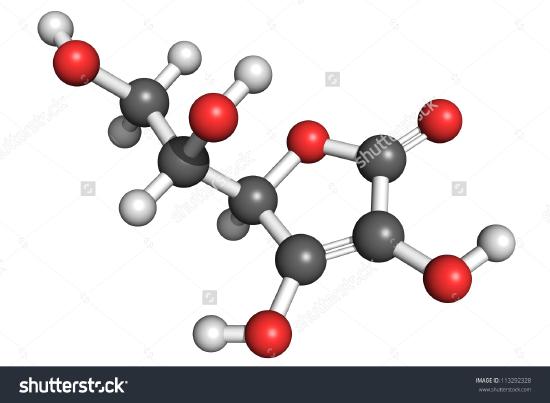
Figura \(\PageIndex{2}) Una rappresentazione 3D dell’acido L-Ascorbico 1
Da ChemPRIME: 3.4: Analisi dei Composti