Il principio più generale che regola la forza degli acidi può essere affermato così: gli acidi forti hanno basi coniugate relativamente stabili. In generale, più stabile è la base coniugata, più forte è l’acido. Una cosa importante da ricordare è che la stabilità e la reattività sono inverse. Più una sostanza è stabile, meno è reattiva, e viceversa. Quindi, un altro modo di affermare la regola di cui sopra è dire che gli acidi forti hanno basi coniugate deboli. HCl e H3O+ sono acidi forti. Di conseguenza, le corrispondenti basi coniugate, Cl- e H2O, sono deboli (molto stabili). Lo ione cloruro è stabile perché la carica negativa risiede su un atomo molto elettronegativo. La molecola dell’acqua è una delle sostanze più stabili conosciute.
Come facciamo a sapere quale protone è il più acido in una molecola (come l’acido acetico) che contiene più di un tipo di protone? Ricordiamo che più alto è il grado di positività del protone, più è acido. L’esame di una tabella pKa rivela alcune tendenze per i protoni acidi. Le seguenti linee guida possono essere usate per prevedere l’acidità.
1. Gli idrogeni direttamente attaccati ad atomi molto elettronegativi come l’ossigeno, lo zolfo e gli alogeni portano un sostanziale grado di acidità.
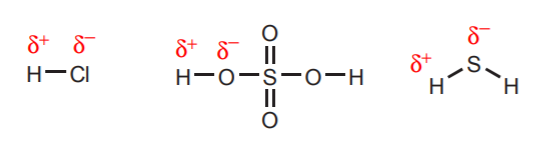
2. Gli idrogeni attaccati ad un azoto, ossigeno o zolfo con carica positiva sono acidi. L’alta elettronegatività di questi atomi li mette a disagio con la carica positiva. Cercano di diffondere la carica tra gli atomi vicini ritirando la densità di elettroni da loro. Questo può essere dimostrato disegnando strutture di risonanza come mostrato.
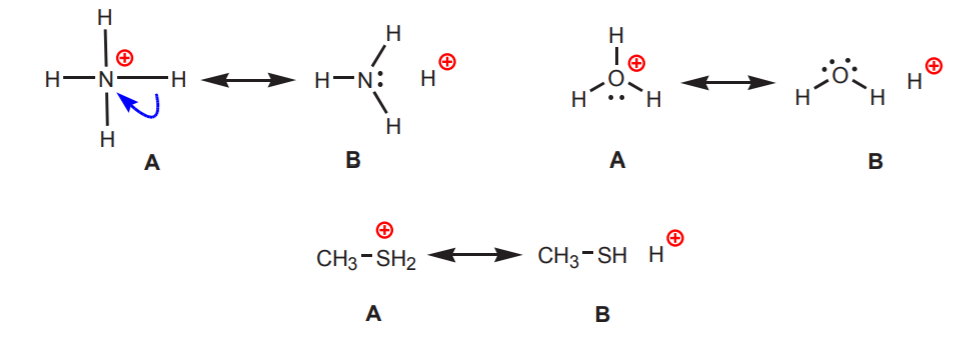
In tutti i casi la struttura B rivela il carattere positivo dell’idrogeno, e quindi la sua natura acida.
3. Come evidenziato dai valori pKa di alcani e alcheni, gli idrogeni attaccati al carbonio sono di acidità molto bassa. Tali sostanze non sono normalmente considerate acidi. Tuttavia, alcuni idrocarburi possono essere debolmente acidi se le loro basi coniugate sono ioni stabili. Questo può accadere nei seguenti casi.
a) Ci sono uno o più atomi elettronegativi vicino al protone in esame. L’effetto induttivo di questi atomi elettronegativi lascia gli idrogeni nelle vicinanze privi di densità di elettroni, e quindi con parziale carattere positivo.
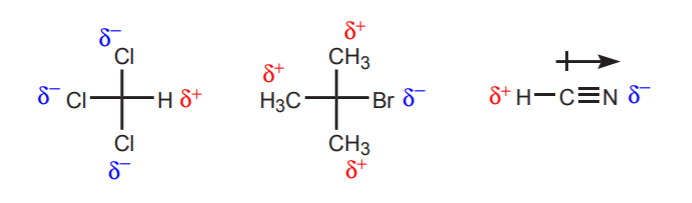
b) Un atomo di idrogeno legato a un carbonio che è a sua volta legato a un altro carbonio che porta una carica positiva parziale o totale è acido.
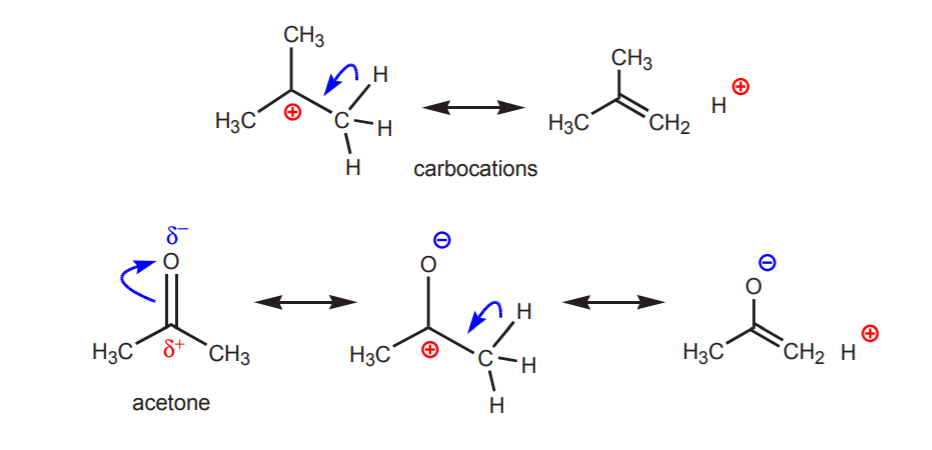
L’acidità dei protoni indicati diventa evidente nelle reazioni di eliminazione (capitolo 6) e nella chimica degli enoli (capitolo 22), quando la presenza di una base porta alla formazione di alcheni o di ioni enolati attraverso un passaggio che comporta un trasferimento di protoni.
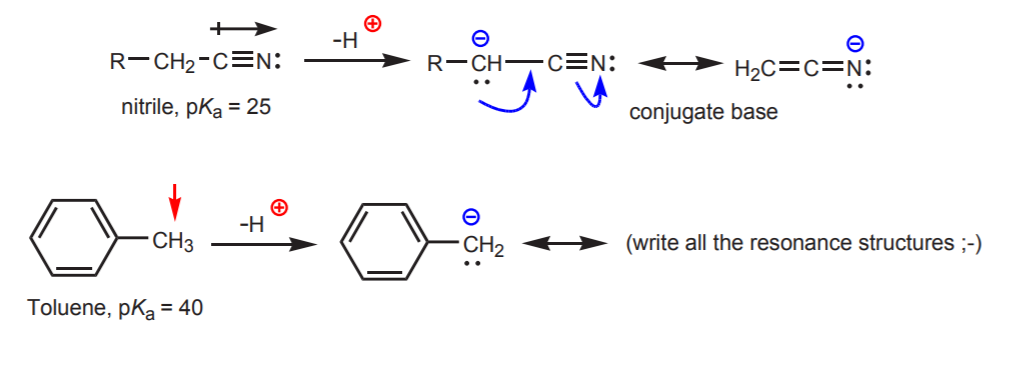
c) La base coniugata è stabilizzata dalla risonanza. Questo effetto è più importante quando c’è un altro fattore che aumenta l’acidità, come la presenza di un dipolo o di un atomo elettronegativo (come nel gruppo funzionale nitrile, -CN). Altrimenti la sola stabilizzazione della risonanza non è sufficiente per aumentare drammaticamente l’acidità di un idrogeno attaccato al carbonio (come nel toluene, dove il pKa è solo 40).
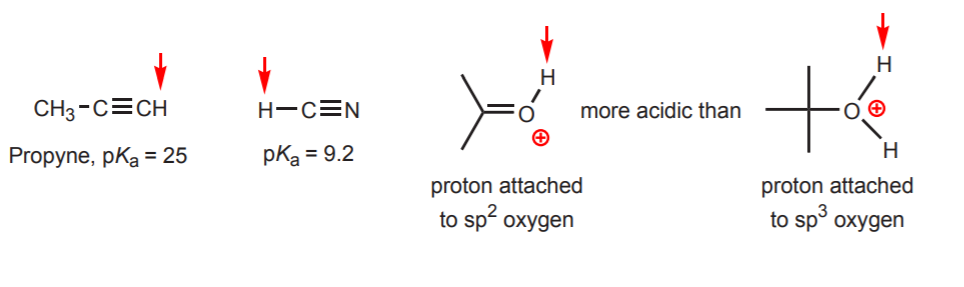
d) L’idrogeno è attaccato a un carbonio sp-ibridato. Gli effetti dell’ibridazione sull’acidità sono discussi nel capitolo 9. Le tendenze di ibridazione possono essere estese all’ossigeno e all’azoto oltre al carbonio, come nell’esempio a destra.