Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organized by the National Science Foundation and Science Magazine. (Lásd a kapcsolódó Science cikket.)
Vízáteresztő filmünk és a 2003-as kémiai Nobel-díj
The Art of Water Transport in Aquaporins
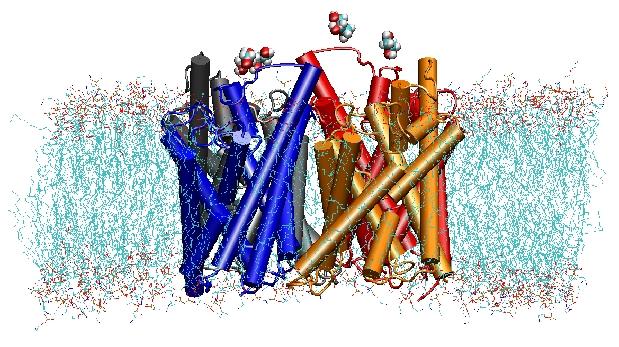
Az aquaporinok membrán vízcsatornák, amelyek kritikus szerepet játszanak a sejtek víztartalmának szabályozásában. Ezek a csatornák széles körben elterjedtek az élet minden királyságában, beleértve a baktériumokat,a növényeket és az emlősöket. Az emberi szervezetben több mint tíz különböző aquaporint találtak, és számos betegség, mint például a veleszületett szürkehályog és a nefrogén diabetes insipidus, e csatornák károsodott működéséhez kapcsolódik. Tetramereket alkotnak a sejtmembránban, és megkönnyítik a víz és bizonyos esetekben más kis oldott anyagok membránon keresztüli szállítását. A vízpórusok azonban teljesen áthatolhatatlanok a töltött fajokkal, például a protonokkal szemben, ami figyelemre méltó tulajdonság, amely kritikus a membrán elektrokémiai potenciáljának megőrzése szempontjából, ugyanakkor paradox, mivel a protonok általában könnyen átvihetők a vízmolekulákon keresztül. Szimulációink eredményei most új betekintést nyújtottak az e lenyűgöző tulajdonság hátterében álló mechanizmusba. A csatornán áthaladó vízmolekulákat a fehérje elektrosztatikus erői arra kényszerítik, hogy a csatorna közepén megforduljanak (lásd az animációt), és ezzel megbontják a protonok transzlokációjához szükséges alternatív donor-akceptor elrendeződést (a teljes történetet a Science Paperben olvashatják).

Functional Implication of a Peculiar Protein Architecture
2000-ben Stroud laboratóriumának az UCSF-en sikerült röntgenkrisztallográfiával megoldania egy aquaporin első nagyfelbontású szerkezetét. A vizsgált szerkezet az E. coliglicerinfelvételi facilitátor (GlpF) szerkezete volt, amely egy aquaglicerinoporin,azaz a csatorna a kis lineáris cukormolekulák, például a glicerin számára is áteresztő. A tetramerikus GlpF nanoszekundumos MD-szimulációi a POPE lipid kettősréteg hidratált foltjában jellemezték a szubsztrátvezetés teljes útját a csatornában. A szubsztrátnak a csatorna belsejével való hidrogénkötéses kölcsönhatásainak elemzése először magyarázta meg azt is, hogy ezek a csatornák miért tartalmaznak két jellegzetes hurkot az architektúrájukban, beleértve az energetikailag kedvezőtlen másodlagos szerkezeti elemeket, amelyek az egész aquaporinfamilyben konzerváltak (Jensenet al., Structure, 2001).
A cukorpermeáció energetikája
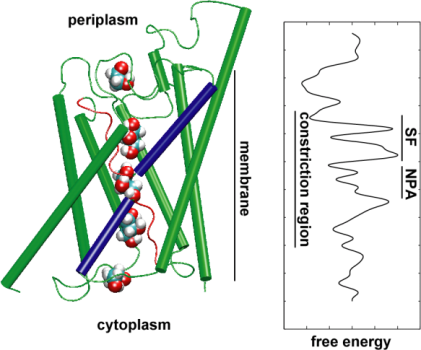
Ezután a transzportfolyamat energetikáját vizsgáltuk, hogy megértsük, milyen akadályokat kell a szubsztrátnak leküzdenie a csatornán való áthaladása során. A szabadenergia-profil leírásához kiszámítottuk az átlagos erő potenciálját a teljes vezetési eseményhez azokból a pályákból, amelyeken a glicerin mozgását a csatornán keresztül külső erők alkalmazásával gyorsítottuk. Ez az irányított molekuláris dinamika (SMD) néven ismert technika lehetővé teszi a lassú események megfigyelését az MD-szimulációk elérhető időskáláján belül. A pályák nem egyensúlyi jellege miatt azonban az eredmények elemzésekor az irreverzibilis munka problémájával kell számolni. A Jarzinsky-azonosság, a szabad energia és a munka egyenlősége a nem egyensúlyi rendszerekben, segítségével teljes mértékben le tudtuk írni a csatornán keresztül történő glicerintranszport energetikáját. A kiszámított átlagos erő potenciálja a csatorna főbb kötőhelyeit és akadályait rögzíti, szoros összhangban az egyensúlyi MD-szimulációk és a kristályszerkezet eredményeivel. Ezen túlmenően az alakja kifejezett aszimmetriát mutat, ami arra utal, hogy a fehérje aszimmetrikus szerkezete funkcionálisan fontos lehet a tápanyagmolekulák hatékony felvételéhez a környezetből. (Jensen, etal., PNAS, 2002).
What Makes an Aquaporin a Glycerol Channel
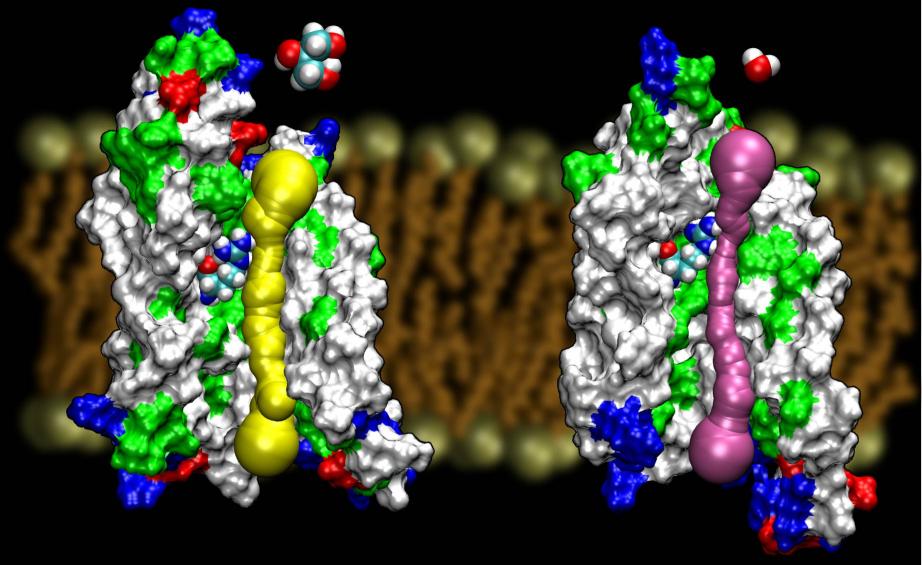
Az aquaporinok a membránfehérjék igen szerencsés családja,amelyek köztudottan ellenállnak a szerkezetmeghatározásnak. Számos AQP nagy felbontású szerkezetét ismerjük: GlpF, AQP1, AQP0 ésAqpZ. Várhatóan hamarosan további struktúrák jelennek meg. Az E. coliból származó két AQP szerkezete – az egyik egy tiszta vízcsatorna (AqpZ), a másik pedig egy glicerincsatorna (GlpF) – egyedülálló lehetőséget biztosított számunkra, hogy megértsük a természet által alkalmazott szelektivitási elveket, amikor két genetikailag és szerkezetileg nagyon homológ csatornát használunk a különböző anyagok membránforgalmazására.A glicerin vezetésére e két csatornában számított akadályok összehasonlítása kimutatta, hogy az AqpZ kihasználja a sztérikus akadályokat, hogy megnehezítse a glicerin átjutását. Valójában a pórus összességében szűkebb, mint a GlpF (lásd az alábbi ábrát). Úgy tűnik, hogy a természet egy nagyon alapvető mechanizmushoz, nevezetesen a csatorna pórusméretének beállításához folyamodott annak érdekében, hogy az ugyanabból a családból származó két fehérje eltérő vezetési tulajdonságokat mutasson. A teljes cikk a Wang, etal., STRUCTURE, 2005-ben olvasható.
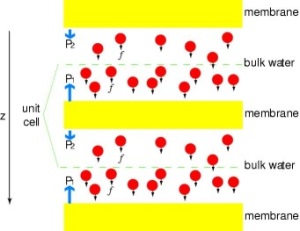
Putting Channels under Pressure
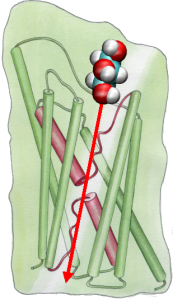
Annak érdekében, hogy az MDszimulációk eredményeit közvetlenül összehasonlíthassuk a membrán vízcsatornák vezetőképességének biokémiai méréseivel, amelyekben ozmotikus nyomásgradienseket használunk a víz membránon keresztüli áramlásának kiváltására, új módszertant fejlesztettünk ki az MD-szimulációkhoz. Azáltal, hogy kis erőket alkalmazunk a vízmolekulákra az ömlesztett tartományban (lásd az ábrát), hidrosztatikus nyomásgradiens keletkezik a membránon keresztül. A nyomásgradiens olyan vezetési sebességeket indukál, amelyek MD-szimulációkkal tanulmányozhatók, amelyek általában néhány nanoszekundumra korlátozódnak. A módszert alkalmazták a GlpF-en keresztül történő vízpermeáció szimulációjában, és lineáris korrelációt eredményezett az alkalmazott nyomás és a fluxus között (Zhu et al.,Biophys. J., 2002).
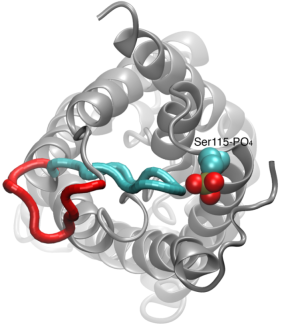
Vízcsatornák kapuzása
Az aquaporinokon keresztül történő vízpermeáció egy passzív folyamat, amely követi a membránon keresztül az ozmotikus nyomás irányát. Bár sok aquaporin mindig nyitott csatornaként működik, az aquaporinok egy alcsoportja, különösen a növényekben, olyan kifinomult molekuláris mechanizmust fejlesztett ki, amelyen keresztül a csatorna bezáródhat a környezet olyan zord körülményeire válaszul, amelyek között a vízcsere káros lehet a szervezet számára. Ilyen körülményekre példa a szárazságstressz és az árvíz, amelyek bizonyos sejtszintű jeleket váltanak ki (defoszforiláció és pH-változás), amelyek a csatorna záródását eredményezik. Egy spenótból származó aquaporin nemrégiben megoldott szerkezetét szimuláltuk különböző körülmények között, hogy megvizsgáljuk a kapuzás molekuláris mechanizmusát ezekben a membráncsatornákban. Megállapítottuk, hogy a kapuzásra képes aquaporinokban egy megnyúlt citoplazmatikus hurok fizikailag elzárja a vízpórus bejáratát a zárt csatornában, és megakadályozza a vízmolekulák pórushoz való hozzáférését. Ennek a huroknak a foszforiláció hatására történő elmozdulása, amint azt a szimulációkban megfigyeltük, eltávolítja a hurkot a pórus citoplazmatikus bejáratától. Továbbá, egy hidrofób aminosav, amely konformációsan szorosan kapcsolódik ehhez a hurokhoz, a hurok elmozdulása következtében visszahúzódik a csatornából. Ezek a molekuláris események együttesen egy nyitott csatornát eredményeznek, amely vízmolekulák számára átjárható. A tanulmány a Nature2006 című folyóiratban jelent meg.

Gating and Ion Conductivity of the Tetrameric Pore
Az AQP-k általában magas vízáteresztő képességükről ismertek. Azonban más sejtfunkciókban való részvételüket, beleértve a vízen kívüli kismolekulák permeációját, valamint a sejt-sejt kommunikációban való részvételüket is feltételezték. A tetramerizáció az AQP-k közös szerkezeti jellemzője. Az a tény, hogy a négy monomer mindegyike funkcionálisan független vízpórust képez, de a működéshez tetramer szerveződésre van szükség, az oligomerizáció szinergikus előnyére utal, és így az AQP-kben a központi pórus lehetséges szerepének további elemzését teszi szükségessé. Érdekes felvetés a központi pórus lehetséges részvétele az ionvezetésben a cGMP aktiválásakor. Az AQP1 membránba ágyazott modelljeinek MD-szimulációjával megvizsgáltuk az AQP1 e tulajdonságát, hogy meghatározzuk, hogyan és milyen konformációs és hidratációs körülmények között vezethet a központi pórus, és hogyan szabályozható a vezetőképesség. Az egyik citoplazmatikus hurok, nevezetesen az argininben gazdag D hurok, a szimulációink szerint kulcsszerepet játszik a centrális pórus cGMP által közvetített aktiválásában. A D hurok feltételezett szerepét kísérleti úton igazolták a D hurok egy tervezett mutánsával, amely az ionvezetés teljes elvesztését mutatta ( Yu et al.,Structure, 2006 ).
Gázmolekulák ingáznak a sejtbe
Minden reggel sokan autóval mennek a munkahelyükre, míg mások kerékpárral, busszal vagy metróval.hasonlóan az emberi szervezetben lévő különböző biomolekulák is változatos módon jutnak el a céljukhoz. Például a sejtmembránon való átjutáshoz a kis hidrofób gázmolekulák a lipidrétegen keresztül diffundálnak, míg a vízmolekulák az aquaporinokon (AQP-k) keresztül jutnak át.Érdekes módon, ahogyan az ember busszal és autóval is eljuthat a munkahelyére, nemrégiben azt találták, hogy egyes gázmolekulák többféleképpen is átjuthatnak a membránon, azaz, a lipideken keresztüli diffúzió mellett az oxigén és a szén-dioxid is áthaladhat az AQP-ken.Azonban az, hogy ezek a gázmolekulák milyen utakat járnak be, megfoghatatlan maradt.NAMD-vel végzett molekuladinamikával vizsgáltuk az AQP1 gázáteresztő képességét két egymást kiegészítő módszerrel (explicit gázdiffúziós szimuláció és implicit ligandsampling). A szimulációs eredmények arra utalnak, hogy míg az AQP1 négymonomer pórusai vízcsatornaként működnek, az AQP1 központi pórusa a gázmolekulák számára a membránon való áthaladás útjaként szolgálhat (Wang et al., Journal of Structural Biology, 2007 ).
Molekuláris akadálypálya
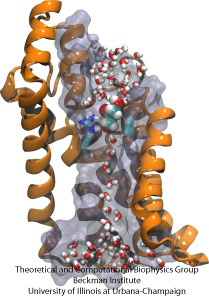
A biológiai sejtek a sejtmembránokon keresztül védik a belsejüket, mégis a tápanyagok importjára támaszkodnak. Ehhez az importhoz gyors vezetési csatornákat fejlesztettek ki, amelyek megbízható ellenőrző pontokat tartalmaznak, amelyek megkülönböztetik a kívánatos és nem kívánatos vegyületeket. Az ellenőrzőpontok valóságos akadálypályát állítanak fel, amelyen csak a megfelelő vegyületek tudnak gyorsan áthaladni. A csatorna kialakításának megértése nehéz a tápanyagok dinamikájára vonatkozó részletes kísérleti adatok hiánya miatt. Jelenleg a legrészletesebb információk a csatornadinamika számításos vizsgálatából származnak, statikus kristályszerkezetekből kiindulva. Egy nemrégiben készült tanulmány azt vizsgálta, hogy a glicerin, az egyes baktériumok számára szükséges kis tápanyagmolekulák hogyan jutnak át a GlpF glicerincsatornán keresztül megvalósított ellenőrzőpontokon. A GlpF négy párhuzamos csatornát biztosít, amelyeket NAMD és egy új algoritmus segítségével számítással követtünk nyomon, amely elég gyorsan feltárja a csatorna energetikáját ahhoz, hogy módszertanilag megvalósítható legyen a mai számítógépeken. Az eredmények azt mutatják, hogy a glicerin fizikai jellemzői, az úgynevezett hidrogénkötések kialakítására való képességük, elektromos dipólusmomentumuk, diffúziós mobilitásuk és saját rugalmasságuk hogyan szondázható a csatorna mentén (Henin et al, Biophysical Journal, in press ).
Aquaporin kutatásaink a hírekben
|
Aquaporin Team
|
Publikációk
-//W3C//DTD XHTML 1.0 Transitional//EN” “http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Diffusion of glycerol through Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, and Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, and Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. A növényi aquaporin kapuzás szerkezeti mechanizmusa.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze és P. Kjellbom. Nature, 439:688-694, 2006. Mitől lesz egy aquaporin glicerincsatorna: Yi Wang, Klaus Schulten és Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Egycsatornás víztranszport kinetikai elmélete és szimulációja.Emad Tajkhorshid, Fangqiang Zhu és Klaus Schulten. In S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Hollandia, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, and Klaus Schulten. In Boris Martinac and Andrzej Kubalski, editors, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Kollektív diffúziós modell a mikroszkopikus csatornákon keresztül történő vízpermeációra: Fangqiang Zhu, Emad Tajkhorshid és Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 oldal). Computational studies of membrane channels.Benoit Roux és Klaus Schulten. Structure, 12:1343-1351, 2004.