Ezek a jegyzetek a Harvard Extension sejtbiológia kurzusának 4. előadásából származnak.
A szekréciós útvonal az endoplazmatikus retikulumra, a Golgi készülékre és a köztük lévő vezikulákra, valamint a sejtmembránra és a lizoszómákra utal. Azért kapta a “szekréciós” nevet, mert ez az az útvonal, amelyen keresztül a sejt fehérjéket választ ki az extracelluláris környezetbe. De mint általában, az etimológia csak a történet töredékét mondja el. Ez az útvonal dolgozza fel azokat a fehérjéket is, amelyek membránhoz lesznek kötve (akár a sejtmembránban, akár magukban az ER- vagy Golgi-membránokban), valamint a lizoszomális enzimeket, és minden olyan fehérjét is, amely magában a szekréciós útvonalban éli életét. A fehérjék feldolgozásán kívül más dolgokat is végez.
A citoszol és a “lumen” (a szekréciós utat kitöltő folyadék) különböző kémiai környezetek, és általában soha nem keverednek. A citoszol reduktív (amikor a citoszolban vagy, folyamatosan olyan molekulákkal találkozol, amelyek elektronokat akarnak felajánlani neked), az ER, a Golgi és az extracelluláris környezet pedig oxidatív (folyamatosan olyan molekulák jönnek fel hozzád, amelyek elektronokat kérnek). Lásd redox, ha még mindig zavaros. Ez különböző fehérje-összehajlási körülményeket eredményez: például a diszulfidkötések általában csak oxidatív körülmények között alakulnak ki. Továbbá különböző fehérjék élhetnek csak a szekréciós útvonalon vagy csak a citoszolban. A szekréciós útvonal egy olyan útvonalat biztosít a sejt számára, amelyen olyan dolgokat kezelhet, amelyeket nem lenne jó a citoplazmában tartani, és/vagy amelyek akkor a leghasznosabbak, ha egy speciális kompartmentben koncentráltan, a kívánt kölcsönhatási partnereikkel együtt tartják őket. A hepatociták (a májban) a sima ER-ben szekvenálják a gyógyszereket és toxinokat, és ott bontják le őket a szervezetből való kiválasztás céljából. A szekréciós útvonal nem összefüggő, hanem minden mozgás a komponensei között a saját kémiai világának kis buborékos mikrokozmoszaiban, úgynevezett vezikulákban történik.
A szekréciós útvonalon keresztülhaladó fehérjék közül sok soha nem érinti a citoszolt – kivéve a membránfehérjéknek a citoszol oldalán kilógó részeit. Sokuknak chaperonokra van szüksége a hajtogatáshoz és/vagy egy egész sor poszttranszlációs módosításra ahhoz, hogy készen álljanak a natív funkciójukra, és a szekréciós útvonal arra specializálódott, hogy mindezt biztosítsa számukra.
A mai előadás arra fog összpontosítani, hogyan kerülnek a fehérjék az ER-be, és hogyan utaznak (vezikulákban) az ER, a Golgi és más rendeltetési helyek között. Ezt gyönyörűen ábrázolja A sejt élete című videó:
Az endoplazmatikus retikulum az első lépés a szekréciós útvonalban. A membránja folytonos a külső magmembránnal, bár nem világos, hogy ez miért számít, hiszen nem úgy van, hogy a fehérjék a sejtmagban kezdik az életüket. Inkább az mRNS-ek sodródnak a citoplazmában, amíg fel nem veszi őket egy, a lefordításukban érdekelt riboszóma. A “poszttranszlációs transzlokáció” során az új fehérje a fordítás után az ER-be kerül. A “cotranszlációs transzlokációnak” nevezett érdekesebb jelenség során a riboszóma ugyanúgy kezdi meg a transzlációt, mint bármely más fehérje esetében, de valahol az első 16-30 aminosav között egy jelző peptidre (más néven jelzőszekvenciára) bukkan. Ez a szignál motívum gyakran 1 pozitív töltésű aminosav, amelyet 6-12 hidrofób aminosav követ. Ezt a motívumot felismeri a szignálfelismerő részecske (SRP, egy “ribonukleoprotein” vagy hibrid RNS/fehérje molekula), amely kötődik hozzá, és megakadályozza a riboszómát a transzláció folytatásában. A transzláció mindaddig leáll, amíg a riboszóma/SRP komplex nem találkozik egy SRP-receptorral az ER-membránon. Amikor találkoznak, az SRP és receptora egy-egy GTP-molekulát köt meg az ER-membránban, ami nyilvánvalóan megerősíti kölcsönhatásukat. Szerencsés módon mindez egy Sec61 transzlokon – egy fehérjekomplex, amely az ER-membránon átvezető csatornát képez – szomszédságában történik. A transzlokon valójában három különböző fehérjéből álló komplex (gének: SEC61A1 vagy SEC61A2, SEC61B, SEC61G), amelyek közül a Sec61a alegység 10 membránon átívelő a-hélixszel rendelkezik, amelyek a csatornát alkotják. Miután a riboszóma a membránhoz dokkolt, folytatja a transzlációt, a jelzőpeptidet és végül a teljes fehérjét a csatornán keresztül az ER lumenébe tolja. Amikor a transzláció leáll, az SRP és az SRP receptor egyaránt hidrolízisbe hozza a GTP-t, hogy felszabadítsák egymást és a riboszóma rakományát (ehhez a GTP energiájára van szükség, mivel az eredeti kötés lefelé történt), egy szignálpeptidáz lehasítja a szignálpeptidet a születő fehérjéről, és a fehérje szabadon elkezdheti a hajtogatást az ER-ben.
Az ER néhány fehérjéje esetében még néhány más szereplő is részt vesz. Az oligoszacharid-transzferáz, amely glikozilcsoportokat ad a naszcens fehérje aszparaginjaihoz, a transzlokon-komplex része, és ténylegesen elvégzi a glikozilálást, miközben az új fehérje még mindig fordítás alatt van. Tehát bár a glikozilációt “poszt-transzlációs módosításnak” nevezzük, ebben az esetben valójában a transzláció során történik. Továbbá, a megfelelő szerkezet eléréséhez egyes fehérjéknek teljesen le kell fordítaniuk, mielőtt elkezdenek hajtogatni – ha az N-terminális résznek megengednénk, hogy a lumenbe kerülve azonnal elkezdje a hajtogatást, akkor a végeredmény nem a megfelelő általános szerkezetű lenne. Ennek megakadályozására néha a BiP, a chaperon megköti a fehérjét, hogy egy darabig kibontatlanul tartsa azt. Képzeljük el a BiP-t egy másik Pac-Man-ként, amely ráharap a fehérjére, hogy lineárisan tartsa azt, mint a Hsc70 a mitokondriális célzás folyamatában (lásd múlt héten).
Itt egy videó erről:
Az első pár percben a fent leírt alapforgatókönyv látható. Aztán áttér egy összetettebb forgatókönyvre, amit egy perc múlva bemutatok. FYI, a videó két “ellentmondásos” dolgot ábrázol, ami nem szerepel a fenti leírásban: (1) a szignálpeptid lebomlását a membránban, és (2) egy “dugófehérjét”, amely elzárja a csatornát a transzláció előtt/után. Ebben a két dologban még nem minden tudós ért egyet.
Az összes fehérjét, amelyről tudjuk, hogy a szekréciós útvonalon halad át, az emberek lokalizációs kísérleteket végezve mutatták ki, hogy egy fehérje hol helyezkedik el a sejtben. Furcsa tény az ER-rel kapcsolatban, hogy beteheted a sejtet egy turmixgépbe, és utána az ER egyszerűen elkezd újra összekapcsolódni önmagával, kis “mikroszómákat” képezve, amelyek nem kapcsolódnak a sejtmaghoz, hanem egybefüggő ER-buborékokat alkotnak. Ezután elkezdhetünk játszani a proteázokkal – amelyek lebontják a fehérjéket – és a detergensekkel – amelyek szolubilizálják az ER membránt. Feltételezve, hogy az érdeklődésedre számot tartó fehérje transzlálódik, ellenőrizheted, hogy ha (1) túléli a proteáz kezelést, de (2) nem éli túl a proteáz + detergens kezelést, akkor ez egy szekréciós útvonal fehérje. A logika az, hogy (1) esetben az ER-en belül védve volt, de (2) esetben feloldottad az ER-t, így megette a proteáz. Mindez feltételezi, hogy van egy antitestünk vagy valamilyen más módunk arra, hogy kimutassuk, hogy a kívánt fehérje ott van-e a kezelések után.
Az emberek arra is használtak ilyen technikákat, hogy kitalálják, hogy egy új fehérjéből csak 70 aminosavat lehet lefordítani, mielőtt túl késő lesz ahhoz, hogy a fehérje az ER-be kerüljön. Ne feledjük, hogy a szignálpeptid az első 16-30 aminosavban van, és az ER-be való transzlokáció az SRP jelenlététől függ. A riboszómák kiszámítható sebességgel transzlálnak, ezért az emberek beindították a riboszómákat néhány mRNS lefordításával, majd meghatározott ideig vártak az SRP hozzáadásával, hogy lássák, mennyi transzláció történhet, mielőtt az SRP már nem tudja elvégezni a feladatát.
Az SRP receptor és a Sec61 fehérjék ER membránfehérjék – és sok más ER membrán, Golgi membrán és lizoszóma membránfehérje is van. Valójában még a sejtmembrán membránfehérjék (lásd 02. osztály) is feldolgozásra kerülnek a szekréciós útvonalban. Ezek közül soknak több vagy több tíz transzmembrán doménje van (egyenként 20-25 hidrofób aminosav), amelyeket a megfelelő sorrendben és orientációban kell beilleszteni (például nagyon fontos, hogy az ioncsatornák és transzporterek a megfelelő irányba mutassanak, a sejtbe befelé, illetve a sejtből kifelé). Ennek megfelelően egy csomó furcsa biológiai mechanizmus létezik arra, hogy ezek a fehérjék helyesen illeszkedjenek a membránba. Ezt mutatja be a fenti videó második fele.
Az alábbi tautológia: egyes fehérjéknek van egy topogén szekvenciájuk, amely meghatározza az orientációjukat a membránban. Ez a szekvencia kétféle szignálszekvenciából áll:
- a stop-transzfer szekvencia (valamiért rövidítve STA) egy 22-25 hidrofób aminosavból álló szekvencia valahol a fehérje közepén, amely egy alfa-hélixet alkot. Amikor találkozik vele, a membránba tolódik, majd a fehérje többi részének transzlációja a citoszolban folytatódik. Ez tehát mintegy “visszacsinálja” az ER-be történő transzlokációt, amelyet a fehérje elején (N-terminusán) lévő szignálpeptid indított el.
- a szignálhorgony-szekvencia (rövidítve SA) szintén egy 22-25aa hidrofób alfa-hélix, de egy ~3 pozitív töltésű aminosavból álló sorozattal a bal vagy jobb oldalán. A szignálpeptidhez hasonlóan ezt is felismeri az SRP, amely a riboszómát az ER-hez juttatja. A szignálpeptiddel ellentétben azonban ez az alfa-hélix szekvencia beilleszkedik az ER membránba. A beillesztés orientációját a 3 pozitív töltésű aminosav határozza meg. A pozitív töltéseknek mindig a citoszolikus oldalon kell végződniük, így ha a hidrofób szekvencia után (azaz C-terminálisán) érkeznek, akkor a fehérje C-terminális vége a citoszol felé mutat, ha viszont a hidrofób szekvencia előtt (azaz N-terminálisán) érkeznek, akkor a fehérje N-terminálisa a citoszol felé mutat.
Ezzel a két szignállal mint építőelemmel elképzelhetünk egy olyan fehérjét, amely egy sor stop transzfer és szignálhorgony szekvenciával rendelkezik, hogy egy egész sor oda-vissza transzmembrán domént hozzon létre, amelyeket mintha varrógép varrt volna a membránba. Az emberek öt kategóriába sorolták a membránfehérjéket:
- Az I-es típusnak csak egy szignálpeptidje van, majd középen egy stop transzfer. Ezért a (hidrofil) N-terminusa a lumenben, a (hidrofób) közepe a membránban, a (hidrofil) C-terminusa pedig a citoszolban végződik.
- A II-es típus nem kezdődik jelzőpeptiddel. Úgy indul, mint bármely más fehérje, de a közepén van egy szignálhorgony szekvencia, ahol a +++ aminosavak következnek először, és a hidrofób sorozat utána. Ezáltal a fehérje a transzláció közepén transzlokálódik, a már transzlált N-terminális rész kilóg a citoszolba (mivel a +++-nak citoszolban kell maradnia), a most kezdődő, transzlálandó C-terminális rész pedig közvetlenül az ER-be kerül. Így végül transzmembrán lesz, a C-terminus az ER-ben, az N-terminus pedig a citoszolban – ellentétben az I. típussal.
- A III. típus olyan, mint a II. típus – nincs szignálpeptid, csak egy szignálhorgony középen, de ebben az esetben a +++ a hidrofób szekvencia után következik, ami megfordítja az orientációt. Tehát az N-terminus az ER-ben, a C-terminus pedig a citoszolban van. A II-es típussal ellentétes, és végső soron ugyanaz, mint az I-es típus, bár más módon jutott oda – nincs szignálpeptidje, amely az ER-ben lehasad.
- A IV-es vagy “multipass” típusú fehérjéknek szignálszekvenciák és stop transzfer szekvenciák váltakozó sorozata van. Ezek egyértelműen több mint egy “típus”, de közel sem olyan változatosak, mint amennyire a kombinatorikus képzeleted engedi. Az első szignálszekvencia orientációja határozza meg, hogy az N-terminus a citoszolban vagy az ER-ben végzi-e, és a stop transzfer + szignálhorgony szekvenciák teljes száma határozza meg, hogy a C-terminus hol végzi: páros számú = az N-terminussal azonos oldalon, páratlan számú = az N-terminussal ellentétes oldalon. Az STA és SA szekvenciáknak szigorúan váltakozniuk kell, azzal a kivétellel, hogy két szignálhorgony szekvenciával is lehet kezdeni, ha az első az N terminussal a citoszolba orientálódik. Csak hogy gúnyt űzzünk ebből a kategorizálási sémából, az emberek definiáltak néhány hiányosan definiált IV-es típus altípust, ahol a IVa típus N-terminálisan a citoszolban van (tehát úgy indul, mint egy II-es típusú fehérje), a IVb típus pedig N-terminálisan a lumenben (úgy indul, mint egy III-as típusú fehérje, de aztán van egy másik SA-szekvencia, amely visszahelyezi az ER-be). A 02-es osztályba tartozó GLUT1 egy IVa típus.
- A GPI-horgonyzott fehérjék, amelyek az ötödik típus, de nem nevezzük V típusnak, egy jelzőpeptiddel kezdődnek és egy hidrofób C-terminussal végződnek, amely a membránba ágyazva marad. Ezt a hidrofób véget lehasítják és GPI-vel helyettesítik, amely szintén a membránba ágyazva marad. A PrP ezek közé tartozik – erről majd később.
Most már beszéltünk arról, hogy a fehérjék hogyan kerülhetnek az ER lumenébe vagy az ER-membránon átívelve. A legtöbb fehérje perceken belül elhagyja az ER-t, a Golgi, majd később a kiválasztás, a lizoszómák vagy a sejtmembrán felé kötött vezikulákban szállítják. Ezt az előre irányuló haladási irányt anterográdnak nevezzük; a Golgiból az ER-be való visszafelé haladást retrográd transzportnak nevezzük.
A transzport mindkét típusa membránhoz kötött vezikulákban zajlik. Ezek leválnak annak a helynek a membránjáról, ahonnan jönnek, és később összeolvadnak annak a helynek a membránjával, ahová tartanak – a fenti Life of the Cell videón ~2:25-nél gyönyörűen látható. A test, amelyből a vezikulák kialakulnak, a “donor rekesz”, és a célállomás, ahová később összeolvadnak, az “akceptor rekesz”.
A bimbózási folyamat megköveteli, hogy a membránban lévő G fehérjék toborozzák a Coat fehérjéket. Konkrétan az anterográd transzporthoz a Sar1 G-fehérje (gén: SAR1A) toborozza a COPII-t (“cop two”); a retrográd transzporthoz egy ARF G-fehérje toborozza a COPI-t (ejtsd: “cop one”). Ezek a G-fehérjék akkor aktiválódnak erre a feladatra, amikor a GEF GTP-vel tölti fel őket, kicserélve a GDP-t.
Az anterográd transzport lépései tehát például a következők:
- A Sec12-GEF (a Sec a szekréciósat jelenti) GTP-vel tölti fel a Sar1-et. Ha GDP-hez kötődik, a Sar1 csak lebeg a donorkompartmentben, de ha GTP-hez kötődik, konformációs változáson megy keresztül, amelynek hatására az egyébként kiégett N-terminális hidrofób farka kiáll, így a membránba tapad, ahol aztán a COPII fehérjék elkezdenek felhalmozódni, mert nagyon szeretik ezt a farkat.
- A COPII-k elkezdenek polimerizálódni, és a konformációja miatt sajátos preferenciája van a görbület, így felhalmozódásuk elindítja a bimbózást. Ezzel egyidejűleg a membránhoz kötött, szállítani kívánt fehérjék – amelyeket a citoszolikus részükben egy kötőhelyet alkotó DXE (azaz aszpartát-minden-glutamát) aminosav szekvencia alapján azonosítanak – rekrutálódnak az újonnan kialakuló vezikulába. A membránhoz kötött fehérjék receptorként működnek, és a Golgi számára kötött lumenes fehérjéket toborozzák, hogy a homorú térben lógjanak, ahol a kialakulás után a vezikulába kerülnek.
- Mihelyt elegendő COPII érkezik, a vezikulum leválik, ekkor a Sar1 hidrolizálja a GTP-t, ami biztosítja az energiát ahhoz, hogy hidrofób farkát visszaszívja magába, és levágja a COPII-ket. A vezikulum most már leválik a donorkompartmentről.
- Most, rosszul megmagyarázott (vagy rosszul értett?) okokból a COPII-k burka egyszerűen szétesik, felfedve a burka alatti receptorokat, amelyek a vezikulum célba juttatását irányítják. Amint a vezikulum megérkezik a célállomásra, a vezikulamembránba ágyazott Rab-GTP kölcsönhatásba lép az akceptor rekesz membránjába ágyazott Rab effektorral. Egy oldalpillantás cserélődik, az érdeklődés felkeltődik. Hamarosan a vezikulum összeolvad a membránnal.
- A vezikulán és a célmembránon egyaránt jelen lévő SNARE-fehérjék (V-SNARE és T-SNARE) kölcsönhatásba lépnek, hogy a membránokat még közelebb hozzák egymáshoz. Ebben a példában a VAMP-ot (a VAMP_ gének) tekintjük V-SNARE-nak, a Syntaxint (az STX__ gének) és a SNAP25-öt (SNAP25 gén) pedig T-SNARE-nak. A Syntaxin és a SNAP25 mindkettő membránfehérje; a Syntaxinnak 1 alfa-hélixe van, a SNAP25-nek pedig 2, mindkettő a citoszolikus oldalon. Az alfa-hélixek irányítják a VAMP-pal való kölcsönhatást. Az ellentétes oldali alfa-hélixek rendkívül erős affinitással rendelkeznek egymáshoz, ami elég közel hozza a membránokat ahhoz, hogy összeolvadjanak. Ha ez megtörtént, a V-SNARE-k és a T-SNARE-k szétfeszítéséhez ismét két fehérje szükséges: NSF (gén: NSF; a NEM-szenzitív faktor rövidítése) és az alfa-SNAP (gén: NAPA), egy oldható NSF-kötőfehérje. Az NSF egy ATP-áz, és ATP-t éget el, hogy a komplex energetikai szempontból felfelé irányuló szétszerelését hajtsa.
Következik a retrográd transzport. Miért van egyáltalán retrográd transzport? Íme egy nem kimerítő lista néhány okról:
- Néhány membránfehérje az ER-ben kezdi életét, a Golgiban kell módosulnia, de aztán vissza kell jutnia az ER-be. Ezt egy KKXX aminosav szekvenciával teszik meg.
- Egy KDEL aminosav szekvencia is van néhány lumenális fehérje C terminusán, amely feltehetően az ER-ben tartja őket, de ez nem tökéletes – néha a Golgiban kötnek ki, ilyenkor retrográd transzporton keresztül az ER-be kerülnek vissza, amely a KDEL szekvencia felismerésétől függ. A mechanizmus elég ügyes – a fehérjék, amelyek felismerik a KDEL-t és kötődnek hozzá, ezt csak alacsony pH-n teszik, és a Golgi pH-ja alacsonyabb, mint az ER-é, így a Golgiban megkötik a KDEL-t, majd felszabadítják, amikor visszakerülnek az ER semlegesebb pH-jára.
- Az összes olyan fehérje, amely részt vesz az anterográd transzportban – a V-SNARES, Rab, stb. – vissza kell jutniuk az ER-be, hogy az egészet elölről kezdhessék, mint ahogyan a busznak is vissza kell jutnia a buszpályaudvarra a nap végén.
- Amint hamarosan látni fogjuk, a Golgi több szakaszban jön, amelyek a lejjebb lévő enzimek hozzáadásától függnek.
A retrográd transzport folyamata nem sokban különbözik az anterográdtól. A Sar1 helyett ARF-et, a COPII helyett COPI-t használ, de ugyanúgy működik: a GTP-vel megrakott ARF hidrofób farka a membránba tapad, így vonva magára a COPI-k figyelmét. A COPI-nak két komponense van, a COPIalfa és a COPIbéta, amelyek mindketten kölcsönhatásba lépnek a KKXXX szekvenciával, hogy a retrográd transzportra szánt membránhoz kötött fehérjéket toborozzák. Egyes fehérjéknek van egy RR szekvenciája is (bárhol a fehérjében), amely megjelölheti őket a retrográd transzportra.
A Golgi apparátus nem összefüggő. Ez különálló alrészek egymásra épülő halmaza, amelyeket zsákoknak vagy ciszternáknak neveznek. A különböző rekeszek különböző tulajdonságokkal rendelkeznek, és a fehérjék meghatározott sorrendben látogatják őket. Az ER-től a sejtmembránig terjedő sorrendben a Golgi-kompartmentumokat cisz-, mediális, transz- és transz-Golgi-hálózatnak nevezzük. Minden kompartmentben más-más enzimek módosítják a fehérjéket, és a módosításoknak meghatározott sorrendben kell megtörténniük, ezért van szükség a kompartmentek egymásra épülésére.
De ahogy a fehérjék a Golgiban érnek, nem úgy történik, hogy az egyik kompartmentből vezikulákban rügyeznek ki, és átkerülnek a következőbe. Inkább az a kompartment, amelyben már vannak, kifelé mozog és “érik”, ahogy új enzimek kerülnek hozzá (a Golgi láncban lejjebb lévő enzimekből) retrográd transzporton keresztül. Furcsa, ugye? Olyan ez, mintha ahelyett, hogy általános iskolából középiskolába, majd gimnáziumba költöznél, egész gyermek- és serdülőkorodban egy iskolai épületben maradnál, és minden évben új tankönyveket és tanárokat hoznának, hogy minden évfolyam megfeleljen annak a fokozatnak, amit te és az osztálytársaid már elértetek. Így néz ki a Golgi, ahogy mozog és fejlődik:
A Golgin belül tehát (kevés vagy) nincs anterográd transzport, de rengeteg retrográd transzport van, hogy az enzimek minden egyes új körét behozzák. Amikor a fehérjék végül teljesítették a Golgi-hálózat teljes K-12 tananyagát, valóban transzporton mennek keresztül, hogy továbbhaladjanak végső rendeltetési helyükre. Egy vezikulában bimbóznak ki, amely három hely valamelyikére kerül:
- Exocitózis – fúzió a sejtmembránnal. Így a lumenfehérjék extracellulárisan szekretálódnak, a membránfehérjék pedig sejtmembránfehérjékké válnak.
- Szekréciós vezikulák – ezek csak vezikulaként maradnak a sejtben, amíg szükség van rájuk – ahol a “szükség” azt jelenti, hogy végül exocitózison mennek keresztül. A neuronokban itt tárolják a neurotranszmittereket, amíg egy akciós potenciál meg nem követeli a szinapszisba történő kiválasztásukat. A gyomorban a gyomorenzimeket termelő sejtek ezeket az enzimeket szekréciós vezikulákban tartják mindaddig, amíg a táplálékfelvétel nem váltja ki a gyomorba történő felszabadulásukat.
- lizoszómák – ahová a rosszul hajtogatott fehérjék kerülnek, hogy lebomoljanak.
A transz-Golgi-hálózatból ezekbe a célállomásokba történő szállítás különbözik a fent tárgyalt többi transzporttól, és gyakran klatrin (CLT__ gének) bevonásával történik. A bimbózó vezikulák kétrétegű bevonattal rendelkeznek, melynek belső rétege az adapterfehérje (AP) komplexek, külső rétege pedig a klatrin. Az adapterfehérjéknek YXXh-motívummal (h = Φ = bármely hidrofób aminosav) rendelkező céljelük van. A klatrin alkotja az itt látható úgynevezett “klatrin-triskelion” képződményt:

(A kép köszönet a Wikimedia Commons felhasználó Phoebus87-nek)
A klatrin felelős az endocitózisért is – az extracelluláris anyagok (és a sejtmembrán fehérjék) vezikulákból való kibuggyanásáért, hogy a sejtbe jussanak. Ezt nevezzük klatrin-mediált endocitózisnak. A sejtmembránban lévő receptorok nagyon gyakran endocitálódnak: a hormonreceptorok teljes populációja körülbelül óránként cserélődik, különösen a hormonok beérkezésekor. A receptor felvétele egy vezikulába az egyik módja annak, hogy a sejt elzárja a beérkező jelet, amíg azt fel nem dolgozza.
A plazmamembrán jegyzetek röviden tárgyalják a cisztás fibrózist: A CFTR egy ABC transzporter, amely a Cl- kiszivattyúzásáért felelős a sejtből (Na+-ot is beenged). A funkcióvesztéses mutánsok nem pumpálják a Cl–t, ami megszünteti az ozmózis hajtóerejét, besűrűsödik a nyálka és légzési problémákat okoz. Legalább 127 különböző funkcióvesztéses CFTR-mutáns létezik (legalábbis a Natera ennyit vizsgál), amelyek (ha mindkét allél hatástalan) cisztás fibrózist okoznak. A leggyakoribb mutáció a ΔF508, amely az összes európai CFTR allél ~3%-át teszi ki, és a mutánsok kb. 70%-át. Ennek az egy fenilalaninnak az elvesztése úgy változtatja meg a CFTR konformációját, hogy a di-savas kilépési kód (D565 és D567 aminosavak), amely a CFTR-t az exocitotikus vezikulákhoz célozza, már nem megfelelően exponálódik, és a fehérje soha nem jut el a sejtmembránig .
megbeszélés rész
A részben olvastuk Hu 2009, aki kimutatta, hogy az atlasztin fehérjék részt vesznek a tubuláris ER hálózat létrehozásában. A bizonyíték szinte teljes egészében fehérje-fehérje kölcsönhatásokból származott. Meglepődtem, hogy ez a cikk nagyot szólt, mert a huntingtin fehérje-fehérje kölcsönhatásait milliónyi cikk mutatta már ki, és senki nem igazán hiszi el mindet, és ez nem feltétlenül juttatott közelebb ahhoz, hogy megtudjuk, mit csinál a huntingtin, vagy mi a baj a Huntington-kórban. De úgy tűnik, Hu képes volt elég tisztán alátámasztani, hogy az atlasztinok és a retikulonok kölcsönhatásai az ER-képződésben betöltött szerepükre utalnak. Segít, hogy Hu a fizikai (kötődési) kölcsönhatás mellett egy “genetikai kölcsönhatást” is ki tudott mutatni. A “genetikai kölcsönhatás” (utána kellett néznem) azt jelenti, amikor “Néha két gén mutációja olyan fenotípust eredményez, amely az egyes mutációk egyedi hatásainak fényében meglepő. Ez a jelenség, amely a genetikai kölcsönhatást definiálja, funkcionális kapcsolatokat tárhat fel a gének és a pályák között.” .
PrP
Ez egy évtizedes, így néhány dolog lehet, hogy elavult, de Harris 2003 (ft) áttekintését a PrP sejtbiológiájáról rendkívül világosnak és hasznosnak találtam. Kim & Hegde 2002 szintén hasznos volt. A PrP egy szekréciós útvonal fehérje. Az első 22 aminosava (MANLGCWCWMLVLFVATWSDLGLC) egy jelző peptid, amely cotranszlációs transzlokációt okoz az ER-be. Normális esetben a PrP csak a C-terminusán kap GPI-kötést, és a membrán exoplazmatikus oldalához rögzül. A 111-134. aminosavak (HMAGAAAAGAVVVGGLGGYMLGSAM) azonban egyfajta gyenge jelhorgony szekvencia (II. típus, a +++ aminosavak a jelhorgony előtt következnek), amely néha, de nem mindig transzmembrán doménné válik, és a C terminust a lumenbe fordítja. Még zavaróbb, hogy ez a szekvencia néha csak transzmembrán doménné válik az inverzió nélkül, így az N-terminus a lumenben van. A PrP-nek tehát három membrán topológiája van: a szokásos régi GPI-horgonyzott, és két transzmembrán orientáció, ahogy azt Harris 2003 3. ábrája mutatja:
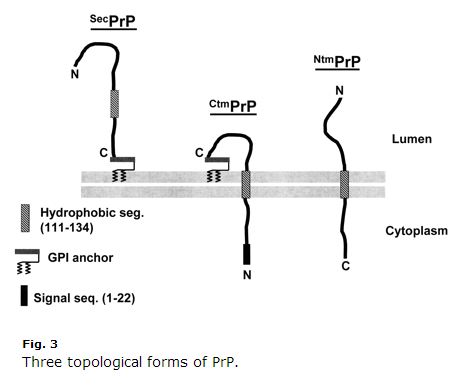
Nézzük, milyen furcsa a CtmPrP. Transzmembrán, ugyanakkor GPI-horgonyzott is, és az N-terminális szignálpeptid soha nem hasad le. Normális esetben a transzmembrán formák a teljes PrP < 10%-át teszik ki. Egyes laboratóriumi körülmények között ez az arány magasabb, és a GSS-t okozó két mutáció (A117V és P105L) is növeli a CtmPrP arányát az összes PrP 20-30%-ára. E három forma közül számos bizonyíték van arra, hogy a CtmPrP toxikus, és hogy szerepet játszhat a prionképződésben, bár úgy tűnik, hogy a legtöbb genetikai prionbetegség mutációja (beleértve az FFI D178N-t) nem befolyásolja a PrP membrántopológiáját vagy a CtmPrP frakcióját.
Amint a PrP áthalad a Golgin, a sejtmembránba kerül. Harris szerint azonban nem csak ott ül, hanem gyakran a klatrin-mediált endocitózison keresztül ~60 percenként ciklikusan végigjárja a sejtet, és néhány molekula minden egyes ciklus során hasad. A réz serkenti a PrP endocitózisát. A legtöbb genetikai prionbetegség mutációja megváltoztatja a PrP lokalizációját – általában mutáció esetén kevesebb PrP található a sejtfelszínen, és több halmozódik fel az ER-ben.