14.1 Bevezetés a neuropeptidekbe és a nitrogén-oxidba
A klasszikus neurotranszmitterek (pl. glutamát és ACh) a preszinaptikus felszabadulási helyek és a posztszinaptikus receptorcsoportok közötti irányított információátvitel révén működnek. A folyamat általában térben jól szervezett, a szomszédos szinapszisok közötti transzmitter némi, de nagyon korlátozott mértékű “átterjedésével”. Egészen más a helyzet a neuropeptidek és a nitrogén-oxid (NO) által közvetített transzmisszió esetében. Ezek a molekulák figyelmen kívül hagyják az információáramlás irányultságát, és ehelyett a felszabadulásuk helyétől egy térfogatnyi területet befolyásolnak. Ez a tulajdonság lazán analóg a peptidhormonok véráramba történő felszabadulásával, amelyek távoli helyekre is eljuthatnak, hogy kifejtsék hatásukat. Például az NO termelődhet egy posztszinaptikus neuronban, és visszadiffundálhat a preszinaptikus neuronba vagy más szomszédos neuronokba, befolyásolva a transzmitter későbbi felszabadulását. Ezt a tulajdonságot retrográd transzmissziónak nevezzük, mivel a jel a neurotranszmisszió klasszikus irányultságához képest ellentétes irányban (poszt-ból pre-ba) halad.
14.2. Neuropeptidek
Számos neuropeptidet eredetileg hormonként írtak le (pl. szomatosztatin és kolecisztokinin), bár miután jellemezték őket, később a CNS neuronjaiban is megtalálták őket. A neuropeptidek jellemzően lassan induló és hosszú ideig tartó neuronális válaszokat váltanak ki (14.1. ábra), és minden jellemzett neuropeptidreceptor a GPCR (G-fehérje kapcsolt receptor) osztályba tartozik. Összehasonlításképpen a 14.1. ábra egy ionotróp receptorra és egy neuropeptidre ható klasszikus neurotranszmitter (glutamát) hatására létrejövő tipikus válaszokat mutatja. Az 1. neuronban (zölddel), egy glutamátot felszabadító neuronban kiváltott akciós potenciál a glutamát közvetítésű szinaptikus transzmisszióra jellemző gyors (5 msec) EPSP-t hoz létre. Ezzel szemben a neuropeptidet felszabadító 2. neuronban (lila) kiváltott akciós potenciál lassan induló (5 mp a csúcspontig) és hosszan tartó (10 mp) EPSP-t eredményez. Ezek a lassú EPSP-k jellemzőek a neuropeptidhatásokra, mivel minden neuropeptidreceptor G-fehérje csatolású.
14.1. ábra
Mellett sok neuropeptid nem okoz nyilvánvaló elektrofiziológiai változást a posztszinaptikus neuronban. Például egy akciós potenciál a 3-as neuronban (14.1. ábra; rózsaszín) nem vált ki választ a posztszinaptikus neuronban, még akkor sem, ha más eszközökkel meg lehet erősíteni, hogy neuropeptidek szabadultak fel. A posztszinaptikus neuronban azonban változások történtek, amint az a “C” jelű panelen látható példából kiderül. Ha először a glutamátválaszt (C1) mérjük az 1. neuron stimulálásával, tipikus választ látunk. A 3. neuron ingerlése nem eredményez választ (C2), mint korábban. Ha azonban az 1. neuront a 3. neuron stimulálása után újra stimuláljuk, a posztszinaptikus neuronban mért EPSP felerősödik (C3) (az eredeti EPSP a folytonos vonal, a 3. neuron stimulálását követő EPSP pedig a szaggatott vonal). Így a 3. neuronból felszabaduló neuropeptid megváltoztatta a posztszinaptikus neuron válaszát egy másik neurotranszmitterre. Ezeket a neuropeptideket neuromodulátoroknak nevezzük, mivel hatásuk egy második transzmitter hatását erősíti vagy csökkenti. Az ilyen heteroszinaptikus plaszticitás egyéb példáit a 7. fejezet 2. része ismerteti.
14.3 A peptidek családok szerinti osztályozása
A neuropeptidek aminosav-szekvenciájuk hasonlóságai alapján családokba sorolhatók (I. és II. táblázat).
I. táblázat
Neuropeptidcsaládok
Tachykininek: substance P, bombesin, substance
Insulinok: inzulin, inzulinszerű növekedési faktorok
Somatosztatinok: szomatosztatin, hasnyálmirigy polipeptid
Gasztrinek: gasztrin, kolecisztokinin
Opioidok: opiocortinok, enkefalinok, dynorfin
Az opiátok például az N-terminusukon található azonos Tyr-Gly-Gly-Phe–(II. táblázat) aminosavsorrend miatt egy családba tartoznak.
| II. táblázat Opiát család – szekvencia azonosság dőlt betűvel |
|
| Név | Aminosav szekvencia |
| Leu-enkefalin | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkefalin | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorphin | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Bioszintézis és szabályozás
14.2. ábra
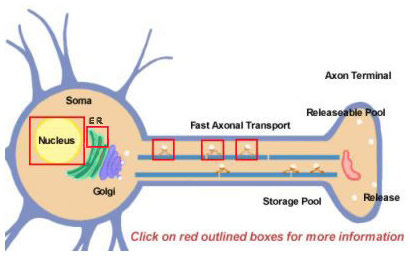
A neuropeptidek nagyobb prekurzorokból származnak proteolitikus feldolgozással. Kezdetben mind a szomán belül szintetizálódnak (14.2. ábra). A prekurzorok kezdetben a sejttesthez közeli endoplazmatikus retikulumhoz kötött poliriboszómákon transzlációval képződnek. Innen a Golgi-apparátuson keresztül haladnak tovább, ahol további módosítások történnek, beleértve a glikozilációt is. Ezután szekréciós granulumokba csomagolódnak, amelyeket a gyors axonális transzport szállít a terminálisokhoz. A gyors azonban relatív kifejezés, és annak köszönhető, hogy egyes neuropeptideknek viszonylag nagy távolságokat kell megtenniük. A felszabaduló neuropeptidek készletének feltöltése sok órát is igénybe vehet. Az idegvégződésbe történő szállítás során a vezikulába csomagolt proteázok elkezdik a prekurzor neuropeptid végső érett formájára hasítani a prekurzor neuropeptidet. Ez a feldolgozás elengedhetetlen a neuropeptidek aktiválásához, mivel a prekurzorok biológiailag inaktívak. Legalább háromféle feldolgozás történik a vezikulákon belül (14.2. ábra; további részletekért kattintson a dobozokra). Először egy endopeptidáz hasítja a prekurzort, hogy két új terméket hozzon létre (Első doboz az axonban). Sok prekurzor esetében ez a hasítás bázikus maradékok (például Lys és Arg) után történik, és tripszinszerű proteázok végzik. Ezután, bár nem minden neuropeptid esetében, egy karboxipeptidáz hasítja le az új peptid C-terminusáról a bázikus maradékokat (Második doboz az axonban). Végül egy harmadik enzim egy Gly-maradék COOH (karboxi) csoportját, amely sok neuropeptid C-terminusán található, NH2 (amid) csoporttá alakítja át, hogy a neuropeptid érett, aktív formája keletkezzen.
14.5 Többféle mechanizmust használnak fel a neuropeptidek sokféleségének előállításához
A legtöbb fehérje mRNS-molekulákból keletkezik, amelyek a sejtmagban a prekurzor RNS-ekből a végleges formájukba splicereződnek. A differenciális splicing az egyik módja annak, hogy a neuronok diverzifikálják a különböző típusú neuropeptidek termelését. Egy jól ismert példa a P anyag mRNS, amely normális esetben a K anyagot kódoló mRNS-t is tartalmazza. Az mRNS K anyagrészét differenciálisan ki lehet splicelni, így a keletkező mRNS csak P anyagot képes termelni (kattintson a 14.2. ábrán a sejtmag feletti dobozra)
14.3. ábra
A neuropeptidek egy hosszabb prekurzor fehérjéből keletkeznek proteolitikus feldolgozással. Kiváló példa erre az opioid peptidek családja (pl. a proopiomelanocorticotropin, a POMC és az enkefalin feldolgozása; lásd a 14.3. ábrát). Mint említettük, a proteolitikus feldolgozás a transzportvezikulákon belül zajlik, és leggyakrabban a prekurzor N-terminális oldalán lévő bázikus maradékok (arginin és lizin) hasításával történik, bár más hasítási helyeket is azonosítottak. Egyes esetekben, mint például az enkefalin prekurzor fehérje esetében, ugyanannak a végső bioaktív peptidnek több példánya is jelen van. A 14.3. ábra tetején látható egyetlen prekurzor molekula hat példányban tartalmazza a Met-enkefalint (ME) és egy példányban a Leu-enkefalint (LE).
A sokféleség tehát a hasítási helyek szekvenciájának differenciális splicinggel történő megváltoztatásával, különböző proteázok előállításával és/vagy csomagolásával (amelyek különböző szekvenciákat ismernek fel a hasításhoz) a transzportvázakba, vagy egy proteolitikus hely poszttranszlációs módosításokkal történő elrejtésével hozható létre. Ez utóbbira példa, hogy egy specifikus hasítási helyet elrejthetünk egy szénhidrát oldallánc hozzáadásával, amely sztérikusan blokkolja a proteáz hozzáférését az adott helyhez. Egy másik gyakori megállapítás, hogy egyetlen prekurzor molekula több különböző neuropeptidet tartalmaz (lásd a 14.3. ábrát), és ezért a bekövetkező feldolgozás típusai határozzák meg végső soron, hogy melyik neuropeptid szabadul fel a neuronból. A POMC prekurzor fehérje hasadhat ACTH (narancssárga) és β-lipoprotein (világoskék) képződhet, amelyek mindegyike tovább hasadhat, hogy további bioaktív neuropeptideket hozzon létre (14.3. ábra). Például a β-lipoprotein (világoskék) tovább hasítható γ-lipoproteinné (zöld csíkok) és β-endorfinná (sötétkék). Ismétlem, a lezajló feldolgozástól függően ugyanaz a prekurzorfehérje módosulhat, hogy drámaian eltérő biológiai válaszokkal rendelkező neuropeptideket állítson elő.
14.6. Felszabadulás
14.4. ábra
A peptidek kalciumfüggő exocitózissal szabadulnak fel, néhány fontos különbséggel a klasszikus neurotranszmitterek felszabadulásához képest. A neuropeptideket felszabadító vezikulák jellemzően sokkal nagyobbak, mint a kis molekulájú neurotranszmittereket (pl. glutamátot) tartalmazó vezikulák, és a felszabaduláshoz nincs szükség preszinaptikus specializációra (lásd a 14.4. ábra elektronmikroszkópos felvételét). A glutamátot tartalmazó kis vezikulákkal ellentétben a nagy vezikulák nem jelennek meg a membránhoz dokkolva. Ez a megfigyelés összhangban van azzal az elképzeléssel, hogy a kis molekulájú neurotranszmitterek rövid, helyi hatásokat fejtenek ki (a szinaptikus kapcsolatoknál), míg a neuropeptidek lassú, hosszan tartó, gyakran a felszabadulás helyét körülvevő jelentős területet felölelő hatásokat fejtenek ki. Emlékezzünk arra is, hogy mivel a neuropeptidek a sejtszomában szintetizálódnak, és nem lokálisan a szinapszisban, ha készletük kimerül a tartós felszabadulásból, több órát is igénybe vehet a felszabaduló készletek feltöltése. Például egy motoros neuron, amelynek sejttestje a gerincvelőben, szinapszisa pedig a lábban van, egy méter hosszú axonnal rendelkezik. A gyors axonális transzportot kihasználva potenciálisan több mint egy napba telhet, amíg egy újonnan szintetizált neuropeptid a szinapszisba érkezik a szomából. Nyilvánvalónak kell lennie annak is, hogy az endogén fájdalomcsillapító neuropeptidek, mint például a béta-endorfin, “elfogyhatnak” a tartós ingerlés idején, ami olyan helyzetekhez vezet, amikor a fájdalmat már nem lehet endogén mechanizmusokkal kontrollálni.
Egy tipikus érett neuron gyakran egy kismolekulás neurotranszmittert és egy vagy több neuropeptidet szabadít fel (mint a 14.4. ábrán látható példában). Ha egynél több neuropeptid szabadul fel, azok legtöbbször ugyanabból az egyetlen prekurzor molekulából származnak. Példa erre az ACh és a kalcitonin génnel kapcsolatos peptid együttes felszabadulása a gerincvelői motoros neuronokból. A CGRP aktiválja az adenilát-ciklázt, emelve a cAMP-szintet, és erősíti a nikotinos ACh-receptor ACh-aktiválása által kiváltott összehúzódási erőt. Ebben az esetben a neuropeptid a 14.1. ábrán leírtak szerint moduláló hatású. Ebben az esetben azonban a hatás az EPSP nagyságának növelése helyett az izomösszehúzódást potenciálja. Mindkét példában a potenciált válasz a rendszer megnövekedett érzékenységének köszönhető a felszabaduló neurotranszmitter állandó mennyiségére.
14.6. A hatás megszűnése
A neuropeptidek lassan távoznak az extracelluláris térből; ez a tulajdonságuk is hozzájárul viszonylag hosszan tartó hatásukhoz. Az inaktiváció mind diffúzióval, mind az extracelluláris proteázok általi lebontással történik. Nem találtak bizonyítékot a peptidek visszavételére, mint a hatásuk megszüntetésének módjára.
14.7 A receptorok mind G-fehérjéhez kapcsolódnak
Minden ismert neuropeptidreceptor az intracelluláris másodlagos hírvivők szintjének megváltoztatásával fejti ki hatását. Ezek a receptorok hét transzmembránon átívelő fehérjék, amelyek G-fehérjék (GPCR-ek) révén kapcsolódnak egymáshoz, hogy megváltoztassák más sejtenzimek aktiválódását. Ez a tulajdonság összhangban van azzal, hogy a neuropeptidek lassabb választ indukálnak, és jól illeszkedik moduláló szerepükhöz. A kis és neuropeptid molekulájú transzmitterek közötti egyik fontos különbség, hogy a neuropeptid receptorok nagy kötési affinitással rendelkeznek (nanomoláris), szemben a kis molekulájú neurotranszmitterek (mint a glutamát) esetében mért mikro- vagy millimoláris affinitásokkal. Mivel a neuropeptidek nem irányítottan szabadulnak fel a szinapszis zárt térfogatába, koncentrációjuk nem ér el nagyon magas szintet, és a receptoroknak nagy affinitással kell rendelkezniük ahhoz, hogy reagáljanak ezekre a kis koncentrációkra. Ez a nagy affinitás lassítja a neuropeptidnek a receptorától való disszociációját, és hozzájárul e molekulák tartós hatásaihoz is.
14.8. Nitrogén-oxid (NO)
A nitrogén-oxid a gáznemű hírvivő molekulák új osztályának alapító tagjaként széles körű figyelmet kapott. Az NO az az aktív molekula, amelyet a szublingvális nitroglicerin termel az angina pectoris enyhítésében az értágulat fokozására. Az NO más fontos biológiai hatásait is felismerték. Például az idegrendszerben az NO fontos szerepet játszik az agyi véráramlás szabályozásában, a neurotranszmisszió modulálásában és a különböző kóros állapotokhoz kapcsolódó toxicitásban.
14.9 Az NO jellemzői
Az NO tulajdonságainak összefoglalása
- Gáz, amely szabadon diffundál a membránokon keresztül
- Rövid élettartamú, félidővel.másodpercekben mért élettartammal
- Nagyon reaktív szabad gyök
- Nagy koncentrációban mérgező
A NO egy rövid életidejű gáz, nem tévesztendő össze a viszonylag stabil érzéstelenítő gázzal, a dinitrogén-oxiddal (nevetőgáz). Az NO valójában egy szabad gyök, ezért erősen reaktív vegyület. Mérgező hatásainak egy része valószínűleg annak köszönhető, hogy az NO a szuperoxiddal reakcióba lépve a pusztító hatású peroxinitrát gyököt hozza létre. Az NO-t nem hagyományos neurotranszmitternek tekintik, mivel nem exocitózissal szabadul fel, és hatása nem a hagyományos receptormolekulákon keresztül érvényesül.
Amint korábban említettük, a neuronális kommunikáció tipikus leírása az átvitelt egyirányúnak tekinti. Egy preszinaptikus neurotranszmitter szabadul fel, amely változásokat idéz elő a posztszinaptikus neuronban. A posztszinaptikus neuronokban termelődő számos vegyület (például neuropeptidek és NO) a helyi környezetbe diffundál, és hatással van a környező sejtekre. Mivel az NO szabadon diffundáló gáz, a keletkezési helyétől bármely irányba gyorsan terjedhet. Például, ha egy posztszinaptikus sejtben glutamátreceptor-stimuláció miatt termelődik, az NO a helyi környezetbe szabadulhat fel, és jelet küldhet vissza a preszinaptikus neuronba (14.5. ábra). Az ilyen típusú tevékenységet retrográd jelátvitelnek nevezik, mivel a jel retrográd irányban halad a posztszinaptikusból a preszinaptikus neuron felé.
14.5. ábra
14.6. ábra
A 14.5., 14.6. és 14.7. ábra összefoglalja az NO-szintézis főbb aspektusait. Ebben a példában a preszinaptikus terminálból glutamát szabadul fel, amely a posztszinaptikus membrán NMDA-receptoraihoz kötődik, aminek hatására azok megnyílnak és lehetővé teszik a Ca2+-beáramlást. A Ca2+ aktiválja a kalmodulint, amely a nitrogén-oxid-szintáz (NOS) enzimhez kötődik és aktiválja azt. Az arginint szubsztrátként használva a NOS NO-t és egy második reakcióterméket, citrullint állít elő. Az NO ezután szabadon diffundálhat a környezetbe, és kölcsönhatásba léphet a preszinaptikus terminállal, amely eredetileg felszabadította a glutamátot, vagy a helyi környezet bármely más sejtjével. Ismerje fel, hogy minden olyan folyamat, amely megemeli az intracelluláris Ca2+-t, potenciálisan aktiválja a NOS-t. Az NMDA receptorok glutamát aktiválása csak egy jól dokumentált példa.
14.7. ábra
14.10 A nitrogén-oxid-szintáz (NOS) szintézise és felszabadulása
Az NO-t a nitrogén-oxid-szintáz (NOS) enzim állítja elő. Ez az enzim a neuronok egy alpopulációjában (a kéregben a neuronok 1-2%-a) és a legtöbb endothelsejtben megtalálható. A NOS legalább egy formája ezekben a sejtekben kalciumtól és kalmodulintól függ az aktiváláshoz, amint azt a 14.5., 14.6. és 14.7. ábra mutatja. A citokróm P-450-hez hasonló kofaktorokat is tartalmaz. Ezek a kofaktorok a NADPH (nikotinamid-adenin-dinukleotid-foszfát, FAD (flavin-adenin-mononukleotid) és FMN (flavin-mononukleotid). Ezek a kofaktorok nélkülözhetetlenek az elektronok átadásához, amely során az instabil és rövid élettartamú NO termék keletkezik. A reakcióban a szubsztrát a gyakori aminosav, az arginin, a termékek pedig a citrullin és a NO (14.5. ábra). Az NO rövid élettartama miatt rendkívül nehéz közvetlenül mérni. Kísérleti preparátumokban azonban kiváló összefüggés van az NMDA alkalmazása – amely növeli az intraneuronális Ca2+-t és aktiválja a NOS-t – és a NOS enzimaktivitásának további terméke, a citrullin termelődése között (lásd a 14.8. ábrát). A citrullin-termelés az NO-termelés megbízható indikátora. A citrullin (és az NO) termelését a sejteknek a NOS számára nem metabolizálható szubsztrát, a metil-arginin nevű szubsztrát etetésével is blokkolni lehet (14. ábra.9), és ilyen vegyületeket használtak az NO termelésének csökkentésére és biológiai hatásainak megszüntetésére.
|
14. ábra.8 |
14.9. ábra |
14. ábra.11 Az NO “receptorai”
14.10. ábra
A NO egyik fő célpontja a jelek szerint a guanil-cikláz enzim. Ezt a felfedezést közvetett módon, a NOS-termék citrullin felhalmozódásának monitorozásával tettük, miközben a guanil-cikláz enzim termékének, a cGMP-nek a termelődését is figyeltük (14.8. és 14.9. ábra). Ebben a kísérletben NMDA-t adtak egy neuronális preparátumhoz a NOS aktiválása érdekében. A NOS arginint használ szubsztrátként az NO előállításához, és mint említettük, ha egy nem hidrolizálható analógot, például metil-arginint adunk a rendszerhez, a citrullin és a cGMP felhalmozódása ugyanolyan dózisfüggő módon szűnik meg. Ezek az erős összefüggések vezettek annak felfedezéséhez, hogy a guanil-cikláz a NO egyik fő célpontja.
A guanil-cikláz szokatlan enzim, mivel szerkezetének részeként egy heme-gyűrűt tartalmaz, amelyhez vasmolekula is társul. Az NO aktiválja ezt az enzimet azáltal, hogy a hemben lévő vashoz kötődik, és az enzim konformációs változásain keresztül ciklikus GMP termelését indítja el GTP-ből (14.10. ábra). A cGMP ezután aktiválja a cGMP-függő fehérjekinázt és más, alább ismertetett enzimeket. A cGMP-függő fehérje-kináz aktiválása által kiváltott hatások spektrumát csak most kezdjük megérteni.
14.12 Az NO biológiai hatásai
Az NO sokféle biológiai hatást vált ki. Sajnos, különösen nem ismerjük az NO szerepét az idegrendszerben zajló sejtfolyamatok modulálásában. Az NO szerepe az érrendszer szabályozásában jól dokumentált, és úgy tűnik, hogy hasonlóan fontos szerepet játszik az idegrendszerben is.
14.13 Vazodilatátor
14.11. ábra
A kép nagyított változatának megtekintéséhez kattintson ide.
Normális körülmények között az NO hozzájárul a véráramlás szabályozásához az agyi érrendszerben. Szükségszerűen létezik egy gyors visszacsatolási mechanizmus, amely az agy aktívabb területeit ellátja a szükséges tápanyagokkal. Erre a mechanizmusra az agy gyenge energiaraktárkészletei miatt van szükség. Az NO olyan NOS-t tartalmazó neuronokban termelődik, amelyek tartós aktivitáson mennek keresztül. Ezek a körülmények kedveznek az NMDA-receptorok aktiválódásának, ami köztudottan NO-termelést okoz. Az NO a magas neuronális aktivitás ezen lokalizált területeiről a környező mikrovaszkulaturába diffundál (14.11. ábra), ami értágulatot és fokozott véráramlást okoz.
Bár még nem határozták meg pontosan azokat a mechanizmusokat, amelyek révén az NO értágulatot okoz, az ismert, hogy a cGMP-függő protein-kináz aktiválása a simaizomsejtekben az erek relaxációját okozza. Mivel a NO egyik fő célpontja a guanil-cikláz (amely cGMP-t termel és aktiválja a cGMP-függő protein-kinázt), feltételezhető, hogy a NO értágító hatásának egyik fő útja a cGMP-függő protein-kinázon keresztül vezet. Ennek a kináznak az aktiválása közvetve a simaizomsejtek Ca2+-szintjének csökkenéséhez, majd a miozin kontraktilis apparátus defoszforilációjához vezet, ami relaxációt okoz (14.12. ábra). Úgy tűnik, hogy a simaizomsejtekben az NO közvetlenül is hiperpolarizálja a sejteket, valószínűleg a K+-csatornák aktiválásával, ami a Ca2+-csatornák másodlagos záródásához vezet, ami szintén izomrelaxációt eredményez. Összefoglalva, úgy tűnik, hogy az NO egyik fő funkciója a neuronális aktivitás szintjének és az agyi véráramlás helyi változásainak integrálása a metabolikusan aktív szövetek megfelelő perfúziójának fenntartása érdekében.
14.12. ábra
14.14. Neuromodulátor
Az NO feltehetően helyileg diffundáló hírvivőként is működik. Minden olyan hatás hatására keletkezik, amely a NOS-t tartalmazó sejtekben megemeli a Ca2+ -ot, mint például az NMDA-receptorok glutamát stimulálása. A guanil-cikláz későbbi aktiválásán és a cGMP termelésén keresztül az NO-termelés számos másodlagos folyamatot befolyásol. Ezek közé tartozik az ioncsatornák közvetlen modulációja, a cGMP-függő protein kináz stimulálása, valamint a cAMP-foszfodiészteráz fel- vagy leszabályozása. A downstream hatások aztán számosak, és magukban foglalják a Ca2+ csatornák fel- és leszabályozását, a fokozott ingerlékenységet (növeli a neuronok tüzelési sebességét), a neurotranszmitterek fokozott vagy csökkent felszabadulását és a neuronok morfológiájának változásait.
14.15 Toxicitás
A NO feleslegben toxikus a sejtekre. Az NO-toxicitással kapcsolatban azonban létezik egy paradoxon. Azok a sejtek, amelyek nagy mennyiségű NO-t termelnek, ellenállóak a toxikus hatásával szemben. Az NO-toxicitást például a makrofágok és a neutrofilek a tumorsejtek és a baktériumok elpusztítására szolgáló mechanizmusként használják. Azonban egyik NO-t termelő sejttípus sem érzékeny a káros hatásaira. Ez a megállapítás a központi idegrendszer neuronjaira is igaz. A túlzott glutamát neurotoxicitást idéz elő az agyban, és úgy gondolják, hogy ez az elsődleges oka az idegsejtek pusztulásának olyan betegségekben, mint a Huntington- vagy az Alzheimer-kór, illetve akut stroke vagy trauma után. Úgy gondolják, hogy a NO túlzott termelése szerepet játszik ebben az idegsejtpusztulásban, mivel a NO túltermelődése mérgező hatású. Érdekes módon a NOS enzimre pozitívan festődő sejtek megkímélik az agy e betegségekben érintett degenerálódó területeit. Úgy tűnik, hogy ezeknek a sejteknek az ellenálló képessége hasonló a fent leírt immunsejtek ellenálló képességéhez.
Tesztelje tudását
- Kérdés 1
- A
- B
- C
- D
- E
A neuropeptidek azért vannak jelen a szinaptikus végződésekben, mert:
A. A terminálisban szintetizálódnak.
B. Gyors axonális transzport révén szállítják
C. Diffúzióval szállítják
D. Lassú axonális transzport által szállítva
E. Az extracelluláris térből felvéve
A neuropeptidek azért vannak jelen a szinaptikus végződésekben, mert:
A. A terminálisban szintetizálódnak. Ez a válasz helytelen.
A peptidek és fehérjék szintéziséhez szükséges szintetizáló gépezet nem található meg az axonvégződésben.B. A gyors axonális transzport által szállított
C. Diffúzióval szállítják
D. Lassú axonális transzport által szállítva
E. Az extracelluláris térből felvéve
A neuropeptidek azért vannak jelen a szinaptikus végződésekben, mert:
A. A terminálisban szintetizálódnak.
B. Gyors axonális transzport révén szállítják Ez a válasz helytálló!
A neuropeptidek a sejttestben szintetizálódnak, és vezikulákban kerülnek feldolgozásra, amelyeket gyors axonális transzport révén a mikrotubulusok mentén az axonvégződésekbe szállítanak.C. Diffúzióval szállítják
D. Lassú axonális transzporttal szállítják
E. Az extracelluláris térből felvéve
A neuropeptidek azért vannak jelen a szinaptikus végződésekben, mert:
A. A terminálisban szintetizálódnak.
B. Gyors axonális transzport révén szállítják
C. Diffúzióval szállítják Ez a válasz TÖRVÉNYTELEN.
A diffúzió kiváló mechanizmus a molekulák rövid (néhány mikronos) távolságokon történő mozgatására, de nem hatékony a molekulák olyan távolságokon történő mozgatására, amelyek jellemzően elválasztják a neuronális szómát az axonvégződésektől.D. Lassú axonális transzport által szállított
E. Az extracelluláris térből felvéve
A neuropeptidek azért vannak jelen a szinaptikus terminálisokban, mert:
A. A terminálisban szintetizálódnak.
B. Gyors axonális transzport révén szállítják
C. Diffúzióval szállítják
D. Lassú axonális transzport által szállítva Ez a válasz TÖRVÉNYTELEN.
Az is fontos, hogy minél gyorsabban pótoljuk a terminálisok neuropeptid-ellátását. Ebben az esetben a gyorsabb a jobb.E. Az extracelluláris térből felvéve
A neuropeptidek azért vannak jelen a szinaptikus terminálokban, mert:
A. A terminálisban szintetizálódnak.
B. Gyors axonális transzport révén szállítják
C. Diffúzióval szállítják
D. Lassú axonális transzport által szállítva
E. Az extracelluláris térből felvéve Ez a válasz TÖRVÉNYTELEN.
Nincs ismert felvételi mechanizmus a neuropeptidek extracelluláris térből való eltávolítására. Hatásmechanizmusukat a diffúzió és az extracelluláris proteázok általi enzimatikus lebontás szünteti meg.
- Kérdés 2
- A
- B
- C
- D
- E
Nitrogén-oxid:
A. Hosszú élettartammal rendelkezik
B. Membránáteresztő.
C. Nem reaktív
D. Nevetőgázként is ismert.
E. Nem mérgező a sejtekre.
Nitrogén-oxid:
A. Hosszú élettartammal rendelkezik Ez a válasz helytelen.
NO másodpercekben mért felezési ideje van, és rendkívül instabil.B. Membránáteresztő.
C. Nem reaktív
D. Nevetőgázként is ismert.
E. Nem mérgező a sejtekre.
Nitrogén-oxid:
A. Hosszú élettartammal rendelkezik
B. Membránáteresztő képességű. Ez a válasz helytálló!
A NO szabadon átjárható a membránokon, és a keletkezési helyétől bizonyos sugarú körben minden sejtre hatással van.C. Nem reaktív
D. Nevetőgázként is ismert.
E. Nem mérgező a sejtekre.
Nitrogén-oxid:
A. Hosszú élettartammal rendelkezik
B. Membránáteresztő.
C. Nem reakcióképes Ez a válasz TÖRVÉNYTELEN.
AzNO egy erősen reakcióképes szabadgyök. Reagál a fehérjékkel, lipidekkel és nukleinsavakkal, és különösen nagy affinitása van a redukált fémekhez (mint például a Fe2+ a guanil-cikláz heme-csoportjában).D. Nevetőgázként is ismert.
E. Nem mérgező a sejtekre.
Nitrogén-oxid:
A. Hosszú élettartammal rendelkezik
B. Membránáteresztő.
C. Nem reaktív
D. Nevetőgázként is ismert. Ez a válasz helytelen.
A nevetőgáz a dinitrogén-oxid, nem a nitrogén-oxid. Nem reaktív és nem mérgező, de befolyásolja a membránok tulajdonságait.E. Nem mérgező a sejtekre.
A nitrogén-monoxid:
A. Hosszú élettartammal rendelkezik
B. Membránáteresztő.
C. Nem reaktív
D. Nevetőgázként is ismert.
E. Nem mérgező a sejtekre nézve. Ez a válasz TÖRVÉNYES.
A NO a sejtekre erősen mérgező, ha feleslegesen termelődik. Valójában az NO túltermeléséről úgy gondolják, hogy bizonyos neurodegeneratív betegségeket okoz. Az NO-t a makrofágok is termelik, mint toxikus terméket a behatoló baktériumok elpusztítására.