Mi a sejtmembrán áteresztőképessége?
Olvasó mód
Minden élő szervezet egyik jellegzetes tulajdonsága, hogy ionok és kismolekulák jellegzetes keverékét tartalmazza. Ez az összetétel nemcsak a környezettől eltérő, hanem a sejten belül is változhat. Például a hidrogénionok koncentrációja egyes sejtkompartmentekben 104-szer nagyobb lehet, mint másokban (a mitokondriumok akár 8-as pH-t is elérő, a lizoszómák 4-es pH-val, BNID 107521, 106074). A Ca2+ -ionok koncentrációjának aránya az extra- és intracelluláris folyadékkompartmentekben ismét 104-szeres lehet (BNID 104083). Ez a koncentrációkülönbség olyan nagy, hogy egy Ca2+ ion transzportálása a membránon keresztül, az intra- az extracelluláris kompartmentből az extracellulárisba, egynél több proton vagy nátriumion energiáját igényli, amelyek a proton-motoros erő gradiensén lefelé áramlanak. Ennek belátásához az olvasónak emlékeznie kell a trükkök listájából ismert hüvelykujjszabályra, miszerint egy nagyságrendnyi potenciálkülönbség létrehozásához 6 kJ/mol (≈2 kBT) szükséges. Ezt az energiát például egy elektromos töltés 60 mV-os potenciálkülönbségen keresztül történő szállításával lehet elérni. Négy nagyságrendnyi koncentrációarány eléréséhez ekkor egy töltésnek körülbelül 240 mV elektronmozgató erőt kellene lefelé haladnia (valójában még többet a kalciumion kettős töltése miatt). Ez nagyon közel van a membrán átütési feszültségéhez, amint azt a “Mekkora az elektromos potenciálkülönbség a membránokon keresztül?” című vignettában tárgyaltuk. Valójában a Ca2+ nagy koncentrációarányát általában három nátriumion transzportjához vagy az ATP hidrolíziséhez való kapcsolódással érik el, ami segít elérni a szükséges sűrűségkülönbséget anélkül, hogy a membránt veszélyesen feltöltené energiával.
A termodinamika második törvénye arra tanít bennünket, hogy általában a koncentrációgradiensek jelenlétét végül a tömegszállítási folyamatok kivezetik, amelyek folyamatosan egyensúlyi állapotba vezetik a rendszereket. Azonban, bár a termodinamika második törvénye megmondja nekünk egy rendszer végső állapotának jellegét (pl. egyenletes koncentrációk), azt nem mondja meg, hogy mennyi idő alatt érjük el ezt az állapotot. A membránok úgy alakultak ki, hogy nagyon hatékony akadályt képeznek számos ionos és molekuláris faj spontán átvitelének. Ahhoz, hogy megbecsüljük a koncentrációk kiegyenlítődésének időskáláját, ismernünk kell a tömegszállítás sebességét, amely olyan kulcsfontosságú anyagtulajdonságoktól függ, mint a diffúziós állandók és a permeabilitások.
A “törvények” egy rendkívül sikeres osztálya, amely az egyensúlytól valamilyen kis mértékben eltért rendszerek viselkedését írja le, a lineáris transzporttörvények. Ezek a törvények egyszerű lineáris kapcsolatot tételeznek fel valamilyen érdekes mennyiség transzportsebessége és a hozzá tartozó hajtóerő között. Tömegszállítás esetén lineáris kapcsolat áll fenn a fluxus (azaz az egységnyi területet egységnyi idő alatt átszelő molekulák száma) és a koncentrációkülönbség (amely a vonatkozó hajtóerő) között. A membránokon keresztüli transzport esetében ezeket a gondolatokat (semleges oldott anyagra) a j= – p-(cin-cout) egyszerű egyenletbe kódolták, ahol j a sejtbe jutó nettó fluxus, cin és cout a membránhoz kötött terület belső és külső koncentrációjára utal, p pedig egy permeabilitásként ismert anyagi paraméter. A p mértékegységei levezethetők abból, hogy a fluxus mértékegysége a szám/(terület x idő), a koncentráció mértékegysége pedig a szám/térfogat, ami azt jelenti, hogy maga a p mértékegysége a hossz/idő. Sok más transzportmennyiséghez hasonlóan (pl. az anyagok elektromos vezetőképessége, amely több mint 30 nagyságrendet ölel fel), az áteresztőképességnek is nagyon nagy dinamikus tartománya van, amint azt az 1. ábra szemlélteti. Amint az ábrán látható, a lipid kettősrétegek permeabilitása közel 1010-szeres tartományban mozog.
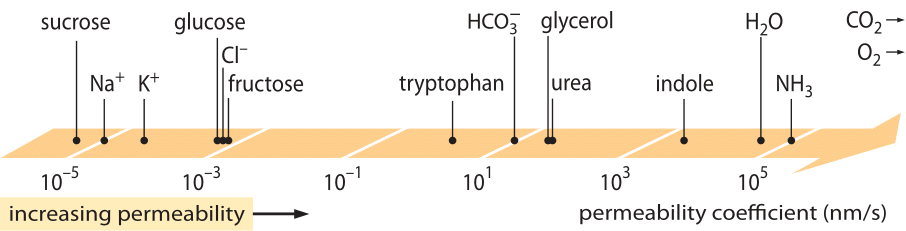
1. ábra: A különböző vegyületek membránpermeabilitásának széles tartománya a sejtben. A membránok a töltés nélküli vegyületek számára permeábilisabbak, a töltött ionok számára pedig a legkevésbé permeábilisak. Megjegyzendő, hogy az ioncsatornák létezése több nagyságrenddel nagyobbá teszi a látszólagos permeabilitást, amikor azok nyitva vannak. Az egységeket nm/s-ban választottuk, és néhány nm a jellemző membránszélesség. Az ábra R. N. Robertson, The Lively Membranes, Cambridge University Press, 1983, alapján készült. A glükózra vonatkozó érték kisebb, mint Robertsonnál, több forrás, például a BNID 110830, 110807 alapján. Egyéb adatforrások: BNID 110729, 110731, 110816, 110824, 110806.
Milyen fizikai-kémiai paraméterek határozzák meg egy vegyület helyét ezen a permeabilitási skálán? Az egyik ökölszabály az, hogy a kis molekulák nagyobb permeabilitással rendelkeznek, mint a nagyobb molekulák. Egy másik ökölszabály szerint a semleges vegyületek nagyságrendekkel gyorsabban képesek áthatolni a membránon, mint a hasonló töltésű vegyületek. A töltött vegyületek közül a negatív (anionos) vegyületek általában sokkal nagyobb permeabilitással rendelkeznek, mint a pozitív (kationos) vegyületek. Az úgynevezett Overton-szabály szerint a membránpermeabilitás a hidrofóbitással nő, ahol a hidrofóbitás a vegyület azon hajlama, hogy a nem poláros oldószert előnyben részesíti a poláros (vizes) oldószerrel szemben. Az Overton-szabály szerint a töltött (nem hidrofób) molekulák, például az ionok permeabilitása alacsony lesz, mivel a membránon való áthatolással járó energetikai hátrányt szenvednek el, míg az oldott gázok, például az O2 és a CO2, amelyek hidrofóbok (mivel töltés nélküliek és szimmetrikusak), nagy permeabilitással rendelkeznek. Valóban, a lipid kettősrétegű membránok CO2 áteresztőképessége 0,01-1 cm/s értékeket ad (igen, az áteresztőképesség mérések igen nagy bizonytalansággal rendelkeznek a különböző laboratóriumok között, BNID 110004, 110617, 102624), ami magasabb, mint az 1. ábrán látható összes többi érték. Ez az érték azt mutatja, hogy a sejtmembrán által létrehozott akadály valójában kisebb akadályt jelent, mint a sejtmembránt kívülről bekebelező, felkeveretlen vízréteg okozta akadály. Egy ilyen következtetés levezethető az akadály áteresztőképességi együtthatójának egyenletéből, amelyet a p=K x D/l egyenlet ad, ahol l a szélesség, D a diffúziós együttható és K a közeg és az akadály anyaga közötti megoszlási együttható. Ezt az áteresztőképesség “oldhatósági-diffúziós” modelljének is nevezik, ahol ezek a K és a D hatásokat jelölik, amelyek az áteresztőképességet befolyásoló két lépést jelentik. Keveretlen vízréteg esetén K=1, mivel nagyon hasonló a közeghez, de membrán esetén az érték a leghidrofóbabb anyag kivételével általában több nagyságrenddel kisebb, mint 1. Ez a K-tól való függés áll a fent említett Overton-szabály középpontjában. A CO2 nagy áteresztőképessége arra is utal, hogy nincs szükség olyan csatornákra, mint az aquaporinok, amelyeket a sejtbe történő gázszállításra javasoltak, mivel a membrán eléggé áteresztő. Hogy lássuk, hogyan befolyásolják a membrántulajdonságok a metabolitok kémiai összetételét, rátérünk a különböző vegyületek szivárgási idejének kiszámítására
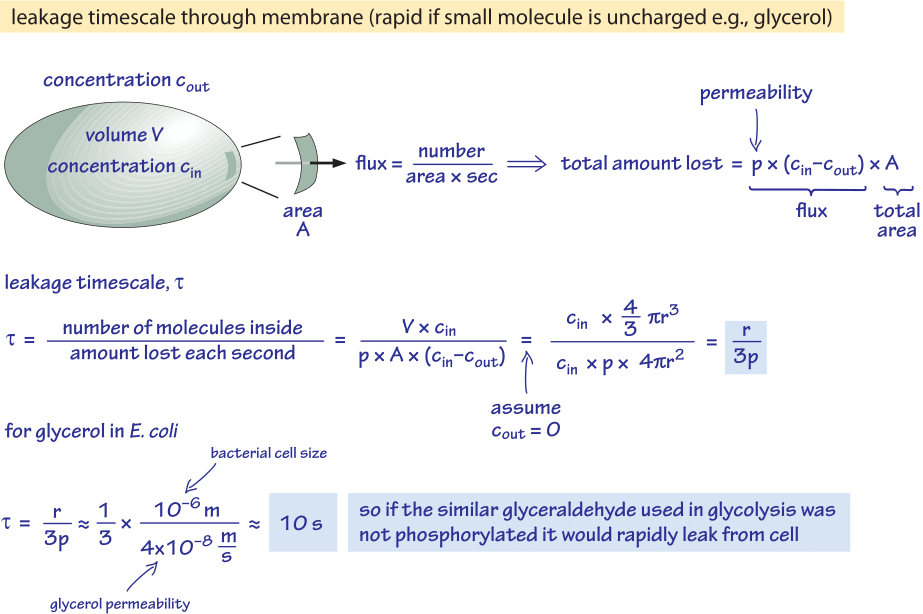
2. ábra: Back of the envelope számítás a foszforilálatlan glükózmolekula baktériumsejtből való passzív diffúziójának időskálájára. Ezután a funkcionális következményeket vizsgáljuk meg a gyorsan növekvő sejtek esetében, ahol a hatás elhanyagolható, és a stacionárius állapotban lévő sejtek esetében, ahol ez jelentős erőforrás-szivárgást okozhat.
Megvizsgáljuk például a glicerint. A 2. ábrán látható elemzés becslést ad a sejtből való kiszivárgásának idejére, ha a molekula nem foszforilálódik vagy más módon nem alakul át hidrofilebb formává. A sejtmembrán glicerinre való áteresztőképessége p≈10-100 nm/s (BNID 110824), amint az az 1. ábráról leolvasható. A sejt belsejében lévő glicerinmolekulának a környező közegbe való visszaszökésének időskálája – feltételezve, hogy nincs visszaáramlás a sejtbe (cout=0) – durván megbecsülhető azzal, hogy a sejtből való kiáramlás p-A-cin, ahol A a sejtfelszín területe. Az időskálát úgy találjuk meg, hogy vesszük a sejtben lévő teljes mennyiséget, V-cin-t (ahol V a sejt térfogata, pontosabban a sejt víztérfogata), és elosztjuk ezzel a fluxussal, ami egy baktériumsejt (r≈1 μm) esetében egy időskálát eredményez:
t =V-cin/p-A-cin =(4πr3/3)/(4πr2-3×10-6 cm/s) ≈ 10 s.
Ez egy durva becslés, mert nem vettük figyelembe a cin idővel csökkenő koncentrációját, ami 1/ln(2) korrekciós tényezőt ad, azaz kevesebb mint 2-szeres növekedést. Amit ezekből a becslésekből megtudunk, az az, hogy ha a glikolitikus köztitermékek, a glicerolhoz nagyon hasonló gliceraldehid vagy dihidroxiaceton nem foszforilálódnának, ami töltés hozzáadását eredményezné, akkor a sejtmembránon keresztül történő diffúzióval a közegbe kerülnének. Laboratóriumi közegben, ahol a szénforrás bőségesen rendelkezésre áll, ez nem jelent nagyobb problémát, de természetes környezetben, ahol a sejtek gyakran a stacionárius fázisban várják a tápanyagok szerencsés impulzusát (E. a coli feltehetően hónapokig nem növekszik a szervezetből való kiürülése után, mielőtt új gazdatestet találna), a sejt úgy tudja megfékezni veszteségeit, hogy gondoskodik arról, hogy az anyagcsere-középtermékek olyan töltéssel legyenek megjelölve, amely megakadályozza, hogy újra átlépjék a lipiddupla réteg által képviselt akadályt.




