A hidrogén kémiai elem a nem fémek közé tartozik. Nagyon nagy nyomáson fémmé válhat. Henry Cavendish fedezte fel 1766-ban.

Data Zone
| Besorolás | A hidrogén nem fém. Nagyon nagy nyomáson válhat fémmé. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szín | színtelen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsúly | 1.0079 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| állapot | gáz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| olvadáspont | -259,14 oC, 14,01 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| forráspont | -252,87 oC, 20.28 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok: | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Protonok: | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neutronok a leggyakoribb izotópban: | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronhéjak | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguráció | 1s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség 20oC-on | 0. Hő, energiák, oxidáció, reakciók, vegyületek, sugarak, vezetőképességek

Nasa kép: Hatalmas mennyiségű hidrogén távoli galaxisokban. 
Theophrastus Paracelsus – Az első ember, aki hidrogént generált: “A levegő keletkezik és kitör, mint a szél.” A hidrogén felfedezéseDr. Doug Stewart
Kedvelt iskolai kémiai kísérlet, amikor egy savhoz egy fémet, például magnéziumot adunk. A fém reakcióba lép a savval, sót képez, és hidrogént szabadít fel a savból. A hidrogéngáz felbuborékol a folyadékból, és a tanulók kis mennyiségben összegyűjtik további kísérletekhez, például a “pop-teszthez.” Az első feljegyzett példa arra, hogy emberi tevékenységgel hidrogént állítottak elő, az 1500-as évek első felében történt, a mostani iskolai kísérlethez hasonló módszerrel: Theophrastus Paracelsus orvos vasat oldott fel kénsavban, és megfigyelte a gáz felszabadulását. Állítólag ezt mondta a kísérletről: “Levegő keletkezik és kitör, mint a szél”. A hidrogén egyetlen tulajdonságát sem fedezte fel azonban.(1) Turquet De Mayerne 1650-ben megismételte Paracelsus kísérletét, és megállapította, hogy a gáz gyúlékony.(2) Sem Paracelsus, sem De Mayerne nem javasolta, hogy a hidrogén egy új elem lehet. Paracelsus ugyanis úgy vélte, hogy csak három elem létezik – a tria prima – só, kén és higany -, és hogy minden más anyag e három elem különböző kombinációiból áll. (3) (A kémiának még hosszú út állt előtte!) 1670-ben Robert Boyle angol tudós vasat adott a kénsavhoz. Kimutatta, hogy a keletkező (hidrogén)gáz csak akkor ég el, ha levegő is jelen volt, és hogy a levegő egy része (ma oxigénnek neveznénk) az égés során elfogyott.(4) A hidrogént először 1766-ban Henry Cavendish angol tudós ismerte fel önálló elemként, amikor sósav és cink reakciójával állította elő. A hidrogént “fémekből származó gyúlékony levegőnek” írta le, és megállapította, hogy ez ugyanaz az anyag (reakciói és sűrűsége alapján), függetlenül attól, hogy milyen fémet és milyen savat használt az előállításához.(1) Cavendish azt is megfigyelte, hogy az anyag elégetésekor víz keletkezik. Antoine Lavoisier francia tudós később elnevezte a hidrogén elemet (1783). A név a görög “hydro” (víz) és “genes” (képző) szavakból származik – a hidrogén a két vízképző elem egyike. 1806-ban, amikor a hidrogén mint elem már jól ismert volt, Humphry Davy angol kémikus erős elektromos áramot vezetett át a megtisztított vizen. Megállapította, hogy hidrogén és oxigén keletkezett. A kísérlet bebizonyította, hogy az elektromosság képes az anyagokat alkotóelemeikre szétszedni. Davy rájött, hogy az anyagokat elektromos jelenség köti össze; felfedezte a kémiai kötés valódi természetét. 5. Látogasson el a Chemicool hűvös hidrogén tényeket tartalmazó oldalára.  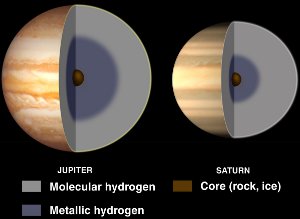
A Jupiter és a Szaturnusz belseje, folyékony fémes hidrogénnel. A NASA/JPL-Caltech jóvoltából. A hidrogén és az oxigén nagymértékű kémiai reakciója. (Ezért töltik ma a léghajókat hidrogén helyett héliummal.)

Nasa: Az űrsikló külső üzemanyagtartálya (narancssárga) folyékony hidrogénnel és oxigénnel töltve. 
A hidrogénautók szennyező anyagok helyett vizet bocsátanak ki. 
Víz laboratóriumi elektrolízise. Elektromos energiát használnak a víz megosztására. Az egyik kémcsőben hidrogén, a másikban oxigén gyűlik össze. Megjelenés és tulajdonságokÁrtalmas hatások: A hidrogén erősen gyúlékony és szinte láthatatlan lángja van, ami véletlen égési sérülésekhez vezethet. Jellemzők: A hidrogén a legegyszerűbb elem az összes közül és a legkönnyebb. Emellett messze a leggyakoribb elem az Univerzumban. Az Univerzumban található atomok több mint 90 százaléka hidrogén. Leggyakoribb formájában a hidrogénatom egy protonból, egy elektronból és neutronok nélkül áll. A hidrogén az egyetlen elem, amely neutronok nélkül is létezhet. A hidrogén színtelen, szagtalan gáz, amely normál hőmérsékleten és nyomáson kétatomos molekulák formájában létezik, H2. A levegőben ég és robbanékony keverékeket alkot, oxidálószerekkel pedig heves reakcióba lép. A Földön a hidrogén fő előfordulási helye a vízben, H2O-ban van. A Földön kevés szabad hidrogén van, mert a hidrogén olyan könnyű, hogy a bolygó gravitációja nem tartja meg. Minden hidrogén, ami keletkezik, végül a légkörből az űrbe távozik. Bár a hidrogén általában nem fém, folyékony fémmé válik, ha hatalmas nyomás éri. Ilyen nyomást találunk a gázóriás bolygókon, például a Jupiteren és a Szaturnuszon. A Jupiter nagy mágneses mezejét (a földi mágneses mező 14-szerese) feltehetően a bolygó forgása közben keringő, elektromosan vezető fémes hidrogénből eredő dinamóhatás okozza. A hidrogén felhasználásaNagy mennyiségű hidrogént használnak a Haber-eljárásban (ammónia előállítása), zsírok és olajok hidrogénezésében, metanol előállításában, hidrokrakkolásban és hidrodekénezésben. Hidrogént használnak a fémfinomításban is. A folyékony hidrogént rakétaüzemanyagként használják, például az űrsikló felszállásának és pályára állásának meghajtására. A folyékony hidrogént és oxigént az űrsikló nagy, külső üzemanyagtartályában tartják. (Lásd a képet balra.) A hidrogén két nehezebb izotópját (deutérium és trícium) a magfúzióban használják. A hidrogéngazdaságot a jelenlegi szénhidrogén (olaj, gáz és szén) alapú gazdaságunk kiváltására javasolták. A hidrogéngazdaság alapja, hogy a hidrogén oxigénnel való elégésekor energia keletkezik, és a reakció egyetlen mellékterméke a víz. Jelenleg azonban a hidrogénüzemű autók hidrogénjét szénhidrogénekből állítják elő. Csak akkor lesz lehetséges a valódi hidrogéngazdaság, ha például a nap- vagy szélenergiát kereskedelmi forgalomban is fel lehet használni a víz hidrogénre és oxigénre való bontására. Bőség és izotópokBőség a földkéregben: 1400 ppm tömegarány (0,14%), 2,9% molban Bőség a Naprendszerben: 75% tömegarány, 93% molban Költség, tisztán: $12 per 100g Költség, ömlesztve: $ per 100g Forrás: A hidrogént kereskedelmi forgalomban úgy állítják elő, hogy túlhevített gőzt reagáltatnak metánnal vagy szénnel. Laboratóriumban a hidrogén előállítható savaknak fémekre, például cinkre vagy magnéziumra gyakorolt hatására, vagy víz elektrolízisével (a képen balra). Izotópok: A hidrogénnek három izotópja van: 1H (protium), 2H (deutérium) és 3H (trícium). Két nehezebb izotópját (deutérium és trícium) a magfúzióban használják. A protium a legnagyobb mennyiségben előforduló izotóp, a trícium pedig a legkisebb mennyiségben előforduló. A trícium instabil, felezési ideje körülbelül 12 év 4 hónap. A természetben előforduló hidrogén a két izotóp, az 1H és a 2H keveréke, amelyek természetes gyakorisága 99,99%, illetve 0,01%. 
Cite this PageOnline hivatkozáshoz, kérjük, másolja be az alábbiak egyikét: <a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a> vagy <a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a> Az oldal tudományos dokumentumban való idézéséhez, kérjük, használja a következő MLA-konform idézést: "Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>. . |