Amint láttuk, étrendünk sok szénhidrátot tartalmaz, és elgondolkodhatunk azon, hogy van-e mód egy minta elemzésére, hogy megállapítsuk, hogy az szacharóz, vagy valamelyik szintetikus édesítőszer, mint a szorbit vagy a magas fruktóz tartalmú kukoricaszirup, vagy akár egy olyan vegyület, mint a C-vitamin, amelyet cukrokból szintetizálnak, és ezekhez hasonlóan csak C, H és O tartalma van. Van ilyen mód, és ez az egyik legalapvetőbb elemzési forma, az úgynevezett elemanalízis. Ez az egyik első módszer, amit a kutatók használnak egy új vegyület azonosítására.
Edig a pontig minden sztöchiometriai arányt kiegyensúlyozott kémiai egyenletek együtthatóiból kaptunk. A kémiai képletek azonban relatív anyagmennyiségeket is jelölnek, és a sztöchiometriai arányok ezekből is levezethetők. Például a CO2 képlet azt mondja, hogy bármilyen nagy mennyiségű szén-dioxid mintánk is legyen, minden mol szénatomra mindig 2 mol oxigénatom jut. Vagyis a CO2 képletből megkapjuk a sztöchiometriai arányt
\
Megállapíthatjuk azt is, hogy a CO2 esetében
\
\
\
(E sztöchiometriai arányok reciprokai is érvényesek a CO2-re.)
Egyenletek helyett képletekből származtatott sztöchiometriai arányok szerepelnek a csak C-t, H-t és O-t tartalmazó vegyületek empirikus képleteinek meghatározására szolgáló legelterjedtebb eljárásban. A vizsgálandó anyag lemérlegelt mennyiségét egy égéssorba helyezzük, és száraz O2-áramban melegítjük. A vegyületben lévő összes H H2O(g)-vá alakul, amely szelektíven csapdába esik egy előzőleg lemért abszorpciós csőben. Az összes C CO2(g)-vá alakul, és ezt egy második csőben szelektíven elnyelik. Az egyes csövek tömegének növekedése mutatja meg, hogy mennyi H2O és CO2 keletkezett a minta elégetése során
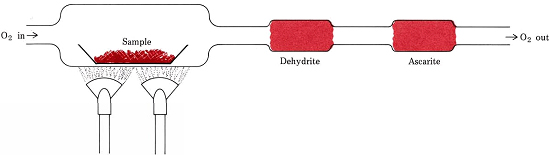
Ábra \(\PageIndex{1}\) Egy égéssorozat. A mintában lévő O2 H-val és C-vel való kombinációjából keletkező H2O-t és CO2-t szelektíven elnyelik a dehidritet és aszkaritot (NaOH azbesztre) tartalmazó csövek.
Példa \(\PageIndex{1}\): Az aszkorbinsav empirikus képlete
Az aszkorbinsav (C-vitamin) 6,49 mg-os mintáját égettük el egy égésvonatban. 9,74 mg CO2 és 2,64 mg H2O keletkezett. Határozzuk meg az aszkorbinsav empirikus képletét.
Megoldás Tudnunk kell a mintában lévő C, H és O mennyiségét. Ezek aránya adja a képletben szereplő indexeket. Az első kettőt a CO2 és a H2O tömegéből a moláris tömegek és a sztöchiometriai arányok segítségével kaphatjuk meg
\
\
Így
\
A vegyület tartalmazhatott oxigént is. Ennek megállapításához számítsuk ki a C és H tömegét, és vonjuk ki a minta össztömegéből
\
Így megkapjuk
\
és
\
Az aszkorbinsavban lévő elemek mennyiségi arányai tehát
\
\
\
Mivel nC:nH:nO 3 mol C:4 mol H:3 mol O, az empirikus képlet C3H4O3.
Az aszkorbinsav molekulájának rajza látható. Az atomok megszámolásával megállapíthatod, hogy a molekula képlete C6H8O6 – pontosan kétszerese az empirikus képletnek. Az is nyilvánvaló, hogy egy molekuláról többet kell tudni, mint azt, hogy hány atom van jelen az egyes fajtákból. Az aszkorbinsavban, akárcsak más molekulákban, nagyon fontos, hogy az atomok hogyan kapcsolódnak egymáshoz, és hogyan helyezkednek el a háromdimenziós térben. A képet, amely megmutatja, hogy mely atomok melyikhez kapcsolódnak, szerkezeti képletnek nevezzük. Empirikus képleteket százalékos összetételből vagy égésvonatkísérletekből kaphatunk, és ha a molekulatömeg ismert, ugyanezen adatokból molekuláris képleteket is meghatározhatunk. A szerkezeti képletek meghatározásához bonyolultabb kísérletek szükségesek. A 2. példában az O tömegét úgy kaptuk meg, hogy a minta össztömegéből kivontuk a C és H tömegét. Ez azt feltételezte, hogy csak C, H és O van jelen. Néha ez a feltételezés helytelen lehet. Amikor a penicillint először izolálták és elemezték, nem vették észre, hogy ként tartalmaz. Ezt a hibát egy ideig nem fedezték fel, mert a kén atomtömege majdnem pontosan kétszerese az oxigénének. A képletben egy kénatom helyett két oxigénatomot helyettesítettek.
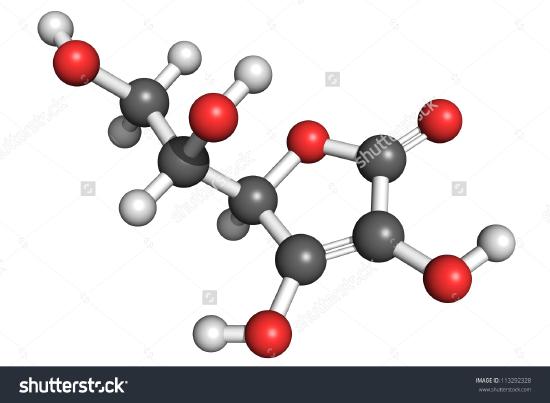
Ábra \(\PageIndex{2}\) Az L-aszkorbinsav 3D ábrázolása 1
From ChemPRIME: 3.4: Vegyületek elemzése