BEVEZETÉS
Amyloidosis egy olyan lerakódásos betegség, amelyet a fibrillumok extracelluláris felhalmozódása okoz, amelynek forrása instabil szerkezetű fehérjékből áll, amelyek összecsukódnak, aggregálódnak és lerakódnak.1 Az ilyen lerakódás megváltoztathatja a szövetek szerkezetét és károsíthatja a különböző szervek és rendszerek működését.2
Az amiloid fibrillumok oldhatatlanok és proteolízisnek ellenállóak, és jellemzően kongóvörössel festődnek, polarizált fényben intenzív sárgászöld kettőstörést mutatnak.3 Több mint 30 fehérje okozhat amiloid lerakódást, de csak 5 okoz jelentős lerakódást a szívszövetben1:
- –
Fényláncok, amelyek primer amiloidózist (AL) okoznak.
- –
Transztiretin (TTR), amely TTR amiloidózist (ATTR) okoz.
- –
Apolipoprotein A.
- –
Fibrinogén.
- –
Szérum amiloid-protein A, amely másodlagos amiloidózist okoz.
A primer amiloidózis és az ATTR a szívamyloidózis leggyakoribb formái, az AL formát történelmileg gyakoribbnak tartották a fejlett országokban.3
A szívamyloidosissal kapcsolatos legtöbb információ eddig az AL-re vonatkozott. Bár azonban az AL-ben szenvedő betegek száma stabil maradt, az ATTR diagnózisok száma az utóbbi időben megnőtt, és ma már úgy gondolják, hogy az ATTR sokkal gyakoribb lehet, mint az AL.2
A transtiretin amyloidózis nagyon gyakran téves diagnózis vagy jelentős késedelem tárgya volt a helyes diagnózisig. Ennek okai között szerepel a formáinak heterogenitása, a szövettani megerősítés szükségessége, a speciális berendezések hiánya, valamint egyes kardiológusok téves meggyőződése, hogy ez egy ritka, kezelési lehetőségek nélküli betegség.2,3
Ezek a szempontok azonban változnak. A diagnózis hatással van a betegkezelésre. Speciális terápiákat fejlesztettek ki, amelyek késleltethetik vagy stabilizálhatják a lerakódást, és amelyek a korai stádiumban hatékonyabbak. A korai diagnózis ezért döntő fontosságú. Ez az áttekintés az ATTR diagnózisában és kezelésében elért jelentős legújabb előrelépéseket ismerteti, reményt adva az ebben az állapotban szenvedő betegek számára.
TRANSTHYRETIN KARDIÁS AMYLOIDOSIS
A transtiretin egy tetramer plazmafehérje, amely a tiroxin és a retinolhoz kötött fehérje szállításáért felelős. Elsősorban a májban szintetizálódik, másodlagosan pedig a chorioidea plexusban és a retina pigment epitheliumában.4
A transtiretin hajlamos dimerekké és monomerekké disszociálni, amelyek fibrillákká rendeződnek félre és lerakódnak. Pontmutációk vagy az életkor hatása fokozhatja ezt a tendenciát, így alakul ki az ATTR 2 klinikai formája: a mutáns (ATTRm) és a vad típusú (ATTRwt).
MUTÁNS TRANSTHYRETIN AMYLOIDOSIS
Jelenleg több mint 120 mutáció ismert, amely az ATTRm-et okozza. Ezek a mutációk autoszomális domináns öröklődési mintázatot mutatnak, változó penetrációval.4 A széles földrajzi változatosság miatt nehéz megállapítani az ATTR prevalenciáját, de ritka betegségnek tekinthető, előfordulási gyakorisága kevesebb, mint 1/100 000 lakos2 (1. táblázat).
Főbb klinikai és diagnosztikai jellemzői a mutáns és vad-Típusú Transthyretin szívamyloidosis
| ATTRwt | ATTRm | |
|---|---|---|
| Prevalencia | Ismeretlen. Látszólag nagyon gyakori | |
| Genetikai vizsgálat | Mutáció hiánya a TTR-ben | Mutáció a TTR-ben |
| Tipikus életkor a megjelenéskor | > 60 év | Változás a kiváltó mutáció szerint |
| Nem | Férfiak túlsúlya. 80% beteg | Férfi predomináns, agresszívebb fenotípussal |
| Extrakardiális manifesztációk | – Carpalis alagút szindróma (33%-49%) – Lumbalis spinalis stenosis – Traumás biceps ínszakadás (32%) |
– Felszálló kétoldali szenzomotoros polineuropátia – Dysautonomia: ortosztatikus hipotenzió, hasmenés-székrekedés, merevedési zavar – Szem érintettsége: Glaukóma, intravitreális lerakódás, pikkelyes pupillák |
| Szívkárosodás | Konstans | Változó a kiváltó mutációtól függően |
| Szív teljesítmény | – Szívelégtelenség (53%-86%) – Vezetési zavarok – AF (43%-67%) – Degeneratív AoS |
– Kondukciós zavarok – Szívelégtelenség – Ritka AF (10%) |
| Diagnosztikai technikák | ||
| EKG | – Pseudoinfarktus mintázat (63%-66%) – Alacsony feszültség (22%-33%) – Sokolow LVH (6%-13%) |
– Pseudoinfarctus minta (18%-69%) – Alacsony feszültség (2%-25%) – Sokolow LVH (3%-8%) |
| ECHO | – Mérsékelt-súlyos hipertrófia – Enyhe-közepes depressziós LVEF (30%) |
– Mérsékelt hipertrófia – LVEF, jellemzően megőrzött |
| Szív MRI | – Késői fokozódás – Emelkedett natív T1 és EV |
|
| 99mTc DPD szcintigráfia | – Grade 2-3 | – Grade 0: Grade 1: kezdeti szívérintettség – Grade 2-3: |
AF, pitvarfibrilláció; AoS, aorta stenosis; ATTRm, mutáns transthyretin amyloidosis; ATTRwt, vad típusú transthyretin amyloidosis; EKG, elektrokardiogram; ECO, echokardiogram; EV, extracelluláris térfogat; LVEF, bal kamrai ejekciós frakció; LVH, bal kamrai hipertrófia; TTR, transthyretin.
Az első TTR-mutációkat familiáris amyloid polyneuropathiaként (vagy Andrade-kórként) jelentették, és ennek következtében az ATTRm-t egészen a közelmúltig neurológiai betegségnek tekintették. A legújabb eredmények azonban az esetek több mint felében szívérintettséget mutatnak.3
Egy erős genotípus-fenotípus korreláció van, a mutációk tisztán neurológiai betegséggel vagy tisztán szívbetegséggel társulnak.3 Az ATTRm szív- vagy neurológiai betegségre való felosztása azonban túlzott leegyszerűsítés lehet, mivel a betegség spektrumának 2 klinikai formája között jelentős átfedés van.
A Val30Met mutáció (ma Val50Met néven ismert, miután az ATTRm hagyományos mutációs nevéhez 20 pozíciót adtak hozzá) a leggyakoribb mutáció világszerte, és Portugáliában, Japánban és Svédországban endémiás. Becsült előfordulási gyakorisága Portugáliában 538 lakosra vetítve 1.2 Mallorca (Spanyolország) és Valverde del Camino (Huelva, Spanyolország) szintén olyan területnek számít, ahol az ATTRm endémiás. A becsült prevalencia Mallorcán a tüneteket mutató betegek körében 3/100 000 lakos.5
A Val30Met mutáció túlnyomórészt neurológiai állapotot okoz szimmetrikus szenzomotoros polineuropátiával, amely az alsó végtagokban kezdődik és felszálló mintázatot követ. Ortosztatikus hipotenzióval, merevedési zavarral, vizeletinkontinenciával és gasztrointesztinális tünetekkel járó dysautonomiával társulhat. Jellemzően az élet második vagy harmadik évtizedének végén kezdődik, és a betegek akár 43%-ának a szíve is érintett lehet, ami gyakori halálozási ok4 (1. táblázat).
Kiemelt jelentőségű a Val122Ile mutáció (p. Val142Ile), amely az észak-amerikai fekete populáció 3-4%-ában fordul elő.3 Bár penetrációja nem teljes,3 ezt a mutációt a szívelégtelenség (HF) kialakulásának 47%-kal megnövekedett kockázatával hozták összefüggésbe.6 Egy nemrégiben végzett vizsgálat kimutatta, hogy a Val122Ile amiloidózis a brit afro-karibi populációban a negyedik leggyakoribb oka a HF kialakulásának.7 Bár az ezzel a mutációval rendelkező betegek akár 30%-ánál az enyhe neuropátia jellemzői is előfordulhatnak,6 a klinikai fenotípus általában hasonló az ATTRwt-hez.4 A Val122Ile nem tekinthető kizárólag a fekete populációra jellemző mutációnak, mivel a fehér populációban is előfordulhat. Mi például 4 fehér spanyol családban azonosítottuk ezt a mutációt fekete felmenők nélkül.
WILD-TÍPUSÚ TRANSTHYRETIN AMYLOIDOSIS
A vad típusú transthyretin amyloidózist először 1876-ban írták le. Korábban szenilis amiloidózisnak nevezték, de a 40 és 60 év közötti betegeknél történő diagnosztizálása ezt a kifejezést elavulttá tette. Érdekesség, hogy e mutáció legkorábbi ismert esetét egy 47 éves amerikai betegnél találták.8
Az ATTRwt pontos előfordulása továbbra sem ismert. A vizsgálatok azonban arra utalnak, hogy aluldiagnosztizált, és hogy ez lehet a szívamyloidosis leggyakoribb formája.2,3 A következő eredmények alátámasztják ezt a hipotézist:
- –
A 80 évnél idősebb betegeknél a TTR-lerakódás előfordulása 25% a boncoláskor.3
- –
A megőrzött ejekciós frakciójú HF-ben (HFpEF) szenvedő betegeknél a közepesen súlyos TTR-lerakódás 5%-os a boncoláskor.9
- –
A 60 év feletti, HFpEF miatt felvett, ≥ 12 mm-es bal kamrai hipertrófiával (LVH) rendelkező betegeknél csoportunk nemrég 13%-os előfordulást talált.10
Az ATTRm-től eltérően az ATTRwt sporadikus betegség, amely jellemzően 70 éves kor után kezdődik4. Főleg férfiaknál fordul elő, és a publikált sorozatok 89% és 98% közötti arányról számoltak be.11,12 Csoportunk azonban egy nemrégiben 2 kórházban (Madrid, Spanyolország és Bologna, Olaszország) ATTRwt-vel diagnosztizált betegekből álló sorozatban azt találta, hogy 20%-ban nőkről van szó. Ezenkívül más boncolási tanulmányok is azt sugallják, hogy az ATTRwt nőknél elterjedtebb lehet a korábban közöltnél. Ezért a női nemnek nem szabad csökkentenie az ATTRwt klinikai gyanúját (1. táblázat).13
Autopsziás leletek azt mutatják, hogy a TTR-lerakódás ATTRwt-ben eloszlik a különböző szervekben. A TTR kardiális tropizmusa miatt azonban a lerakódás sokkal nagyobb a szívben, és a szív érintettsége a fő klinikai manifesztáció.4 A betegek az extracardialis TTR-lerakódás tüneteivel jelentkezhetnek, mint például lumbális csatornaszűkület, a bicepsz-ín atraumatikus szakadása vagy “Popeye-jel” és carpalis alagút szindróma (CTS)3 (1. ábra). Mindezek a jellemzők segíthetnek a diagnózis felállításában és gyors felállításában. A CTS más amiloidózis altípusokat is kísérhet, de az ATTRwt esetében gyakoribb. A lerakódás több évvel megelőzheti a kardiális manifesztációkat.6 Idős, LVH-s betegeknél indikációként használható, különösen, ha kétoldali, nem specifikus foglalkozással összefüggő CTS-ük van, és a New York Heart Association ≥ II. funkcionális osztályába tartoznak (nem publikált adatok).
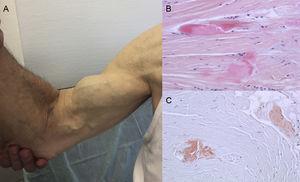
A transthyretin amyloidosis jelei és tünetei. A: a jobb bicepsz ín nem traumás szakadása (“Popeye-jel”). B és C: hematoxilin-eozin (B) és kongóvörös (C) festés (mindkettő ×200) a kéztőszalag mintáján, amely sűrű kollagénkötegeket mutat nem sejtes anyaggal. Dr. Clara Salas Antón jóvoltából.
A TRANSTHYRETIN AMYLOIDOSIS DIAGNÓZISAKlinikai bemutatás
Amyloid bármely szívizomzatba beszivároghat.1 Jellemzően a lerakódás növeli a kamrai falvastagságot, ami fokozatosan csökkenti a tágulási képességet, ami súlyos diasztolés diszfunkcióhoz vezet. Az ATTR-t ezért hagyományosan a restriktív kardiomiopátia okaként tartják számon.
Az ATTR klinikai spektruma azonban sokkal szélesebb és heterogénebb. Az ATTR leggyakoribb tünete a HF. Mint említettük, egy csoportunk által 2015-ben publikált tanulmány szerint a 99mTc-3,3-difoszfono-1,2-propanodikarbonsav (99mTc-DPD) szcintigráfián alapuló protokoll hasznos lehet az ATTRwt diagnózisában a HFpEF miatt felvett 60 év feletti betegek jelentős részénél (13%).10 Ezen eredmény alapján a 99mTc-DPD szcintigráfia bekerült a 2016-os európai HF irányelvekbe, mint az ATTR-es betegek azonosításának hasznos eszköze.14 Az ATTR-re azonban nem szabad kizárólag HFpEF-ben szenvedő betegeknél gyanakodni, mert az amiloidlerakódás előrehaladtával a kontraktilis funkció romlik, és következésképpen az ATTR különböző mértékű szisztolés diszfunkcióval társulhat.
A transtiretin amiloidózis a hipertrófiás kardiomiopátia (HCM) fenokópiája, és összetéveszthető vele. Egy nemrégiben végzett multicentrikus francia tanulmány szerint a HCM-es betegek 5%-ában van ATTRm.15 Eredményeink azonban nem állnak összhangban ezzel a magas aránnyal, ami összefügghet a nagyszámú fekete bőrű franciaországi populációval.
A szív vezetési rendellenességek lehetnek az ATTR első manifesztációja. A sinus és az atrioventricularis csomópontok1 amiloidos infiltrációja jelezheti a pacemaker-beültetés szükségességét (1. táblázat). A korábban említett, Spanyolországban és Olaszországban végzett vizsgálat szerint a vezetési zavarok az ATTRwt első manifesztációja voltak a betegségben szenvedő betegek 7%-ánál.13
A pitvari aritmiák szintén nagyon gyakoriak az ATTRwt-ben szenvedő betegeknél13 (2A. ábra), és a betegség első manifesztációja lehet a stroke.4 Sőt, a Mayo Clinic csoportja nemrég azt javasolta, hogy az ATTRwt-t ki kell zárni, ha idős betegeknél nem-valvularis pitvarfibrillációt (AF) diagnosztizálnak.8 Ezzel szemben az AF sokkal ritkábban fordul elő ATTRm-ben szenvedő betegeknél (1. táblázat).
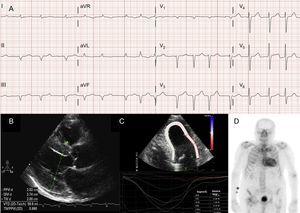
Diagnosztikai technikák a transthyretin szívamyloidosisban (ATTR). A: vad típusú transthyretin amyloidosisban (ATTRwt) szenvedő beteg elektrokardiogramja, amely pitvarfibrillációt és pszeudoinfarctus-mintázatot mutat az alsóbb elvezetésekben. B: egy Val30Met mutációjú, mutáns transthyretin amyloidosisban szenvedő beteg echokardiogramja, kifejezett koncentrikus bal kamrai hipertrófiával és enyhe perikardiális folyadékgyülemmel. C: ATTRwt-ben szenvedő beteg longitudinális regionális strain, amely az apikális szegmensben megőrzött értékeket, a bazális és a középső kamrai szegmensben pedig depressziós értékeket mutat. D: 99mTc-DPD (99mTc-3,3-difoszfono-1,2-propán-dikarbonsav) vizsgálat ATTRwt-ben szenvedő betegnél, amely a csontfelvételt meghaladó biventricularis felvételt mutat, ami megfelel a Perugini 3. fokozatának.
Végezetül megjegyezzük, hogy az ATTR és a degeneratív aorta-szűkület egyazon betegnél is előfordulhat. 2016-ban több tanulmány is felhívta a figyelmet erre a lehetőségre, és egy prospektív vizsgálat arról számolt be, hogy az ATTRwt prevalenciája 6% volt a 65 évesnél idősebb betegeknél, akiknél aortabillentyűpótlásra került sor16. Ez a vizsgálat azt sugallta, hogy a mindkét entitással rendelkező betegeknek sokkal rosszabb volt a posztoperatív prognózisa, mint az ATTRwt nélküli betegeknek (a mortalitás 50% vs. 6,9% a 2,3 éves medián követési idő után).16 Egy másik, 99mTc-DPD szcintigráfiával végzett, nemrégiben végzett vizsgálatban 43, alacsony áramlású/alacsony gradiensű aorta-szűkületben szenvedő betegnél 5 betegnél azonosítottak ATTRwt-t (prevalencia 12%). 17 A súlyos aorta-szűkületben és ATTRwt-ben szenvedő betegek demográfiai profilja megegyezik, és a mindkét betegségben szenvedő betegek megfelelő kezelését még meg kell határozni.
A diagnosztikai technikák hasznossága
A mindennapi klinikai gyakorlatban az ATTR diagnózisa kihívást jelent. Bár az elektrokardiográfia és az echokardiográfia szerepet játszik a diagnózisban, az új noninvazív technikák kulcsszerepet kaptak az ATTR-ben szenvedő betegek értékelésében.
Elektrokardiogram
Az alacsony feszültség és a szív amyloidózisa közötti összefüggést régóta vitathatatlannak tartják.3 A klinikai gyakorlatban a legszélesebb körben használt kritériumok a QRS-amplitúdó 1 Bár az alacsony elektrokardiográfiás feszültségeknek LVH mellett meg kell alapozniuk a gyanút, az ATTR egy kortárs sorozatában a prevalencia mindössze 20-25% volt.3,4,13 A prevalencia az alkalmazott kritériumok szerint is változik. Például a Sokolow-kritérium (S-hullám a V1 elvezetésben + R-hullám a V5 vagy V6 elvezetésben
1,5 mV) alkalmazása 46% és 58% közé emelheti a számított prevalenciát.13 A bal kamra falvastagságának és a teljes QRS-feszültségnek az arányát ajánlották a két technika eredményei közötti különbségek jobb értékelésére.2,3,3 Ugyanakkor az ATTR-betegek akár 20%-a is megfelelhet az LVH elektrokardiográfiás kritériumainak.2,3
A legtöbb, szívamyloidosisban szenvedő betegről szóló sorozatban a pszeudoinfarctus mintázat a leggyakoribb elektrokardiográfiás lelet2,3,13 (2A ábra). A vezetési rendszer esetleges érintettsége miatt a teljes vagy nem teljes kötegágazati blokkok is gyakoriak.3
Echokardiográfia
Bár az echokardiográfia az ATTR kezdeti diagnózisának sarokköve, nincs specifikus lelet.3 A transtiretin amyloidózis jellemzően normális vagy kicsi bal kamra koncentrikus hipertrófiával társult.3 A 2004-ben tartott 10. Nemzetközi Amyloid és Amyloidosis Szimpóziumon az AL okozta szívbetegség echokardiográfiás kritériumaként az LVH egyéb okainak hiányában az LVH jelenlétét határozták meg, az interventricularis septum falvastagság 12 mm-es határértékével.4 Ezt a kritériumot később extrapolálták az amiloidózis más formáira (2B ábra), ami nagyfokú specificitást, de alacsony érzékenységet biztosított.
Noha klasszikusan koncentrikus LVH-t írtak le, a jelenlegi sorozatok szerint körülbelül 20%-ban aszimmetrikus LVH van.13
A normális vagy enyhén csökkent bal kamrai ejekciós frakció (LVEF) és a szív amiloidózisa közötti klasszikus összefüggés ellenére,2 az LVEF tartomány nagyon változó.8 Egy nemrégiben a Mayo Klinikán végzett vizsgálatban az LVEF 8, míg a mi sorozatunkban az LVEF 13 Ráadásul az LVEF használata a szisztolés funkció értékelésére a szív amyloidózisában korlátozott, mivel az enyhén depressziós értékek már releváns szívbetegségre utalnak. Ez a korlátozás áthidalható a szöveti Doppler sebességek, a törzsképalkotás és a myocardialis kontrakciós frakció használatával, amelyeket a szívműködés értékelésére alkalmasabb mutatóként javasoltak.2
Egyéb klasszikus echokardiográfiás jelek a jobb kamrai hipertrófia, a biatriális tágulat, az enyhe pericardialis folyadékgyülem, a pitvari billentyű megvastagodása, a pitvari szeptum falvastagsága és a myocardium szemcsés szikrázó megjelenése.3,6 Mivel azonban e jellemzők némelyikét a betegség előrehaladott stádiumában lévő betegek egy erősen szelektált sorozatában figyelték meg, nem kell mindegyiknek jelen lennie a gyanú megalapozásához.1
A regionális törzsképalkotás nagyon hasznos technika az ATTR-ben szenvedő betegek korai diagnózisában. ATTR-ben szenvedő betegeknél a hosszanti törzs depressziós a bazális és középső ventrikuláris szegmensekben, de az apikális szegmensekben megmarad18 (2C ábra). Ez a jellegzetes mintázat hasznos lehet az ATTR és más szívbetegségek differenciáldiagnosztikájában.4
Biomarkerek
Az agyi natriuretikus propeptid N-terminális prohormonjának (NT-proBNP) és a troponinnak az ATTR-ben betöltött szerepéről kevesebb adat áll rendelkezésre, mint az AL-ben.4 Az NT-proBNP szintje ATTR-ben jellemzően alacsonyabb, mint AL-ben,4 ami 2 különböző patofiziológiai mechanizmust tükröz: közvetlen fénylánc-toxicitás AL-ben vs. protofibrillumok által indukált szövetkárosodás ATTR-ben.
A Mayo Clinic csoportja nemrégiben az AL esetében érvényben lévőhöz hasonló rétegzési rendszert javasolt. Egy 360 ATTRwt-betegből álló kohorszban mindkét biomarker a mortalitás előrejelzőjének bizonyult. A III. stádiumú betegek (NT-proBNP > 3000 pg/ml és troponin T > 0,05 ng/ml) medián túlélése 20 hónap volt, míg az I. és II. stádiumú betegek medián túlélése 66 hónap és 40 hónap volt (nincs biomarker, illetve csak 1 biomarker volt a megállapított határértékek felett).
Szív mágneses rezonancia képalkotás
A szív mágneses rezonancia képalkotás (CMRI) felhasználható strukturális és funkcionális információk megszerzésére és a szívizomszövet összetételének jellemzésére3. A CMRI alapvető fontosságú az ATTR korai felismerésében, valamint az egyéb szívbetegségektől való differenciáldiagnosztikában.
A szövetek CMRI-vel történő jellemzése a következő jellemzők alapján történik:
- –
Késői fokozódás: A globális subendocardialis mintázat gyakorlatilag patognomikus a szív amyloidózisára, de csak a betegek negyedénél van jelen. Más mintázatok, mint például a transzmurális (a leggyakoribb) vagy a foltos, szintén összeegyeztethetőek (3. ábra). A magas érzékenység és specificitás ellenére figyelembe kell venni, hogy előfordulhat a késői enhancement hiánya (a betegek 15%-ánál), és tapasztalataink szerint technikai okokból nem elhanyagolható a hamis negatív eredmények aránya.3 A transzmurális enhancement mintázat rosszabb prognózissal jár együtt, és független prediktora a mortalitásnak.19
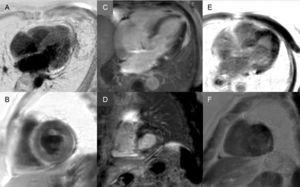 3. ábra.
3. ábra.A késői fokozódási mintázatok sokfélesége a szív mágneses rezonanciás képalkotásában transthyretin amyloidosisban. A és B: késői enhancement szekvenciák, 4 kamra síkban, illetve rövid tengelyen, középszinten, egy mutáns transthyretin amyloidosisban (ATTRm) szenvedő betegnél, diffúz kóros transzmurális gadolíniumlerakódást mutatva. C és D: késői enhancement szekvenciák, 4 kamrai és rövid tengelyes bazális szinten, illetve ATTRm-ben szenvedő betegnél, amelyek patológiás gadolíniumlerakódást mutatnak foltos mintázattal, alsó inferoseptális és inferolaterális bazális fókuszos területtel. E és F, ATTRm-ben szenvedő betegek késői fokozódási szekvenciái, 4 kamrai síkban, illetve rövid tengelyen az apikális szinten, amelyek kiterjedt patológiás transzmurális lerakódást mutatnak, kivéve a bazális és középső anterolaterális szegmenseket. Dr. Jesús González Mirelis jóvoltából.
(0.15MB).- –
Long T1 times: A T1-térképezés egy olyan technika, amelyben a szívizom kvantitatív jelét kontrasztanyag beadása előtt (natív T1) vagy után mérik. A natív T1-idők nagyon hosszúak a szív amyloidózisában.3 A T1-térképezés nem igényel kontrasztanyag beadását, ezért veseelégtelenségben is alkalmazható. A T1-idők még az LVH megfigyelése előtt is kórosak lehetnek.3 A T1-idők hosszabbak ATTR-ben, mint HCM-ben és kontrollban (1097ms ± 43 ms vs. 1026ms ± 64 ms vs. 9,67ms ± 34ms; P
ms ± 68 ms; P = 0,01).20
- –
A kontrasztanyag beadása használható az extracelluláris térfogat (ECV) kiszámítására és az extracelluláris tér növekedésének értékelésére. Az ECV-értékek a szív amiloidózisában magasabbak, mint más szívbetegségekben, kivéve a myocardialis infarktus zónáit.21 2016-ban a mi csoportunk más nemzeti központokkal együttműködve arról számolt be, hogy az ECV-kvantitatív meghatározás képes azonosítani a szív érintettségét ATTRm-ben, és először korrelált a neurológiai károsodás mértékével, támogatva ennek a technikának a használatát az ATTRm korai diagnózisában és nyomon követésében.22
A kvantitatív T1-térképezési és ECV-számítási technikák nagyon hasznosak lehetnek ATTR-ben a korai diagnózis, a klinikai követés és a kezelésre adott válasz értékelésében (4. ábra).
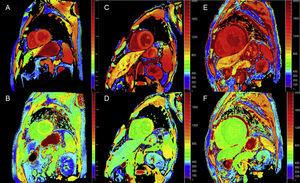 4. ábra.
4. ábra.T1-térképezés, kontrasztanyag előtt és után, módosított look-locker inversion-recovery-vel (MOLLI) 3T szív mágneses rezonancia képalkotásban egészséges kontroll, transthyretin amyloidosisban szenvedő beteg és primer könnyűláncú amyloidosisban szenvedő beteg esetében. A és B: natív T1-térképezés és extracelluláris térfogat (EV) egészséges kontrollban, normális értékeket mutatva (EV = 0,214). C és D: natív T1-térképezés és EV egy mutáns transthyretin amyloidosisban szenvedő betegnél, neurológiai károsodással és kezdődő szívérintettséggel, emelkedett natív T1 és enyhén emelkedett EV (0,361). E és F: natív T1-térképezés és EV egy vad típusú transthyretin kardiális amiloidózisban szenvedő betegnél, emelkedett natív T1 és nagyon magas EV (0,626), ami masszív amiloid-infiltrációt tükröz. Dr. Jesús González Mirelis jóvoltából.
(0.68MB).Szív szcintigráfia
A 80-as években több csontdifoszfonát tracer szívfelvételének megfigyelése szövettanilag korrelált a szív amyloidózisának jelenlétével.23 A felvétel mechanizmusa nem jól jellemezhető, de összefügghet az amiloidlerakódások kalciumtartalmával.
A bolognai csoport 99mTc-DPD-vel végzett korai vizsgálata 15 ATTR-betegnél talált szívfelvételt, 10 AL-betegnél pedig annak hiányát, a csontfelvétellel megegyező vagy azt meghaladó biventricularis felvételen alapuló pontszámot (Perugini-pontszám)24 alkalmazva (2D ábra). Később csoportunk és mások is hasonló eredményekről számoltak be.25 Enyhe (1. score) és mérsékelt (2. score) felvétel az AL-ben szenvedő betegek 30%-ánál, illetve 10%-ánál található.24
Nagy érzékenysége és specificitása miatt ez a technika rendkívül hasznos az ATTR diagnózisának felállításában, és még akkor is mutathat szívérintettséget, ha az echokardiográfiás és MRI-leletek még normálisak. Valójában az onkológiai vagy reumatológiai indikációjú szcintigráfiát követően nem ritka az ATTR véletlen lelete.26
A Tc-DPD nem áll rendelkezésre az Egyesült Államokban, de hasonló eredményekről számoltak be 99mTc-PYP (pirofoszfát) képalkotó eljárással.27
A többi radiotracer jelenleg vizsgálat alatt áll. Például a 18F-florbetapirt, amelyet már engedélyeztek az agyi béta-amiloid képalkotására,4 AL és ATTR betegeknél vizsgálták. Az eredmények azt mutatják, hogy a 18F-florbetapir képes kimutatni a myocardialis AL- és ATTR-lerakódásokat.28 Bár a rendelkezésre álló adatokat esettanulmányokban29 nyerték, és e radiotracer magas költsége korlátozza alkalmazását, több vizsgálat is folyamatban van azzal kapcsolatban, hogy a Tc-DPD-vel szemben milyen előnyökkel járhat a használata az amyloidózis két leggyakoribb típusának szűrési technikájaként.
Invazív diagnózis
Az ATTR végleges diagnózisa az amyloidfibrillumok szövettani kimutatásán alapul. Bár előfordulhat extracardialis lerakódás, az amiloid szövettani kimutatásának valószínűsége szervenként változik.2 Kevés tanulmány van az extracardialis biopszia (pl. hasi zsír, íny, nyálmirigy, gyomor-bélrendszer) költséghatékonyságáról ATTR-ben, ami ATTRm-ben nagyobb, mint ATTRwt-ben. Azonban egy klinikailag nem érintett szerv negatív biopsziája nem zárja ki az ATTR diagnózisát.4
Az ATTRwt-hez hasonlóan az endomyocardialis biopszia az extracardialis érintettség nélküli vagy kizárólag szívbetegségben szenvedő betegeknél javallott.3,4 Az endomyocardialis biopszia alacsony kockázatú eljárás (különösen tapasztalt központokban), és a mintavételi hiba nem valószínű.6
Az amiloidózis szövettani igazolása után, amely néha képzett személyzet általi értelmezést igényel,6 az altípus helyes osztályozása döntő fontosságú.4 Jelenleg az osztályozás az immunhisztokémia, a genetikai elemzés és a proteomika kombinációjától függ:
- –
Az immunhisztokémia az ismert amiloidfehérjék elleni specifikus antitestek használatán alapul. Bár ennek a technikának az eredményei jellemzően véglegesek, a könnyű láncok felismerésében kevésbé érzékeny.4
- –
Ezt a korlátot a tömegspektrometria alkalmazásával lehet kiküszöbölni, amely végleges eredményeket ad, és az amiloid altípus megerősítésének kritériumi standardja.2 Bár ez a technika csak speciális központokban áll rendelkezésre, különösen hasznos a nem egyértelmű esetekben vagy olyan esetekben, amikor az immunhisztokémia több antitestre is pozitív, ami tapasztalataink szerint az esetek 20-30%-ában fordul elő. 4
- –
Mivel a klinikai vagy szövettani technikák nem tudják megkülönböztetni az ATTRm-t az ATTRwt-től, minden ATTR-esetben genetikai vizsgálat javasolt. A kórokozó mutáció megtalálása fontos lehet a genetikai tanácsadás és a tünetmentes hordozók nyomon követése szempontjából,4,30 akik hasznot húzhatnak a közelgő terápiákból, amelyek késleltethetik vagy akár meg is előzhetik a betegség kialakulását31.
Noninvazív diagnózis
A közelmúltig a szövettani vizsgálatokat alapvető fontosságúnak tartották az ATTR diagnózisában.3 A diagnózis megkönnyítése érdekében azonban 2016-ban egy nemzetközi multicentrikus vizsgálat új algoritmust javasolt az ATTR nem invazív diagnózisára.32
A vizsgálat 1217 beteg eredményeit elemezte. A szív amyloidózisának klasszikus jeleinek jelenléte képalkotó eljárásokkal, a 2. vagy 3. fokozatú Tc-DPD/PYP felvétel a szcintigráfián, valamint a monoklonális fehérje hiánya 100%-os specificitást és pozitív prediktív értéket jelentett az ATTR-re32 (5. ábra).
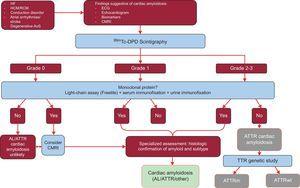 5. ábra.
5. ábra.Diagnosztikai algoritmus a cardialis amyloidosis gyanújában szenvedő betegek számára. 99mTc-DPD szcintigráfia osztályozási rendszere: 0. fokozat, nincs szívfelvétel; 1. fokozat, a csontfelvételnél kissé alacsonyabb felvétel; 2. fokozat, a csontfelvétellel megegyező mérsékelt felvétel; 3. fokozat, a csontfelvételt meghaladó súlyos felvétel. ACV, stroke; AL, elsődleges könnyűláncú amyloidosis; AoS, aorta stenosis; ATTR, transthyretin amyloidosis; ATTRm, mutáns transthyretin amyloidosis; ATTRwt, vad típusú transthyretin amyloidosis; CMRI, cardiac magnetic resonance imaging; EKG, elektrokardiogram; HCM, hypertrophiás cardiomyopathia; HF, szívelégtelenség; RCM, restriktív cardiomyopathia; TTR, transthyretin.
(0.32MB).Az algoritmus legfontosabb jellemzője, hogy nincs olyan monoklonális fehérje, amely AL-t okozhatna a szérumláncvizsgálaton (Freelite, The Binding Site, UK) és a vér és vizelet immunfixációs elektroforézisén. A monoklonális fehérje jelenléte endomyocardialis biopszia indikációja az ATTR és az AL megkülönböztetésére.32 A 65 év feletti lakosság legfeljebb 5%-ának van meghatározatlan jelentőségű monoklonális gammopátiája.2 Idős egyéneknél a keringő könnyű láncok mérsékelt emelkedése nem vezethet közvetlenül az AL diagnózisához. Arról számoltak be, hogy a referenciaközpontokban az ATTRwt-vel és meghatározatlan jelentőségű monoklonális gammopátiával rendelkező idős betegek akár 10%-ánál korábban tévesen AL-t diagnosztizáltak.3,33 A helyes diagnózisra van szükség a nem megfelelő kemoterápia elkerülése érdekében. Érdekesség, hogy kórházunkban 2 olyan esetet dokumentáltak, ahol a tömegspektrometriás vizsgálat során myeloma multiplex és egyidejűleg ATTRwt is előfordult.
A TRANSTHYRETIN CARDIAC AMYLOIDOSIS KEZELÉSE
Az ATTR-ben szenvedő betegek kezelésének két célja van: az orvosi támogatás, és ha lehetséges, az amyloid lerakódás megállítása vagy késleltetése specifikus kezelések alkalmazásával.
Orvosi kezelés
A következő szakaszok az ATTR-ben szenvedő betegek támogató kardiológiai kezelését ismertetik.
A szívelégtelenség kezelése
A szív amyloidózisban szenvedő betegeknél az euvolémiát fenn kell tartani. A diéta és az életmódbeli intézkedések nagyon fontosak. A diuretikumok kulcsfontosságúak a HF kezelésében ATTR-ben. Mivel azonban a diuretikumok túlzott alkalmazása hipotenzióhoz vezethet (gyakran autonóm diszfunkció miatt) és ronthatja a klinikai helyzetet, különösen ATTRm-ben, rendkívüli óvatossággal kell kezelni.
A HF kezelésében ATTR-ben figyelembe kell venni, hogy a károsodott diasztolés diszfunkció és a csökkent lökettérfogat kompenzációs tachycardia kialakulásához vezet a szívtérfogat fenntartása érdekében. Ezért a béta-blokkolókat körültekintően és minden egyes betegre egyénre szabottan kell alkalmazni. A szokásos gyakorlat az, hogy a szívfrekvencia szabályozásának nehézségei hiányában el kell távolítani őket. Ez a megközelítés még fontosabb, ha lehetséges, ATTRwt-ben a vezetési zavarok gyakori jelenléte miatt.6 A kalciumantagonisták és a digoxin az amiloidfibrillumokhoz kötődhetnek, ezért ATTR-ben a toxicitás veszélye miatt még terápiás dózisban is ellenjavallt.6
A más etiológiájú szisztolés diszfunkcióval járó HF-sel ellentétben nincs bizonyíték a béta-blokkolók, angiotenzin-konvertáló enzim gátlók vagy angiotenzin II-receptor-antagonisták prognosztikai előnyére a szív amyloidózisában. Valójában alkalmazásuk a hipotenzió és az alacsony teljesítmény miatt klinikai romláshoz vezethet: egy nemrégiben megjelent publikáció rosszabb prognózisról számolt be ATTRm-ben és semleges hatásról ATTRwt-ben.34
A pitvari ritmuszavarok kezelése
A pitvari ritmuszavar kezelése ATTR-ben kihívást jelent. A hosszú távú sinusritmus fenntartása nehéz. Az elektromos kardioverzió azonban megkísérelhető, mert klinikai javuláshoz vezethet.
A tromboembóliás kockázat ATTR-ben szenvedő betegeknél nagyon magas. Ezenkívül a krónikus amiloid-infiltráció mechanikus pitvari diszfunkcióhoz vezethet, ami néhány AF nélküli betegnél a pitvari trombus kialakulásának kiváltó oka lehet. Az ATTR-ben alkalmazott antikoaguláns terápia nem alapulhat a CHADS2-VASC pontszámon, és az AF-ben standard terápiának kell lennie. A vérzéses események ritkábbak, mint AL-ben, ezért egyes kórházak szinuszritmusban lévő betegeknél antikoaguláns terápiát javasolnak, ha a transzmissziós Doppler-sebesség alapján gyenge pitvarfunkció áll fenn. Bár nincsenek összehasonlító tanulmányok a direkt orális antikoagulánsok és a K-vitamin-antagonisták hatékonyságáról, kórházunkban kiválasztott betegeknek adtak direkt orális antikoagulánsokat.
A készülékek szerepe
A pacemaker beültetésére vonatkozó jelenlegi ajánlások megegyeznek az ATTR és az általános populáció esetében. Egyes csoportok azonban a profilaktikus beültetést támogatják, különösen ATTRm-ben és vezetési zavarokban szenvedő betegeknél.35 Mi nem támogatjuk ezt a megelőző stratégiát, és nem találtuk a vezetési zavarok olyan magas arányát, amely indokolná a profilaktikus beültetést ATTRm-ben szenvedő betegeknél.
A beültethető kardioverter-defibrillátor (ICD) alkalmazásának szerepe ATTR-ben nem jól megalapozott. Egy kis sorozatban az ICD beültetése nem javította jelentősen a túlélést, bár az első 2 évben több betegnél megfelelő hatása volt.36
Szívtranszplantáció
A szívtranszplantáció kisebb szerepet játszott az ATTR-ben, mivel az ATTRm több szervet is érinthet, és az ATTRwt jellemzően idős betegeket érint. Az ATTRwt-ben szenvedő betegeknél azonban az extracardialis érintettség hiánya miatt jó jelöltek az eljárásra. Az irodalomban találunk példákat sikeres transzplantációra 70 évnél fiatalabb, ATTRwt vagy ATTRm és túlnyomórészt szívérintettségű betegek esetében.4
A Transthyretin cardialis amyloidosis specifikus kezelése
Az ATTR cardialis amyloidosis specifikus kezelésére jelenleg nincs engedélyezett terápia, bár a májátültetést (TxH) önmagában vagy szívátültetéssel kombinálva az 1990-es évek óta alkalmazzák ATTRm esetében a prekurzor TTR fő forrásának megszüntetésére.4
Májtranszplantáció
A Familial Amyloidotic Polyneuropathy World Transplant Registry37 arról számolt be, hogy 20 országban több mint 2000 ATTRm-es betegnél végeztek TxH-t.4 A Val30Met mutációval és túlnyomórészt neurológiai klinikai képpel rendelkező betegek túlélési aránya 20 év alatt több mint 50%.3 Ezek az ígéretes eredmények az életkor, a mutáció típusa és a betegség stádiuma szerinti szigorú betegszelekción alapulnak. A TxH leggyakrabban elfogadott indikációja a fiatal életkor, a Val30Met mutáció és a betegség korai stádiumának kombinációja.
A technika fő korlátai azonban a donorok hiánya, a krónikus immunszuppresszió szükségessége, az előrehaladott életkor a megjelenéskor, valamint a Val30Met mutációtól eltérő mutációval rendelkező betegeknél elért rosszabb eredmények.
Mellett a mutáns fehérje termelésének elméleti szuppresszióját ellensúlyozza a beültetés utáni progresszív natív TTR-lerakódás,4,6 amelynek mechanizmusa nem teljesen tisztázott. Valójában a TxH-t követő kardiális TTR-lerakódás befolyásolja a morbiditást és a mortalitást.
Az ATTR patogenezisének és a TxH korlátainak jobb megértésének igénye számos gyógyszer kifejlesztését ösztönözte.
Ezek az új vegyületek a TTR amiloidogenezis kaszkádjának különböző pontjain hatnak (6. ábra). A kezelés mindig a prekurzorfehérje csökkentésével jár, bár a lerakódás elkerülése és a meglévő lerakódások megszüntetése ugyanolyan fontos. Ezért úgy gondoljuk, hogy a jövőben a betegség megközelítése kombinált kezelés formájában fog történni.
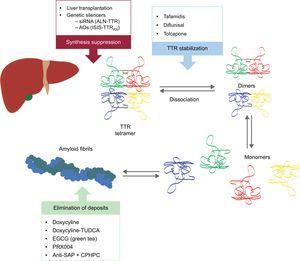 6. ábra.
6. ábra.Specifikus terápiák transthyretin szívamyloidosisban és fő célpontok. AntiSAP + CPHPC, antiszérum amiloid P komponens + (R)-1–6-oxo-hexanoil]pirrolidin-2-karbonsav; AO, antisense oligonukleotidok; EGCG, epigallokatechin-3-gallát; siRNS, kis interferáló RNS; TTR, transtiretin; TUDCA, tauroursodeoxikolsav.
(0.27MB).A transtiretin-szintézis elnyomása
Két kutatási irányvonal van folyamatban a TTR máj expressziójának gátlására: a kis interferáló RNS (siRNS) és az antisense oligonukleotid (AO) gyógyszerek alkalmazása.
- –
A siRNS-ek olyan kettős szálú RNS-molekulák, amelyek a hírvivő RNS-szekvenciákat specifikusan hozzájuk kötődve elnémítják, megakadályozva a fehérjeképződést. A Patisiran (ALN-TTR02) 80%-kal csökkenti a TTR-termelődést.38 ATTRm-ben szenvedő betegeknél a TTR-csökkenés 87%-os volt.39 Egy 2. fázisú vizsgálat ígéretes eredményeket mutatott, stabil echokardiográfiás, funkcionális és analitikai paramétereket mutatott 12 és 24 hónap után.40 Az ATTRm-ben szenvedő betegeknél végzett 3. fázisú neurológiai vizsgálat és a szívérintettségű betegek alanalízisének eredményei 2017-ben várhatóak (2. táblázat). Egy másik gyógyszert, a revusirant (ALN-TTR01) szubkután adják be, és a patisirantól az siRNS-t kapszulázó lipid nanorészecskékben különbözik. Ezzel a gyógyszerrel egy III. fázisú klinikai vizsgálatot végeztek ATTRm-ben szenvedő, szívbetegségben szenvedő betegeknél. A vizsgálatot tavaly leállították, mivel a kezelt csoportban váratlanul megnőtt a halálozás (2. táblázat).
2. táblázat.Főbb folyamatban lévő klinikai vizsgálatok a transthyretin szívamyloidosisban
Hatásmechanizmus Vegyület Kísérlet Tervezet. Betegek (N) és ATTR altípus Kezelés Primer végpontok Szituáció/eredmények TTR szintézis szuppresszió Patisiran (ALN-TTR02) NCT01961921 Phase II vizsgálat, multicentrikus 27
ATTRm (11 szív érintettsége)Patisiran 0.30 mg/kg IV 3 hetente 2 éven keresztül Hosszú távú biztonságosság. Másodlagos végpontok: Neurológiai rendellenességekre és szívparaméterekre gyakorolt hatás Jól tolerált gyógyszer, hasonló biztonsági profillal a neurológiai és a szívfenotípusban
Troponin I, NT-proBNP és echokardiográfiás adatok stabilak maradtak 12 mo és 24 mo utánNCT01960348 (APOLLO) III. fázisú, randomizált, kettős vak, placebokontrollos, multicentrikus 225
ATTRm neurológiai érintettséggelPatisiran infúzió IV vs placebo 2:1 Változások az mNIS+7-ben Várhatóan 2017 novemberében
Subanalízis az előre jelzett szívérintettségű betegekNCT02510261 APOLLO kiterjesztő vizsgálat Patisiran infúzió IV vs placebo 2:1 52 wk alatt Biztonság és hosszú távú mellékhatások Folyamatban Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Phase III, randomizált, kettős vak, placebokontrollált 206
ATTRm szívérintettséggelRevusiran 500 mg 5 d, majd hetente 2 éven át vs placebo Változások a 6 m-es sétatesztben és a plazma TTR-értékekben A revusiran karban megnövekedett mortalitás miatt megszűnt ISIS-TTRRX NCT01737398 Phase II/III, randomizált, kettős vak, placebokontrollált, multicentrikus 172
ATTRm neuropátiával; 50% egyidejű szívérintettségISIS-TTRRX 300 mg SC 12 óránként 1 hétig, majd hetente 64 wk-ig vs placebo Változások az mNIS+7 és a Norfolk életminőségi kérdőívben Várhatóan 2017 szeptemberében
Súlyos trombocitopénia és vérzés eseteiről számoltak be
Echokardiográfiás paraméterek elemzése és NT-proBNP várható a hipertónia nélküli, LVH > 12 mmTTR-kardiomiopátia kezelése TTR-specifikus antisense oligonukleotiddal Phase II, nyílt, nem randomizált 20
ATTRm szívérintettséggel és ATTRwtISIS-TTRRX 300mg SC 12 h/hetente Echokardiográfiás paraméterek és szív MRI vs. historikus kontroll Nem romlott a törzs és csökkent az LV tömeg kb. 5%-kal
6 beteg végzett 12 hónapot; 15 beteg 6 mo; 1 beteg TxCNCT02627820 Phase II, nyílt, nem randomizált 50
ATTRwtISIS-TTRRX 300mg SC 12 óránként 1 wk alatt, majd 1 wk 18 wk alatt A törzsben bekövetkező változások speckle trackinggel mérve Páciensek toborzásának megkezdése nélkül törölték Phase III vizsgálat az ISIS-TTRRX-szel a TTR amiloid kardiopátia kezelésére Phase III, randomizált, kettős vak, placebokontrollált, multicentrikus 490
ATTRwt és ATTRm szívérintettséggelISISIS-TTRRX 300 mg SC 12 óránként 1 wk-ig, majd hetente 16 wk-ig placebóval, majd hetente 24 hónapig Halál, TxC vagy kardiovaszkuláris okok miatti felvétel Készenlétben TTR stabilizálása Tafamidis NCT01994889 III. fázis, randomizált, kettős vak, placebo-kontrollált, multicentrikus 441
ATTRwt és ATTRm szívérintettséggelTafamidis 20 mg vagy 80 mg szájon át 24 óránként 30 hónapig vs placebo All-halálozás és kardiovaszkuláris hospitalizáció Végzés 2018. február NCT02791230 Hosszabbítás III. fázis NCT01994889 330
ATTRwt és ATTRm szívérintettséggelTafamidis 20 mg vagy 80 mg orálisan 24 óránként 60 hónapig All-az-Cause mortality and incidence of adverse effects Expected December 2021 NCT00935012 Phase II, nyílt, hatékonysági és biztonságossági vizsgálat 31
ATTRwt vagy ATTRm p.Val122Ile szívérintettséggelTafamidis 20 mg szájon át Biztonságosság és hatékonyság Folyamatban 2021 decemberéig Diflunisal NCT00294671 Phase III, randomizált, kettős vak, placebo-kontrollált, multicentrikus 130
ATTRm neurológiai fenotípussal (50%-ban szívérintettséggel)Diflunisal 250 mg szájon át 12 óránként vs placebo 24 hónap alatt NIS+7 24 hónap alatt NIS+7 diflunisal vs placebo 16.3 (P Nem csökkent a kamra vastagsága vagy terhelése a szív érintettségében szenvedő betegeknél vs placebo A lerakódások megszüntetése Doxiciklin + TUDCA/UDCA NCT01171859 Phase II, nyílt, nem randomizált, prospektív 40
ATTR (25 ATTRm, 13 ATTRwt és 2 domino májtranszplantáción átesett)Doxiciklin 100 mg 12 óránként + TUDCA 250 mg 8 óránként 12 hónapig, majd 6 mo terápia nélkül Előrehaladás 14 beteg visszalépett
Nemkívánatos bőrreakciók, 16 beteg
A 25 értékelhető beteg 68%-a teljesítette az elsődleges végpontot
A törzsállapot javulása 12 mo után és romlása 6 mo után terápia nélkülNCT01855360 Phase II, nyitott, nem randomizált, prospektív vs. korábbi kontrollok 30
Szív ATTR amyloidosis (27 ATTRwt és 3 ATTRm). Történeti kontrollok, 14 ATTRwt betegDoxiciklin 100 mg 12 óránként + TUDCA 250 mg 8 óránként 18 hónapig A hosszanti törzs változása 6 hónaponként 22 beteg fejezte be a vizsgálatot és volt értékelhető
Nagyobb törzsromlás a kontrolloknál vs. kezelési csoport
Növekedett NT-proBNP a kezelési csoportban; kontrolloknál nem mértükNCT01677286 Phase II, nyitott, nem randomizált, prospektív 25
Szisztémás amyloidosis (6 ATTRwt és 3 ATTRm)Doxiciklin 100 mg 12 óránként 12 hónapig A gyógyszer biztonságossága
Az érintett szervek reakciójaAz NT-proBNP és a vesefunkció
Nem javult más vizsgált paraméterek
A betegek 60%-ának bőrszövődményei voltak, és 30%-uk visszalépett bőr- vagy gyomor-bélrendszeri problémák miattNCT01171859 Phase II, nyitott, nem randomizált, prospektív 45
35 szív érintettséggel; 25 ATTRm; 5 ATTRm TxH-val; 13 ATTRwt; és 2 domino májtranszplantáción átesettDoxiciklin 100 mg 12 óránként + TUDCA 250 mg 8 óránként 12 hónapig
Következő követési szakasz kezelés nélkül 6 hónapigA gyógyszerre adott válasz meghatározása: Szívválasz 25 betegnél értékelték
68%-nak volt szívválasza
Növekedett NT-proBNP és a törzsállapot romlása a kezelés nélküli követés során
Nemkívánatos hatások miatti visszalépések magas száma
14 visszalépett a kezelési fázisban és 5 abbahagyta a kezelés nélküli fázisbanDoxiciklin + UDCA hatása az ATTR-re II. fázis, nyitott, nem randomizált, prospektív 28
ATTR szívérintettséggel (27 ATTRm és 1 ATTRwt)Doxiciklin 200 mg/d 4 hétig, majd 2 hétig felfüggesztve, majd UDCA 750 mg/d 12 hónapig
Következő követési szakasz kezelés nélkül 6 hónapigVáltozások az NT-proBNP-ben és a Kumamoto-pontszámban Mindössze 14% fejezte be a vizsgálatot és 36% a 12 hónapot
Nem változott az NT-proBNP 6 mo alatt és romlás 12 mo alatt
Stabil LVH
A Kumamoto score romlása 12 mo alattEGCG NCT01171859 Phase II, nyílt, nem randomizált, prospektív 25
ATTRwt600 mg, EGCG 12 hónapig Változások az ECHO-ban és a szív MRI-ben (n = 14) csökkent LV tömeg 6% szív MRI-vel (P = 0.03)
LVEF, myocardialis vastagság és MAPSE ECHO-n változatlanAntiSAP + CPHPC NCT03044353 Phase II, nyitott, randomizált 40
Cohort 1: szív ATTR amyloidosis
Cohort 2: primer amyloidosis 6 hónap kemoterápia utánAnti-SAP + CPHPC havonta 6 hónapig csökkent amyloidterhelés szív MRI és ECHO alapján Kezdés 2017-ben AntiSAP + CPHPC, Antiszérum amiloid P komponens + (R)-1–6-oxo-hexanoil]pirrolidin-2-karbonsav; ATTRm, mutáns transthyretin amyloidosis; ATTRwt, vad típusú transthyretin amyloidosis; BNP, agyi natriuretikus peptid; ECHO, echokardiogram; EGCG, epigallokatechin-3-gallát; IV, intravénásan; LV, bal kamra; LVEF, bal kamrai ejekciós frakció; LVH, bal kamrai hipertrófia; MAPSE, mitralis gyűrűs sík szisztolés kitérés; mNIS, Modified Neuropathy Impairment Score; MRI, mágneses rezonancia képalkotás; NIS, Neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, amino-terminal pro-brain natriuretic peptide; SC, subcutan; TTR, transthyretin; TUDCA, tauroursodeoxycholic acid; TxC, szívátültetés; TxH, májátültetés; UDCA, ursodeoxycholic acid.
- –
Az AO-k rövid oligonukleotidszálak, amelyek specifikusan kötődnek az RNS-hez, megakadályozva a transzlációt és a célfehérje szintézist.4 Az ISIS-TTRRX egy szubkután AO, amely egészséges önkéntesekben a TTR-értékek 75%-90%-os dózisfüggő csökkenését bizonyította.4 Az ATTRm-ben és neurológiai fenotípusban szenvedő betegeken végzett III. fázisú vizsgálat 2017 márciusában fejeződött be, eredményei 2017 végére várhatók. Az amerikai Élelmiszer- és Gyógyszerügyi Hatóság azonban elhalasztotta a szívbetegséggel járó ATTRwt és ATTRm betegeknél végzett III. fázisú vizsgálat megkezdését, mivel a neurológiai vizsgálatban súlyos trombocitopéniás esetek fordultak elő (2. táblázat). Mivel a neurológiai vizsgálatban résztvevők 50%-ának szívbetegsége volt, e szívbetegséggel kapcsolatos alvizsgálat eredményei fogják meghatározni, hogy a III. fázisú vizsgálatot folytatják-e. Másrészt vannak előzetes adatok egy nyílt fázisú II. fázisú vizsgálatból. Ebben a vizsgálatban 22 ATTRwt és ATTRm szívbetegségben szenvedő beteg kapott heti rendszerességgel ISIS-TTRRX injekciót. A jelentés szerint a gyógyszer biztonsági profilja nagyon kedvező, és a CMR, az NT-proBNP és a 6 perces tesztek alapján a szívbetegség progressziójára vonatkozó köztes adatok pozitívak.41
A transthyretin stabilizálása
A TTR-tetramer alegységekre történő disszociációja döntő lépés az ATTR-fibrillumok kialakulásában. A diflunisal és a tafamidis 2 TTR-stabilizátor, amelyek hatékonysága bizonyított az ATTRm polineuropátiában.
- –
A tafamidis egy orálisan beadott kismolekula, amely a TTR-hez kötődik a T4 kötőhelyeken, stabilizálva a fehérjét és megakadályozva annak disszociációját. A neurológiai betegség kezdeti stádiumában lévő 125 ATTRm és Val30Met mutációban szenvedő betegnél végzett randomizált kettős vak vizsgálat eredményeinek közzétételét követően42 az Európai Gyógyszerügynökség 2011-ben engedélyezte a neurológiai progresszió késleltetésére szolgáló, ritka betegségek gyógyszerként való alkalmazását. A legújabb adatok bizonyítják a gyógyszer hatékonyságát a neurológiai stabilitás elérésében a résztvevők legalább 60%-ánál több mint 4 éves követés után. Eddig ATTR és kardiológiai betegségben korlátozottan alkalmazható. Egy II. fázisú vizsgálat 21 ATTRm-ben és különböző mutációkban szenvedő betegnél azt mutatta, hogy az NT-proBNP és az echokardiográfiás paraméterek 12 hónap után stabilak maradtak.43 Egy 5 éves kohorszvizsgálat adatai megerősítették, hogy a gyógyszer 20 mg-os dózisban jól tolerálható, bár kevés ATTRwt-ben szenvedő beteg maradt stabil 3,5 év után.44 Az ATTR-ACT vizsgálat egy 30 hónapos III. fázisú vizsgálat, amelyben 440 ATTRm, ATTRwt és HF-ben szenvedő betegnél vizsgálták a 20 mg és 80 mg tafamidis és placebo dózisok hatékonyságát, biztonságosságát és tolerálhatóságát. Az elsődleges végpont a kórházi halálozás és felvétel. Eredményei 2018-ban várhatóak.3,27
- –
A diflunisal egy nem szteroid gyulladáscsökkentő szer, amely in vitro stabilizálja a TTR-molekulákat. Spanyolországban nem áll rendelkezésre, de külföldről orvosilag kérhető könyörületes felhasználásra. Az ATTRm III. fázisú vizsgálata túlnyomórészt neurológiai érintettségű betegeken, akiknek több mint fele szívbeteg volt, nem talált jelentős különbségeket az echokardiográfiás paraméterekben a vizsgálati időszak alatt (2. táblázat).45 A gyomor-bélrendszeri mellékhatások, veseelégtelenség, vízvisszatartás és magas vérnyomás kialakulásának lehetősége miatt nem alkalmas szívbetegségben szenvedő betegeknél. A diflunisalra vonatkozó bizonyítékok ATTR-betegeknél nagyon korlátozottak. Egy tanulmány létezik, de azt korlátozta, hogy nem randomizált, egyközpontú, kevés követéses és kevés beteg (n = 13) volt. Dekompenzált HF miatt nem történt felvétel, de a vesefunkció jelentős romlását tapasztalták.46
- –
Még nemrégiben egy spanyol csoport kimutatta, hogy a tolkapon (a Parkinson-kór kezelésében alkalmazott orális katechol-O-metiltranszferáz-gátló) képes in vitro kötődni az ATTRwt és Val122Ile betegek TTR-éhez, nagyobb affinitással, mint más stabilizátorok.47
Az amiloid lerakódások eliminációja
Az amiloid lerakódások nagyon stabilak, és úgy tűnik, hogy az emberi szervezetnek kevés képessége van azok eliminálására. Az olyan kezelések azonban, amelyek megakadályozzák az új amiloidok termelődését, mint például a kemoterápia az AL-ben, fokozatosan, szervspecifikusan eltérő ütemben képesek megszüntetni a lerakódásokat. A szív tisztulása különösen alacsony, és egyelőre kevés bizonyíték van a visszafejlődésre. Jelenleg több molekulát is vizsgálnak az ATTR-ben az amiloid szívtisztulás felgyorsítására:
- –
A doxiciklin (egy általánosan használt antibiotikum) megzavarja az amiloidfibrillumok képződését. A doxiciklin és a májbetegségek kezelésében alkalmazott tauroursodeoxikolsav (TUDCA) kombinált doxiciklin szinergista hatását a TTR-lerakódások megszüntetésében mutatták ki állatmodellekben. Egy 20 beteggel végzett II. fázisú vizsgálat a doxiciklin/TUDCA-val végzett 1 éves kezelés után nem mutatott ki szív- vagy neurológiai progressziót, elfogadható biztonsági és tolerálhatósági profil mellett.4 Más II. fázisú vizsgálatok megpróbálták megerősíteni ezeket az eredményeket kombinált doxiciklin/TUDCA, doxiciklin/ursodeoxikolsav vagy csak doxiciklin alkalmazásával.48-50 Az egyik ilyen vizsgálat előzetes eredményei védőhatásra utalnak, a szívműködés kevésbé romlott a terhelés miatt a kezelt csoportban. Egy másik ilyen vizsgálat hasonló eredményeket kapott 40 ATTR-betegnél: az NT-proBNP, a funkcionális osztály, az LVEF és a szívizomvastagság paraméterei többek között 12 hónap alatt stabilak maradtak (2. táblázat). Mindazonáltal mindezen vizsgálatokban magas volt a lemorzsolódási arány (35%-44%), főként a mellékhatások, különösen a napérzékenység és a gasztrointesztinális panaszok miatt (akár 30%).48-50
- –
Az EGCG (epigallokatechin-3-gallát) a zöld tea legnagyobb mennyiségben előforduló katechinje, amelyről in vitro és egérmodellben kimutatták, hogy gátolja az amiloidképződést és megszünteti a meglévő lerakódásokat4. A CMRI kimutatta, hogy 600 mg EGCG napi adagolása a bal kamra tömegének stabilizálódásával járt egy 25 betegből álló csoportban (2. táblázat).51
- –
A PRX004 egy monoklonális antitest, amely monomer-specifikus epitópokhoz és félregördült TTR-hez kötődve hat. Így a fagocitózis aktiválásával váltja ki a lerakódások eltávolítását.52 Hatásmechanizmusának alapja hasonló az AL-ben használt antitestéhez. Az ezzel az antitesttel végzett II. fázisú vizsgálatok ígéretes eredményeket mutatnak. Ennek az új antitestnek az I-II. fázisú vizsgálata 2017-ben kezdődik.
- –
Az amiloid prekurzor fehérje típusától függetlenül minden lerakódás tartalmaz szérum amiloid P komponenst (SAP). Ezt a molekulát célpontként használva kimutatták, hogy az anti-SAP antitestek makrofág-mediált és komplement-függő reakciót váltanak ki, amely a zsigeri amiloid lerakódások jelentős mértékű eliminációját okozta egy egérmodellben. A CPHPC bisz-D-prolin vegyület képes semlegesíteni a plazma SAP-t, és az anti-SAP IgG-vel való együttes adagolás lehetővé teszi, hogy az antitest elérje a szövetekben lévő SAP-tartalmú lerakódásokat.53 Egy 2015-ben közzétett I. fázisú vizsgálat 15 szisztémás amiloidózisban szenvedő, szívérintettség nélküli betegnél mutatta ki a májlerakódások eltávolítását, kevés mellékhatás mellett.53 Az ATTR-szívamyloidosisban és AL-ben szenvedő betegek II. fázisú vizsgálata 2017-ben kezdődik (2. táblázat).
KÖVETKEZTETÉSEK
A transtiretin szívamyloidózist egyre gyakrabban diagnosztizálják. A 99mTc-DPD-szcintigráfia és a CMRI példák olyan technikákra, amelyek az ATTR-ben szenvedő betegek egyszerű és korai azonosítására használhatók.
Más ATTR-specifikus gyógyszerek jelenleg a kutatás végső fázisában vannak. Ezért úgy gondoljuk, hogy az ATTR szívamyloidózis hamarosan kezelhető, nem pedig halálos kimenetelű betegségnek tekinthető.
FORRÁSZATOK
Ezt a munkát a Carlos III Egészségügyi Intézet és a Spanyol Kardiológiai Társaság részleges támogatásával végeztük (2016-os kutatási ösztöndíj E. González-Lópeznak). A Carlos III Egészségügyi Intézet támogatását az Európai Regionális Fejlesztési Alap “Európa egy másik útja” finanszírozza.
Érdekütközések
E. González-López előadóként részt vett a Pfizer által szervezett tevékenységekben. P. Garcia-Pavia a Pfizer által szervezett tevékenységek előadójaként, valamint az Alnylam, a Prothena és a Pfizer tanácsadójaként kapott kifizetéseket. E. González-López, A. López-Sainz és P. Garcia-Pavia kijelentik, hogy a Pfizer finanszírozta az intézményük kutatási projektjeit.
- –
- –