A savak erősségét szabályozó legáltalánosabb elv így fogalmazható meg: az erős savaknak viszonylag stabil konjugált bázisai vannak. Általában minél stabilabb a konjugált bázis, annál erősebb a sav. Fontos megjegyezni, hogy a stabilitás és a reakcióképesség fordítottan arányosak. Minél stabilabb egy anyag, annál kevésbé reaktív, és fordítva. Ezért a fenti szabályt úgy is megfogalmazhatjuk, hogy az erős savaknak gyenge konjugált bázisai vannak. A HCl és a H3O+ erős savak. Ennek megfelelően a megfelelő konjugált bázisok, Cl- és H2O, gyengék (nagyon stabilak). A kloridion azért stabil, mert a negatív töltés egy nagyon elektronegatív atomon található. A vízmolekula az egyik legstabilabb ismert anyag.
Honnan tudjuk, hogy melyik proton a legsavanyúbb egy olyan molekulában (például az ecetsavban), amely többféle protont tartalmaz? Ne feledjük, hogy minél magasabb a proton pozitív karaktere, annál savasabb. A pKa-táblázat vizsgálata feltár néhány tendenciát a savas protonokra vonatkozóan. A savasság előrejelzéséhez a következő irányelvek használhatók.
1. A közvetlenül nagyon elektronegatív atomokhoz, például az oxigénhez, a kénhez és a halogénekhez kapcsolódó hidrogének jelentős savasságot hordoznak.
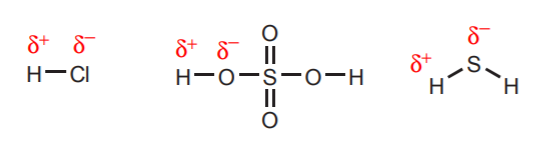
2. A pozitív töltésű nitrogénhez, oxigénhez vagy kénhez kapcsolódó hidrogének savasak. Ezeknek az atomoknak a nagy elektronegativitása miatt kellemetlen a pozitív töltésük. Igyekeznek a töltést a szomszédos atomok között szétteríteni azáltal, hogy elektronsűrűséget vonnak el tőlük. Ezt az ábrán látható rezonanciaszerkezetek rajzolásával mutathatjuk ki.
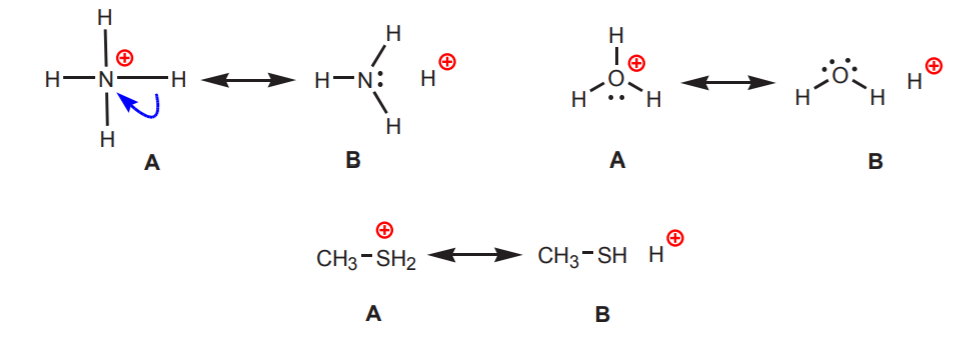
A B szerkezet minden esetben a hidrogén pozitív jellegét, tehát savas jellegét mutatja.
3. Amint azt az alkánok és alkének pKa értékei mutatják, a szénhez kötött hidrogének nagyon alacsony savasságúak. Az ilyen anyagokat általában egyáltalán nem tekintik savaknak. Egyes szénhidrogének azonban gyengén savasak lehetnek, ha konjugált bázisaik stabil ionok. Ez a következő esetekben fordulhat elő:
a) A vizsgált proton közelében egy vagy több elektronegatív atom van. Ezeknek az elektronegatív atomoknak az induktív hatása miatt a közelben lévő hidrogénatomok elektronsűrűségtől megfosztottak, ezért részlegesen pozitív jellegűek.
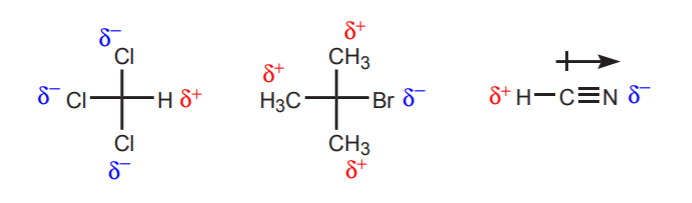
b) Egy olyan szénhez kötött hidrogénatom, amely viszont egy másik, részleges vagy teljes pozitív töltést hordozó szénhez kötődik, savas.
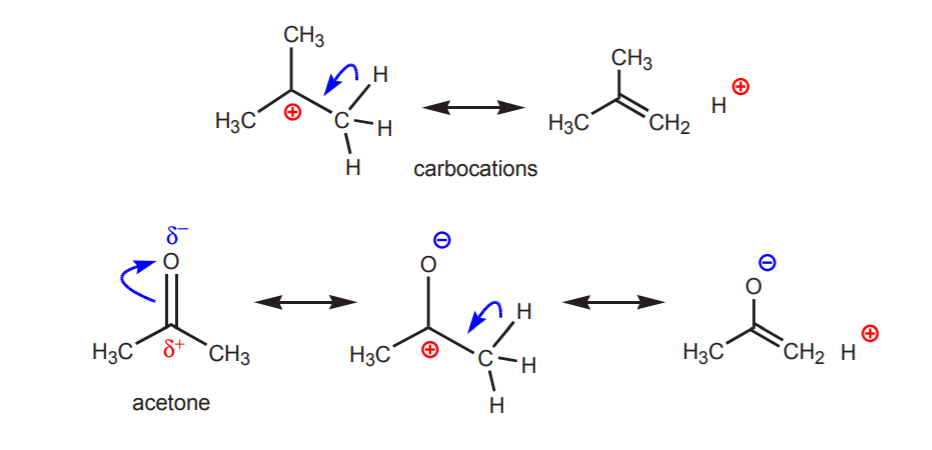
A mutatott protonok savassága az eliminációs reakciókban (6. fejezet) és az enolok kémiájában (22. fejezet) válik nyilvánvalóvá, amikor egy bázis jelenléte protonátvitellel járó lépés révén alkének vagy enolátionok képződéséhez vezet.
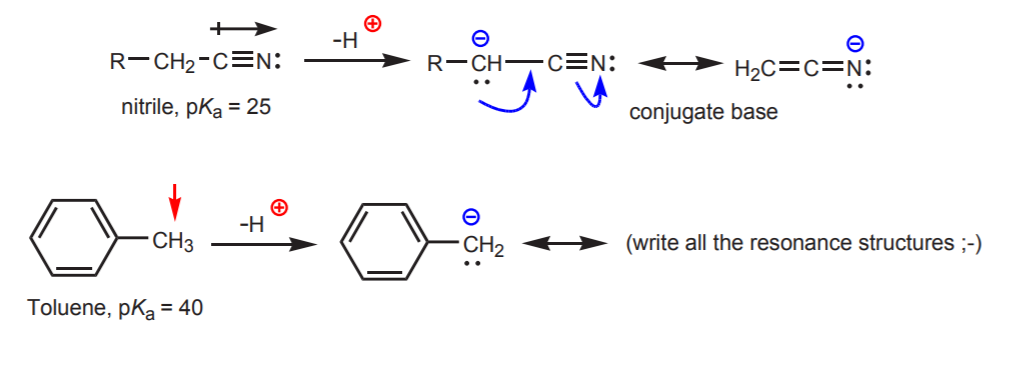
c) A konjugált bázis rezonanciastabilizált. Ez a hatás akkor a legfontosabb, ha van egy másik, a savasságot fokozó tényező, például egy dipól vagy elektronegatív atom jelenléte (mint a nitril funkciós csoportban, -CN). Egyébként a rezonancia-stabilizáció önmagában nem elegendő ahhoz, hogy drámaian megnövelje a szénhez kötött hidrogén savasságát (mint a toluolban, ahol a pKa csak 40).
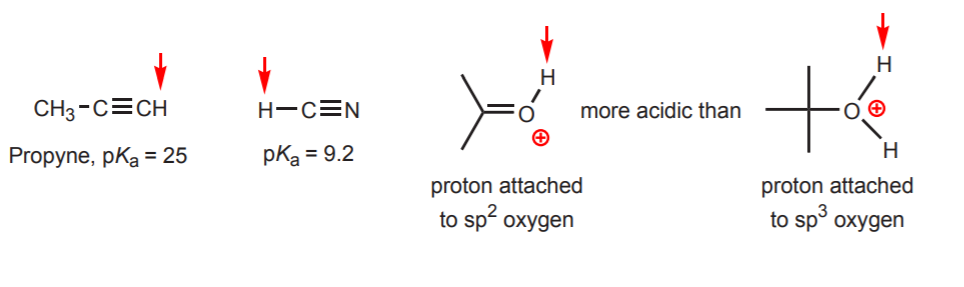
d) A hidrogén egy sp-hibridizált szénhez kapcsolódik. A hibridizáció savasságra gyakorolt hatásait a 9. fejezetben tárgyaljuk. A hibridizáció tendenciái a szén mellett az oxigénre és a nitrogénre is kiterjeszthetők, mint a jobb oldali példában.