14.1 Introducción a los neuropéptidos y al óxido nítrico
Los neurotransmisores clásicos (por ejemplo, el glutamato y la ACh) actúan mediante la transferencia direccional de información entre los sitios de liberación presinápticos y los grupos de receptores postsinápticos. El proceso suele estar bien organizado espacialmente, con un cierto «desbordamiento», aunque muy limitado, del transmisor entre sinapsis vecinas. La situación es bastante diferente para la transmisión mediada por neuropéptidos y óxido nítrico (NO). Estas moléculas ignoran la direccionalidad del flujo de información y en su lugar influyen en un volumen de área desde su punto de liberación. Esta característica es vagamente análoga a la liberación de hormonas peptídicas en el torrente sanguíneo, que pueden ser transportadas a sitios distantes para producir sus efectos. Por ejemplo, el NO puede producirse en una neurona postsináptica y difundirse de vuelta a la neurona presináptica o a otras neuronas vecinas, afectando a la posterior liberación del transmisor. Esta propiedad se denomina transmisión retrógrada, ya que la señal viaja en la dirección opuesta (de post a pre) en comparación con la direccionalidad clásica de la neurotransmisión.
14.2 Neuropéptidos
Muchos neuropéptidos se describieron originalmente como hormonas (por ejemplo, la somatostatina y la colecistoquinina), aunque una vez caracterizados se encontraron posteriormente también en las neuronas del SNC. Los neuropéptidos suelen producir respuestas neuronales de inicio lento y larga duración (Figura 14.1), y todos los receptores de neuropéptidos caracterizados pertenecen a la clase GPCR (receptor acoplado a proteína G). A modo de comparación, la Figura 14.1 muestra las respuestas típicas producidas por la acción de un neurotransmisor clásico (glutamato) que actúa sobre un receptor ionotrópico y un neuropéptido. Un potencial de acción provocado en la neurona 1 (en verde), una neurona liberadora de glutamato, produce el EPSP rápido (5 mseg) típico de la transmisión sináptica mediada por el glutamato. Por el contrario, un potencial de acción provocado en la neurona 2 (en púrpura) que libera neuropéptidos produce un EPSP de inicio lento (5 segundos hasta el pico) y de larga duración (10 segundos). Estos EPSP lentos son típicos de las acciones de los neuropéptidos, ya que todos los receptores de neuropéptidos están acoplados a la proteína G.
Figura 14.1
Además, muchos neuropéptidos no producen un cambio electrofisiológico evidente en la neurona postsináptica. Por ejemplo, un potencial de acción en la neurona 3 (Figura 14.1; rosa) no produce ninguna respuesta en la neurona postsináptica aunque se pueda confirmar por otros medios que se han liberado neuropéptidos. Sin embargo, se han producido cambios en la neurona postsináptica como se revela en el ejemplo mostrado en los paneles etiquetados como «C». Si se mide primero la respuesta del glutamato (C1) estimulando la neurona 1, se observa una respuesta típica. La estimulación de la neurona 3 no produce ninguna respuesta (C2) como antes. Sin embargo, si se estimula de nuevo la neurona 1 después de la estimulación de la neurona 3, el EPSP medido en la neurona postsináptica aumenta (C3) (el EPSP original es la línea sólida y el EPSP tras la estimulación de la neurona 3 es la línea discontinua). Así, el neuropéptido liberado por la neurona 3 alteró la respuesta de la neurona postsináptica a otro neurotransmisor. Se dice que estos neuropéptidos son neuromoduladores ya que sus efectos son potenciar o deprimir los efectos de un segundo transmisor. Otros ejemplos de esta plasticidad heterosináptica se describen en el capítulo 7, parte 2.
14.3 Clasificación de los péptidos por familias
Los neuropéptidos pueden agruparse en familias basándose en las similitudes de sus secuencias de aminoácidos (Tablas I y II).
Tabla I
Familias de neuropéptidos
Aquiquininas: sustancia P, bombesina, sustancia
Insulinas: insulina, factores de crecimiento similares a la insulina
Somatostatinas: somatostatina, polipéptido pancreático
Gastrinas: gastrina, colecistoquinina
Opioides: opiocortinas, encefalinas, dinorfina
Por ejemplo, los opiáceos se agrupan como una familia debido a la secuencia idéntica de aminoácidos Tyr-Gly-Gly-Phe–(Tabla II) que se encuentra en el N-terminal de cada uno.
| Tabla II Familia de opiáceos-Identidad de secuencia en cursiva |
|
| Nombre | Secuencia de aminoácidos |
| Leu-enkephalin | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkephalin | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dinorfina | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosíntesis y regulación
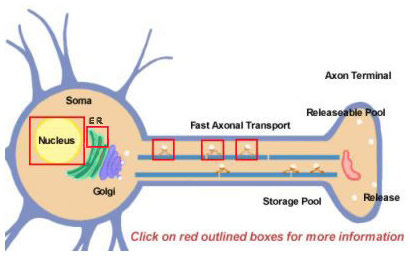
Figura 14.2
Los neuropéptidos se derivan de precursores más grandes mediante procesamiento proteolítico. Todos ellos se sintetizan inicialmente dentro del soma (Figura 14.2). Los precursores se forman inicialmente por traducción en polirribosomas unidos al retículo endoplásmico cerca del cuerpo celular. A partir de ahí, pasan por el aparato de Golgi, donde se producen nuevas modificaciones, incluida la glicosilación. A continuación, se empaquetan en gránulos secretores que se transportan a las terminales mediante un transporte axonal rápido. Sin embargo, rápido es un término relativo, debido a las distancias relativamente largas que deben recorrer algunos neuropéptidos. La reposición de la reserva de neuropéptidos liberables puede requerir muchas horas. Durante el transporte a la terminal nerviosa, las proteasas que se empaquetan dentro de la vesícula comienzan a escindir el neuropéptido precursor en su forma madura final. Este procesamiento es esencial para la activación de los neuropéptidos, ya que los precursores son biológicamente inactivos. Dentro de las vesículas se producen al menos tres tipos de procesamiento (Figura 14.2; haga clic en los recuadros para obtener más detalles). En primer lugar, una endopeptidasa escinde el precursor para generar dos nuevos productos (primer recuadro en el axón). En el caso de muchos precursores, este corte se produce después de los residuos básicos (como Lys y Arg) y lo llevan a cabo proteasas similares a la tripsina. A continuación, aunque no para todos los neuropéptidos, una carboxipeptidasa escinde los residuos básicos del C-terminal del nuevo péptido (Segunda caja en el axón). Finalmente, una tercera enzima convierte el grupo COOH (carboxi) de un residuo Gly, que se encuentra en el C-terminal de muchos neuropéptidos, en un grupo NH2 (amida) para producir la forma madura y activa del neuropéptido.
14.5 Se utilizan múltiples mecanismos para producir la diversidad de neuropéptidos
La mayoría de las proteínas se producen a partir de moléculas de ARNm que se empalman a partir de ARN precursores en sus formas finales en el núcleo. El empalme diferencial es una de las formas que utiliza una neurona para diversificar la producción de diferentes tipos de neuropéptidos. Un ejemplo bien conocido es el ARNm de la sustancia P, que normalmente también incluye un ARNm que codifica la sustancia K. La porción de la sustancia K del ARNm puede empalmarse diferencialmente para que el ARNm resultante pueda producir sólo la sustancia P (haga clic en el recuadro sobre el núcleo en la Figura 14.2)
Figura 14.3
Los neuropéptidos se producen a partir de una proteína precursora más larga mediante procesamiento proteolítico. Un excelente ejemplo es la familia de péptidos opioides (por ejemplo, el procesamiento de la proopiomelanocorticotropina, la POMC y la encefalina; véase la figura 14.3). Como se ha señalado, el procesamiento proteolítico tiene lugar dentro de las vesículas de transporte y, en la mayoría de los casos, se produce la escisión del precursor en el lado N-terminal de los residuos básicos (arginina y lisina), aunque también se han identificado otros sitios de escisión. En algunos casos, como el de la proteína precursora de la Encefalina, hay múltiples copias del mismo péptido bioactivo final. La molécula precursora mostrada en la parte superior de la Figura 14.3 contiene seis copias de Met-encefalina (ME) y una copia de Leu-encefalina (LE).
Así pues, la diversidad puede generarse alterando la secuencia de los sitios de corte por empalme diferencial, produciendo y/o empaquetando diferentes proteasas (que reconocen diferentes secuencias para el corte) en las vesículas de transporte, u ocultando un sitio proteolítico mediante modificaciones postraduccionales. Un ejemplo de esto último es que un sitio de escisión específico podría estar oculto por la adición de una cadena lateral de carbohidratos que bloquea estéricamente el acceso de la proteasa a ese sitio. Otro hallazgo común es que una sola molécula precursora contendrá varios neuropéptidos diferentes (véase la figura 14.3) y, por tanto, los tipos de procesamiento que se producen determinan en última instancia qué neuropéptido es liberado por la neurona. La proteína precursora de la POMC se puede escindir para formar ACTH (naranja) y β-lipoproteína (azul claro), cada una de las cuales se puede volver a escindir para generar otros neuropéptidos bioactivos (Figura 14.3). Por ejemplo, la β-lipoproteína (azul claro) puede ser escindida posteriormente en γ-lipoproteína (rayas verdes) y β-endorfina (azul oscuro). Una vez más, dependiendo del procesamiento que tenga lugar, la misma proteína precursora puede ser modificada para producir neuropéptidos con respuestas biológicas dramáticamente diferentes.
14.6 Liberación
Figura 14.4
Los péptidos son liberados por exocitosis dependiente de calcio con algunas diferencias importantes respecto a la liberación de neurotransmisores clásicos. Normalmente, las vesículas que liberan neuropéptidos son mucho más grandes que las que contienen neurotransmisores de moléculas pequeñas (por ejemplo, glutamato) y no requieren una especialización presináptica para su liberación (véase la micrografía electrónica de la figura 14.4). En contraste con las pequeñas vesículas que contienen glutamato, las grandes vesículas no aparecen acopladas a la membrana. Esta observación es coherente con la idea de que los neurotransmisores de moléculas pequeñas producen efectos breves y locales (en las conexiones sinápticas), mientras que los neuropéptidos producen efectos lentos y duraderos que a menudo abarcan una zona importante alrededor del lugar de liberación. Además, hay que recordar que, dado que los neuropéptidos se sintetizan en el soma de la célula y no localmente en la sinapsis, si su suministro se agota debido a la liberación sostenida, puede tardar varias horas en reponer las reservas liberables. Por ejemplo, una motoneurona, con su cuerpo celular en la médula espinal y la sinapsis en el pie, tiene un axón de hasta un metro de largo. Utilizando un transporte axonal rápido, un neuropéptido recién sintetizado podría tardar más de un día en llegar a esta sinapsis desde el soma. También debería ser evidente que los neuropéptidos endógenos que eliminan el dolor, como la beta-endorfina, podrían «agotarse» en momentos de estimulación persistente, lo que llevaría a situaciones en las que el dolor ya no puede ser controlado por mecanismos endógenos.
Una neurona típica madura suele liberar un neurotransmisor de molécula pequeña y uno o más neuropéptidos (como en el ejemplo de la figura 14.4). Si se libera más de un neuropéptido, la mayoría de las veces proceden de la misma molécula precursora. Un ejemplo es la liberación conjunta de ACh y del péptido relacionado con el gen de la calcitonina en las neuronas motoras espinales. El CGRP activa la adenilato ciclasa, aumentando los niveles de AMPc, y potencia la fuerza de contracción producida por la activación del receptor nicotínico de ACh. En este caso, el neuropéptido es modulador como se describe en la figura 14.1. Sin embargo, en este caso, el efecto potencia la contracción muscular en lugar de aumentar la magnitud del EPSP. En ambos ejemplos, la respuesta potenciada se debe a una mayor sensibilidad del sistema a una cantidad constante de neurotransmisor liberado.
14.6 Terminación de la acción
Los neuropéptidos se eliminan lentamente del espacio extracelular; una característica que también contribuye a sus efectos relativamente duraderos. La inactivación se produce tanto por difusión como por descomposición por parte de las proteasas extracelulares. No se han encontrado pruebas de que la recaptación del péptido sea un medio para terminar su acción.
14.7 Los receptores están todos vinculados a la proteína G
Todos los receptores de neuropéptidos conocidos producen sus efectos alterando los niveles de segundos mensajeros intracelulares. Estos receptores son siete proteínas que abarcan toda la transmembrana y que están unidas a través de proteínas G (GPCRs) para alterar la activación de otras enzimas celulares. Esta propiedad es coherente con la inducción de una respuesta más lenta por parte de los neuropéptidos y es muy adecuada para una función moduladora. Una distinción importante entre los transmisores de moléculas pequeñas y los neuropéptidos es que los receptores de los neuropéptidos tienen una gran afinidad de unión (nanomolar), a diferencia de las afinidades micro o milimolares medidas para los neurotransmisores de moléculas pequeñas (como el glutamato). Como los neuropéptidos no se liberan direccionalmente en el volumen confinado de una sinapsis, sus concentraciones no alcanzan niveles muy altos y los receptores deben tener entonces afinidades altas para reaccionar a estas pequeñas concentraciones. Esta alta afinidad retrasa la disociación del neuropéptido de su receptor y también contribuye a los efectos persistentes de estas moléculas.
14.8 Óxido nítrico (NO)
El óxido nítrico ha ganado una amplia atención como miembro fundador de una nueva clase de moléculas mensajeras gaseosas. El NO es la molécula activa que produce la nitroglicerina sublingual para aumentar la vasodilatación en el alivio de la angina de pecho. Actualmente se reconocen otros efectos biológicos importantes del NO. Por ejemplo, en el sistema nervioso, el NO es importante en la regulación del flujo sanguíneo cerebral, en la modulación de la neurotransmisión y en la toxicidad asociada a diversos estados patológicos.
14.9 Características del NO
Resumen de las propiedades del NO
- Gas que difunde libremente a través de las membranas
- De vida corta con una semivida medida en segundos
- .vida media medida en segundos
- Radical libre altamente reactivo
- Tóxico en altas concentraciones
El NO es un gas de vida corta que no debe confundirse con el gas anestésico relativamente estable óxido nitroso (gas de la risa). El NO es en realidad un radical libre y, por tanto, un compuesto altamente reactivo. Algunos de sus efectos tóxicos se deben probablemente a que el NO reacciona con el superóxido para producir el destructivo radical peroxinitrato. El NO se considera un neurotransmisor no convencional porque no se libera por exocitosis y su acción no se produce a través de moléculas receptoras convencionales.
Como se ha mencionado anteriormente, la descripción típica de la comunicación neuronal considera que la transmisión es unidireccional. Se libera un neurotransmisor presináptico que produce cambios en la neurona postsináptica. Varios compuestos (como los neuropéptidos y el NO) producidos en las neuronas postsinápticas se difunden en el entorno local y afectan a las células circundantes. Dado que el NO es un gas de libre difusión, tiene el potencial de viajar rápidamente en cualquier dirección desde su punto de producción. Por ejemplo, si se produce en una célula postsináptica debido a la estimulación del receptor de glutamato, el NO podría liberarse en el entorno local y enviar una señal de vuelta a la neurona presináptica (Figura 14.5). Este tipo de actividad se denomina señalización retrógrada, ya que la señal viaja en dirección retrógrada desde la neurona postsináptica a la presináptica.
Figura 14.5
Figura 14.6
Las figuras 14.5, 14.6 y 14.7 resumen los principales aspectos de la síntesis de NO. En este ejemplo, se libera glutamato desde la terminal presináptica que se une a los receptores NMDA de la membrana postsináptica, provocando su apertura y permitiendo el flujo de Ca2+. El Ca2+ activa la calmodulina, que se une a la enzima óxido nítrico sintasa (NOS) y la activa. Utilizando arginina como sustrato, la NOS produce NO y un segundo producto de reacción, la citrulina. El NO queda entonces libre para difundirse en el entorno e interactuar con la terminal presináptica que inicialmente liberó el glutamato o con cualquier otra célula del entorno local. Reconocer que cualquier proceso que eleve el Ca2+ intracelular activará potencialmente la NOS. La activación por glutamato de los receptores NMDA es sólo un ejemplo bien documentado.
Figura 14.7
14.10 Síntesis por la óxido nítrico sintasa (NOS) y liberación
El NO es producido por la enzima óxido nítrico sintasa (NOS). Esta enzima se encuentra en una subpoblación de neuronas (1-2% de las neuronas en la corteza) y se encuentra en la mayoría de las células endoteliales. Al menos una forma de NOS en estas células depende del calcio y de la calmodulina para su activación, como se indica en las figuras 14.5, 14.6 y 14.7. También contiene cofactores similares al citocromo P-450. Estos cofactores son NADPH (nicotinamida adenina dinucleótido fosfato, FAD (flavina adenina mononucleótido) y FMN (flavina mononucleótido). Estos cofactores son esenciales para la transferencia de electrones que produce el producto inestable y de corta duración NO. El sustrato de esta reacción es el aminoácido común arginina y los productos son la citrulina y el NO (Figura 14.5). Debido a la corta vida del NO, es extraordinariamente difícil medirlo directamente. Sin embargo, en preparaciones experimentales, existe una excelente correlación entre la aplicación de NMDA, que aumenta el Ca2+ intraneuronal y activa la NOS, con la producción del producto adicional de la actividad enzimática de la NOS, la citrulina (véase la figura 14.8). La producción de citrulina es un indicador fiable de la producción de NO. También es posible bloquear la producción de citrulina (y de NO) alimentando a las células con el sustrato no metabolizable para la NOS denominado metil arginina (Figura 14.9), y tales compuestos se han utilizado para reducir la producción de NO y poner fin a sus efectos biológicos.
|
Figura 14.8 |
Figura 14.9 |
14.11 «Receptores» del NO
Figura 14.10
Una de las principales dianas del NO parece ser la enzima guanil ciclasa. Este descubrimiento se realizó de forma indirecta mediante el control de la acumulación del producto de la NOS, la citrulina, al tiempo que se controlaba la producción de GMPc, el producto de la enzima guanilil ciclasa (Figuras 14.8 y 14.9). En este experimento se añadió NMDA a una preparación neuronal para activar la NOS. La NOS utiliza la arginina como sustrato para producir NO y, como se ha mencionado, si se añade al sistema un análogo no hidrolizable como la metil-arginina, se comprobó que la acumulación de citrulina y de GMPc terminaba de la misma forma dependiente de la dosis. Estas fuertes correlaciones condujeron al descubrimiento de que la guanilil ciclasa es un objetivo principal del NO.
La guanilil ciclasa es una enzima inusual porque tiene un anillo hemo con una molécula de hierro asociada como parte de su estructura. El NO activa esta enzima uniéndose al hierro en el hemo, iniciando la producción de GMP cíclico a partir de GTP (Figura 14.10) a través de cambios conformacionales en la enzima. El GMPc activa entonces una proteína quinasa dependiente de GMPc y otras enzimas descritas a continuación. El espectro de efectos producidos por la activación de la proteína cinasa dependiente de GMPc sólo se está comprendiendo ahora.
14.12 Efectos biológicos del NO
El NO produce una gran variedad de efectos biológicos. Desgraciadamente, desconocemos especialmente el papel del NO en la modulación de los procesos celulares en el sistema nervioso. El papel del NO en la regulación de la vasculatura está bien documentado y parece desempeñar un papel igualmente importante en el sistema nervioso.
14.13 Vasodilatador
Figura 14.11
Haga clic aquí para ver una vista ampliada de esta imagen.
En circunstancias normales, el NO contribuye al control del flujo sanguíneo a través de la cerebrovasculatura. Existe necesariamente un mecanismo de retroalimentación rápida para suministrar a las zonas más activas del cerebro los nutrientes necesarios. Este mecanismo es necesario debido a la escasa reserva de energía del cerebro. El NO se produce en las neuronas que contienen NOS y que están sometidas a una actividad sostenida. Estas condiciones favorecen la activación de los receptores NMDA, que se sabe que provocan la producción de NO. El NO se difunde desde estas áreas localizadas de alta actividad neuronal a la microvasculatura circundante (Figura 14.11), provocando vasodilatación y aumento del flujo sanguíneo.
Aunque los mecanismos exactos por los que el NO produce vasodilatación aún no están definidos, se sabe que la activación de la proteína quinasa dependiente de GMPc en las células musculares lisas provoca una relajación de los vasos. Dado que una de las principales dianas del NO es la guanilil ciclasa (que produce GMPc y activa la proteína cinasa dependiente de GMPc), se supone que una de las principales vías de acción vasodilatadora del NO es la proteína cinasa dependiente de GMPc. La activación de esta cinasa conduce indirectamente a la disminución de los niveles de Ca2+ en las células musculares lisas y, posteriormente, a la desfosforilación del aparato contráctil de la miosina, lo que provoca la relajación (Figura 14.12). En las células musculares lisas, el NO también parece hiperpolarizar directamente las células, posiblemente mediante la activación de los canales de K+, lo que conduce al cierre secundario de los canales de Ca2+, que también produce la relajación muscular. En conclusión, una de las principales funciones del NO parece ser la de integrar el nivel de actividad neuronal con las alteraciones locales del flujo sanguíneo cerebral para mantener una perfusión adecuada del tejido metabólicamente activo.
Figura 14.12
14.14 Neuromodulador
Se cree que el NO también actúa como mensajero localmente difusible. Se produce por cualquier acción que eleve el Ca2+ en las células que contienen NOS, como la estimulación por glutamato de los receptores NMDA. Mediante la posterior activación de la guanilil ciclasa y la producción de GMPc, la producción de NO influye en diversos procesos secundarios. Estos incluyen la modulación directa de los canales iónicos, la estimulación de la proteína quinasa dependiente del GMPc y la regulación al alza o a la baja de la cAMP-fosfodiesterasa. Los efectos descendentes son numerosos e incluyen la regulación ascendente y descendente de los canales de Ca2+, el aumento de la excitabilidad (aumenta la velocidad de disparo neuronal), el aumento o la disminución de la liberación de neurotransmisores y los cambios en la morfología de las neuronas.
14.15 Toxicidad
El NO en exceso es tóxico para las células. Sin embargo, existe una paradoja para la toxicidad del NO. Las células que producen altos niveles de NO son resistentes a sus efectos tóxicos. Por ejemplo, los macrófagos y los neutrófilos utilizan la toxicidad del NO como mecanismo para eliminar células tumorales y bacterias. Sin embargo, ninguno de los dos tipos de células que producen NO es susceptible a sus efectos dañinos. Este hallazgo también es válido para las neuronas del sistema nervioso central. El exceso de glutamato induce la neurotoxicidad en el cerebro y se cree que es la causa principal de la muerte neuronal en enfermedades como la de Huntington o la de Alzheimer o tras un accidente cerebrovascular o un traumatismo agudo. Se cree que la producción excesiva de NO desempeña algún papel en esta pérdida neuronal debido a su toxicidad cuando se produce en exceso. Curiosamente, las células que se tiñen de forma positiva para la enzima NOS se conservan en las zonas de degeneración del cerebro afectadas por estas enfermedades. La resistencia de estas células parece ser similar a la de las células inmunitarias descritas anteriormente.
Prueba tus conocimientos
- Pregunta 1
- A
- B
- C
- D
- E
Los neuropéptidos están presentes en las terminales sinápticas porque son:
A. Sintetizados en la terminal.
B. Llevados por transporte axonal rápido
C. Transportada por difusión
D. Llevado por transporte axonal lento
E. Tomados del espacio extracelular
Los neuropéptidos están presentes en las terminales sinápticas porque son:
A. Sintetizados en la terminal. Esta respuesta es INCORRECTA.
La maquinaria sintética necesaria para la síntesis de péptidos y proteínas no se encuentra en la terminal del axón.B. Llevado por transporte axonal rápido
C. Transportado por difusión
D. Llevado por transporte axonal lento
E. Tomados del espacio extracelular
Los neuropéptidos están presentes en las terminales sinápticas porque son:
A. Sintetizados en la terminal.
B. Llevados por transporte axonal rápido ¡Esta respuesta es CORRECTA!
Los neuropéptidos se sintetizan en el cuerpo celular y se procesan en vesículas que son transportadas a las terminales de los axones a lo largo de los microtúbulos mediante el transporte axonal rápido.C. Transportadas por difusión
D. Llevado por transporte axonal lento
E. Tomados del espacio extracelular
Los neuropéptidos están presentes en las terminales sinápticas porque son:
A. Sintetizados en la terminal.
B. Llevados por transporte axonal rápido
C. Transportado por difusión Esta respuesta es INCORRECTA.
Además, la difusión es un mecanismo excelente para mover moléculas a distancias cortas (unas pocas micras) pero es ineficiente para mover moléculas a distancias que suelen separar el soma neuronal de las terminales del axón.D. Llevado por transporte axonal lento
E. Tomados del espacio extracelular
Los neuropéptidos están presentes en las terminales sinápticas porque son:
A. Sintetizados en la terminal.
B. Llevados por transporte axonal rápido
C. Transportado por difusión
D. Llevado por transporte axonal lento Esta respuesta es INCORRECTA.
Además, es importante reponer lo más rápidamente posible el suministro de neuropéptidos a las terminales. En este caso, más rápido es mejor.E. Tomados del espacio extracelular
Los neuropéptidos están presentes en las terminales sinápticas porque son:
A. Sintetizados en la terminal.
B. Llevados por transporte axonal rápido
C. Transportado por difusión
D. Transporte axonal lento
E. Captado desde el espacio extracelular Esta respuesta es INCORRECTA.
No se conoce ningún mecanismo de captación para eliminar los neuropéptidos del espacio extracelular. Su mecanismo de acción se termina por difusión y por degradación enzimática por proteasas extracelulares.
- Pregunta 2
- A
- B
- C
- D
- E
A. Tiene una larga vida
B. Es permeable a la membrana
C. No es reactivo
D. También se conoce como gas de la risa.
E. No es tóxico para las células.
Oxido nítrico:
A. Tiene una vida larga Esta respuesta es INCORRECTA.
NO tiene una vida media medida en segundos y es muy inestable.B. Es permeable a la membrana.
C. No es reactivo
D. También se conoce como gas de la risa.
E. No es tóxico para las células.
Oxido nítrico:
A. Tiene una larga vida
B. Es permeable a la membrana. Esta respuesta es CORRECTA
NO es libremente permeable a las membranas y afecta a todas las células en un radio determinado desde su punto de producción.C. No es reactivo
D. También se conoce como gas de la risa.
E. No es tóxico para las células.
Oxido nítrico:
A. Tiene una larga vida
B. Es permeable a la membrana.
C. No es reactivo Esta respuesta es INCORRECTA.
El NO es un radical libre altamente reactivo. Reaccionará con proteínas, lípidos y ácido nucleico y tiene una afinidad particularmente alta por los metales reducidos (como el Fe2+ en el grupo hemo de la guanilil ciclasa).D. También se conoce como gas de la risa.
E. No es tóxico para las células.
Oxido nítrico:
A. Tiene una larga vida
B. Es permeable a las membranas
C. No es reactivo
D. Es también conocido como gas de la risa. Esta respuesta es INCORRECTA.
El gas de la risa es óxido nitroso y no óxido nítrico. No es reactivo y no es tóxico pero sí afecta a las propiedades de las membranas.E. No es tóxico para las células.
Oxido nítrico:
A. Tiene una larga vida
B. Es permeable a las membranas
C. No es reactivo
D. También se conoce como gas de la risa.
E. No es tóxico para las células. Esta respuesta es INCORRECTA.
El NO es altamente tóxico para las células cuando se produce en exceso. De hecho, se cree que la sobreproducción de NO causa ciertas enfermedades neurodegenerativas. El NO también es producido por los macrófagos como producto tóxico para eliminar las bacterias invasoras.