Los receptores tipo Toll son proteínas de detección microbiana que reconocen una amplia gama de patógenos, son una proteína crítica en la protección inicial contra la infección; generando una respuesta inmediata aunque relativamente inespecífica. Esta minirrevista destaca el papel que desempeñan los TLR en la inmunidad innata, incluyendo información sobre las vías de señalización de los TLR y las moléculas asociadas a ellas.
Vea nuestra gama completa de anticuerpos contra TLR

Mini-revisión de los receptores similares a los molares (TLR)
Descargar como PDF
Los TLR y la inmunidad innata
Los receptores similares a los molares (TLR) son componentes esenciales de la respuesta inmunitaria innata y, por tanto, uno de los factores clave que intervienen en el reconocimiento y la defensa contra los patógenos invasores. Son receptores transmembrana que pueden localizarse tanto en la superficie celular como en vesículas endosomales. Pertenecen a la familia de los receptores de reconocimiento de patrones (PRR) junto con los receptores de manosa (CD206), NOD y NALP. Dado que están implicados en la identificación de lo propio y lo ajeno, también se cree que están implicados en las enfermedades autoinmunes.
Los receptores tipo Toll constituyen una familia de proteínas esenciales para el sistema inmunitario innato que se conserva desde las plantas hasta los mamíferos.
En 1996 y 1997, Lamaitre y sus colegas demostraron que el gen Toll, un regulador dorsoventral del desarrollo de Drosophila, también estaba implicado en la respuesta inmunitaria innata a los hongos y a las bacterias grampositivas (1, 2). Este papel era coherente con la similitud estructural del dominio intracelular de Toll con el receptor de la interleucina-1B.
Casi al mismo tiempo, el grupo de Janeway clonó uno de los homólogos de mamíferos de Drosophila Toll, más tarde denominado receptor similar a Toll 4 (TLR4). Observaron que una forma activa dominante de TLR4 era capaz de estimular NFkB y genes inflamatorios dependientes de NFkB, y que TLR4 induce la expresión de CD80 (3).
La expresión de la molécula coestimuladora CD80 es necesaria para la activación de los linfocitos T ingenuos, y su inducción por TLR4 fue la primera prueba de que el sistema inmunitario innato podría participar en la polarización de los linfocitos T ingenuos y activar la inmunidad adaptativa (3).
Genes TLR y su expresión
Hasta ahora se han identificado 11 genes TLR en humanos, y 13 en ratones. Pueden dividirse en clases basadas en su función y secuencia. Aunque todos son proteínas de membrana, algunos TLR se localizan en vesículas intracelulares.
Aunque la expresión de los TLR es muy amplia, con varios tejidos que expresan más de un tipo de TLR, el mayor nivel de expresión y la mayor variedad de TLR se encuentra en los tejidos implicados en la inmunidad innata (4).
Moléculas asociadas a los TLR
El dominio intracelular de los TLR se denomina Toll/IL-1 (TIR), debido a las similitudes con el receptor de IL-1, mientras que la parte extracelular contiene un dominio de repetición rica en leucina (LRR). Se sabe que el TIR participa en la transducción de la señal, mientras que se cree que el LRR reconoce directamente el ligando correspondiente.
Al unirse el ligando, los TLR se dimerizan o se asocian con otros receptores. El dominio TIR interactúa con otras proteínas intracelulares que contienen TIR.
Se han descrito cuatro proteínas adaptadoras intracelulares que contienen un dominio TIR:
- MyD88
- TRIF (o TICAM-1)
- TIRAP (o MAL)
- TICAM-2 (o TRAM)
MyD88 y TRIF definen dos vías de señalización independientes, mientras que MAL y TICAM actúan como moléculas puente.
Vía de señalización de TLR
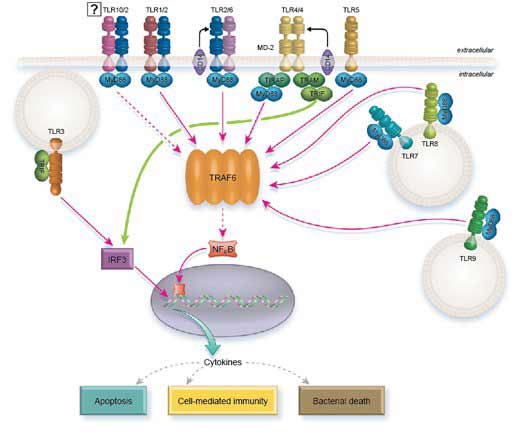
Señalización de TLR
Todos los TLR, excepto TLR3, pueden señalar a través de MyD88. Sin embargo, TLR2 y TLR4 requieren TIRAP para reclutar a MyD88. A su vez, MyD88 recluta a IRAK1 e IRAK4 que se disocian de MyD88 tras su fosforilación. A continuación, IRAK1 e IRAK4 interactúan con TRAF6 que, a su vez, activa la vía NFkB, AP1 e IRF5, estimulando en última instancia la transcripción de citoquinas inflamatorias.
Para completar esta tarea, TRAF6 fosforila directamente a IRF5, al tiempo que activa AP1 a través de MAP quinasas. La liberación de NFkB de su inhibidor IKB requiere el reclutamiento de las proteínas TAK1 y TAB de TRAF6 que actúan sobre la quinasa IKB (IKKa/IKKB/NEMO).
TLR7, TLR8 y TLR9 inducen la señalización de IFN tipo I a través de MyD88. En este caso se cree que MyD88 activa directamente a IRF1 e indirectamente a IRF7 a través de la interacción de TRAF6 con TRAF3.
En lugar de actuar a través de MyD88, TLR3 señala a través de TRIF. Sin embargo, la vía acaba activando los mismos efectores: NFkB, AP1, IRF3 e IRF7.
TLR4 es único porque utiliza tanto MyD88 como TRIF como moléculas adaptadoras intracelulares. También requiere la molécula puente TRAM para reclutar a TRIF y TIRAP para reclutar a MyD88.
Interesantemente, parece que TLR4 utiliza ambas vías secuencialmente y no desde el mismo compartimento (5). Cuando TLR4 se une a LPS, TIRAP es reclutado y a su vez recluta la señalización de MyD88 desde la membrana plasmática para activar la transcripción de citoquinas. El LPS también promueve la internalización del TLR4 a través de la endocitosis, un evento que desactiva la señalización de MyD88. En este punto, el TLR4 internalizado sigue señalando desde el compartimento del endolisosoma, pero ahora actúa a través de TRAM/TRIF y conduce a la transcripción de los genes del interferón.
Para más información sobre los receptores de reconocimiento de patrones, incluidos los TLR, visite nuestra página web de receptores de reconocimiento de patrones y revise la gama de anticuerpos disponibles.
- Lemaitre, B. et al. (1996) El casete génico regulador dorsoventral spätzle/Toll/cactus controla la potente respuesta antifúngica en los adultos de Drosophila.
Cell. 86:973-83 - Lemaitre, B. et al. (1997) Drosophila host defense: differential induction of antimicrobial peptide genes after infection by various classes of microorganisms.
Proc Natl Acad Sci U S A. 94:14614-9 - Medzhitov, R. et al. (1997) A human homologue of the Drosophila Toll protein signals activation of adaptive immunity.
Nature. 388:394-7 - Zarember, K.A. y Godowski, P.J. (2002) Tissue expression of human Toll-like receptors and differential regulation of Toll-like receptor mRNAs in leukocytes in response to microbes, their products, and cytokines.
J. Immunol. 168:554-561 - Barton, G.M. y Kagan, J.C. (2009) A cell biological view of Toll-like receptor function: regulation through compartmentalization.
Nat Rev Immunol. 9:535-42
Lectura adicional
- Montero Vega, M.T. y De Andrés Martín, A. (2009) La importancia de los receptores tipo Toll en las enfermedades humanas.
Alergol Inmunopathol(Madr). 37:252-63 - Montero Vega, M.T. y De Andrés Martín, A. (2008) Receptores Toll-like: una familia de sensores innatos de peligro que alertan e impulsan la inmunidad.
Allergol Immunopathol(Madr). 36:347-57 - Uematsu, S. y Akira, S. (2008) Toll-Like receptors (TLRs) y sus ligandos.
Handb Exp Pharmacol. :1-20 - Bauer, S. et al. (2009) Pattern recognition by Toll-like receptors.
Adv Exp Med Biol. 653:15-34 - Schmidt M. et al (2010) Crucial role for human Toll-like receptor 4 in the development of contact allergy to nickel.
Nat Immunol. 2010 Aug 15.