Estructura, dinámica y función de las acuaporinas
 Ganador del 2004 Visualization Challenge in Science and Engineering,
Ganador del 2004 Visualization Challenge in Science and Engineering, Organizado por la National Science Foundation y Science Magazine. (Véase el artículo de Science relacionado.)
Nuestra película sobre la permeabilidad del agua y el premio Nobel de Química 2003
El arte del transporte de agua en las acuaporinas
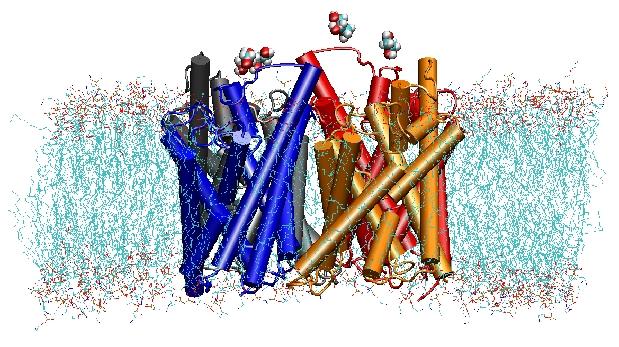
Las acuaporinas son canales de agua de membrana que desempeñan papeles críticos en el control del contenido de agua de las células. Estos canales están ampliamente distribuidos en todos los reinos de la vida, incluyendo bacterias, plantas y mamíferos. Se han encontrado más de diez acuaporinas diferentes en el cuerpo humano, y varias enfermedades, como las cataratas congénitas y la diabetes insípida nefrogénica, están relacionadas con el deterioro de la función de estos canales. Forman tetrámeros en la membrana celular y facilitan el transporte de agua y, en algunos casos, de otros pequeños solutos a través de la membrana. Sin embargo, los poros de agua son completamente impermeables a las especies cargadas, como los protones, una propiedad notable que es crítica para la conservación del potencial electroquímico de la membrana, pero paradójica al mismo tiempo, ya que los protones normalmente pueden ser transferidos fácilmente a través de las moléculas de agua. Los resultados de nuestras simulaciones han proporcionado una nueva visión del mecanismo subyacente a esta fascinante propiedad. Las moléculas de agua que pasan por el canal se ven obligadas, por las fuerzas electrostáticas de la proteína, a girar en el centro del canal (véase la animación), rompiendo así la disposición alternativa donante-aceptor que es necesaria para la translocación de protones (lea la historia completa en nuestro artículo de Science).

Implicación funcional de una arquitectura proteica peculiar
En el año 2000, el laboratorio de Stroud en la UCSF consiguió resolver la primera estructura de alta resolución de una acuaporina mediante cristalografía de rayos X. La estructura estudiada fue la del facilitador de la captación de E. coliglicerol (GlpF), que es una acuaporina, es decir, el canal es también permeable a pequeñas moléculas lineales de azúcar, como el glicerol. Las simulaciones de DM en nanosegundos del GlpF tetramérico en un parche hidratado de la bicapa lipídica POPE caracterizaron la vía completa de conducción del sustrato en el canal. El análisis de las interacciones de enlace de hidrógeno del sustrato con el interior del canal también explicó por primera vez por qué estos canales incorporan en su arquitectura dos bucles característicos, que incluyen elementos de estructura secundaria energéticamente desfavorables, que se conservan en toda la familia de acuaporinf (Jensenet al., Structure, 2001).
Energética de la Permeación del Azúcar
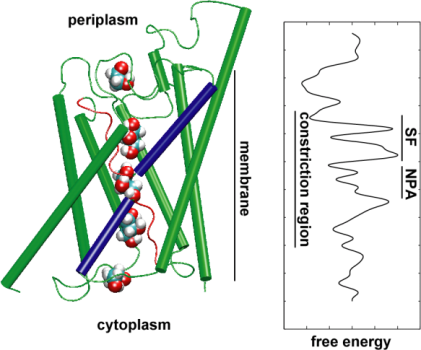
A continuación, exploramos la energía del evento de transporte para comprender qué barreras debe superar un sustrato durante su paso por el canal. Para describir el perfil de energía libre, calculamos el potencial de fuerza media para el evento de conducción completo a partir de las trayectorias en las que se aceleró el movimiento del glicerol a través del canal aplicando fuerzas externas. Esta técnica, conocida como dinámica molecular dirigida (SMD), permite observar eventos lentos dentro de la escala de tiempo accesible de las simulaciones MD. Sin embargo, debido a la naturaleza no equilibrada de las trayectorias, al analizar los resultados uno se enfrenta al problema del trabajo irreversible que tiene que ser contabilizado. Utilizando la identidad de Jarzinsky, la igualdad entre la energía libre y el trabajo en sistemas no equilibrados, pudimos describir completamente la energética del transporte de glicerol a través del canal. El potencial calculado de la fuerza media capta los principales sitios de unión y las barreras en el canal en estrecha concordancia con los resultados de las simulaciones MD de equilibrio y la estructura cristalina. Además, muestra una pronunciada asimetría en su forma, lo que sugiere que la estructura asimétrica de la proteína puede ser funcionalmente importante para una eficiente captación de moléculas nutritivas del entorno. (Jensen, etal., PNAS, 2002).
Qué hace que una acuaporina sea un canal de glicerol
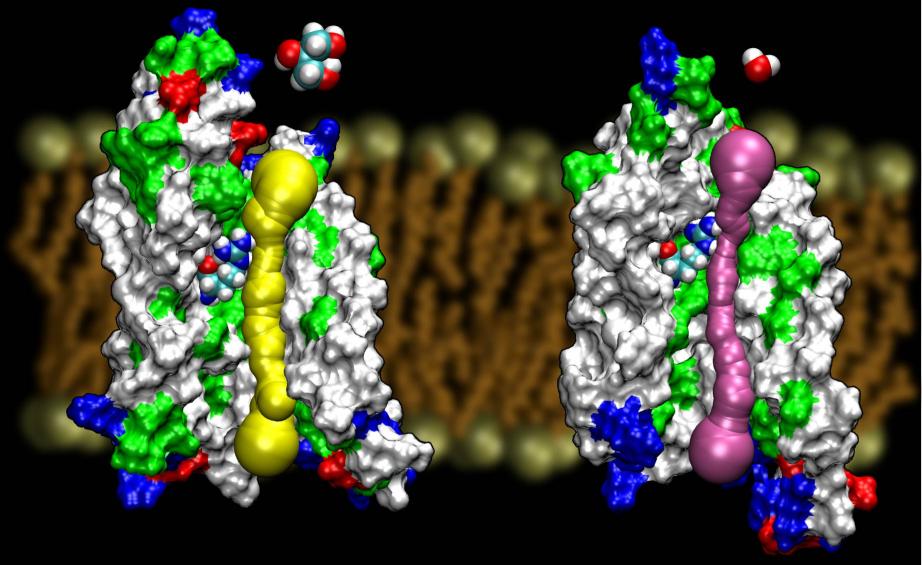
Las acuaporinas son una familia muy afortunada de proteínas de membrana, que son notoriamente resistentes a la determinación de su estructura. Tenemos estructuras de alta resolución de varias AQP: GlpF, AQP1, AQP0 yAqpZ. Se espera que pronto aparezcan más estructuras. La disponibilidad de la estructura de dos AQP de E. coli, una que es un canal de agua puro (AqpZ) y la otra que es un canal de glicerol (GlpF), nos ha proporcionado una oportunidad única para comprender los principios de selectividad empleados por la naturaleza al utilizar dos canales genética y estructuralmente muy homólogos para el tráfico de materiales diferentes en la membrana. De hecho, el poro es en general más estrecho que el de GlpF (véase la figura siguiente). Parece que la naturaleza ha recurrido a un mecanismo muy básico, el ajuste del tamaño del poro del canal, para hacer que dos proteínas de la misma familia presenten propiedades de conducción diferentes. Lea la historia completa en Wang, etal., STRUCTURE, 2005.
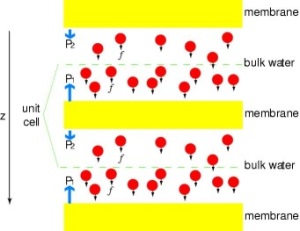
Poniendo los canales bajo presión
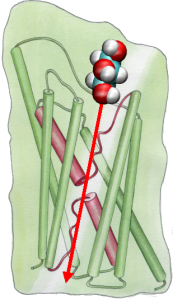
Con el fin de comparar directamente los resultados de las simulaciones MD con las mediciones bioquímicas de la conductividad de los canales de agua de la membrana, en los que se utilizan gradientes de presión osmótica para inducir el flujo de agua a través de la membrana, desarrollamos una nueva metodología para las simulaciones MD. Aplicando pequeñas fuerzas sobre las moléculas de agua en la región de la masa (véase la figura), se genera un gradiente de presión hidrostática a través de la membrana. El gradiente de presión induce tasas de conducción que pueden estudiarse con simulaciones MD, que normalmente se limitan a unos pocos nanosegundos. El método se ha aplicado en la simulación de la permeación del agua a través del GlpF, y ha dado como resultado una correlación lineal entre la presión aplicada y el flujo (Zhu et al., Biophys. J., 2002).
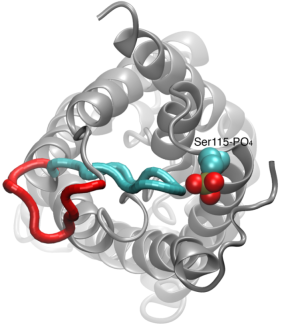
Permeabilización de los canales de agua
La permeabilidad del agua a través de las acuaporinas es un proceso pasivo que sigue la dirección de la presión osmótica a través de la membrana. Aunque muchas acuaporinas funcionan como canales siempre abiertos, un subgrupo de acuaporinas, sobre todo en las plantas, han desarrollado un sofisticado mecanismo molecular mediante el cual el canal puede cerrarse en respuesta a condiciones duras del entorno, bajo las cuales el intercambio de agua puede ser perjudicial para el organismo. Ejemplos de estas condiciones son el estrés por sequía y las inundaciones, que desencadenan ciertas señales celulares (desfosforilación y cambio de pH) que provocan el cierre del canal. Una estructura recientemente resuelta de una acuaporina de espinacas se simuló en diferentes condiciones para investigar el mecanismo molecular de cierre de estos canales de membrana. Se descubrió que un bucle citoplasmático alargado en las acuaporinas con capacidad de cierre ocluye físicamente la entrada del poro de agua en el canal cerrado y bloquea el acceso de las moléculas de agua al poro. El desplazamiento de este bucle en respuesta a la fosforilación, como se observa en las simulaciones, elimina el bucle de la entrada citoplasmática del poro. Además, un aminoácido hidrofóbico que está conformacionalmente acoplado a este bucle será retirado del canal como resultado del movimiento del bucle. En conjunto, estos acontecimientos moleculares dan lugar a un canal abierto que es permeable a las moléculas de agua. El estudio apareció en Nature2006.

Conexión y conductividad iónica del poro tetramérico
Los AQP son generalmente conocidos por su alta permeabilidad al agua. Sin embargo, se ha sugerido su implicación en otras funciones celulares, incluyendo la permeabilidad de pequeñas moléculas distintas del agua, así como la comunicación célula-célula. La tetramerización es una característica estructural común de las AQP. El hecho de que cada uno de los cuatro monómeros forme un poro de agua funcionalmente independiente, pero que requiera una organización tetramérica para su funcionamiento, sugiere un beneficio sinérgico de la oligomerización y, por tanto, obliga a seguir analizando el papel potencial del poro central en las AQP. Una propuesta interesante es la posible participación del poro central en la conducción de iones tras la activación del GMPc. Utilizando simulaciones MD de modelos incrustados en la membrana de AQP1, hemos investigado esta propiedad de AQP1, para determinar cómo, y bajo qué condiciones de conformación e hidratación, el poro central podría conducir y cómo se regula la conductividad. Nuestras simulaciones sugieren que uno de los bucles citoplasmáticos, el bucle D, rico en arginina, desempeña un papel clave en la activación del poro central mediada por el GMPc. El papel sugerido del bucle D fue verificadoexperimentalmente por un mutante diseñado del bucle D que mostraba una pérdida completa de conductividad iónica ( Yu et al.,Estructura, 2006 ) .
Las moléculas de gas entran en la célula
Cada mañana, muchas personas van al trabajo en coche, mientras que otras van en bicicleta, en autobús o en metro. Por ejemplo, para atravesar la membrana celular, las pequeñas moléculas de gas hidrofóbicas se difunden a través de la capa lipídica, mientras que las moléculas de agua pasan por las acuaporinas (AQP), Además de la difusión a través de los lípidos, el oxígeno y el dióxido de carbono también pueden atravesar las AQP. Sin embargo, las vías que siguen estas moléculas de gas siguen siendo difíciles de determinar. Los resultados de la simulación sugieren que, mientras que los poros cuatromonoméricos de AQP1 funcionan como canales de agua, el poro central de AQP1 puede servir como vía para que las moléculas de gas atraviesen la membrana (Wang et al., Journal of Structural Biology, 2007 ).
Carrera de obstáculos molecular
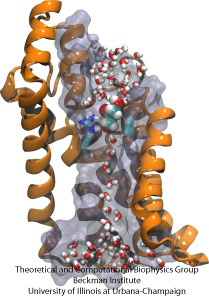
Las células biológicas protegen su interior a través de sus membranas celulares, pero dependen de la importación de nutrientes. Han evolucionado para esta importación canales de conducción rápidos que incluyen puntos de control fiables que distinguen compuestos deseables e indeseables. Un punto de control pone una verdadera carrera de obstáculos que sólo los compuestos adecuados pueden pasar rápidamente. Comprender el diseño del canal es difícil debido a la falta de datos experimentales detallados sobre la dinámica de los nutrientes. En la actualidad, la información más detallada procede de la visualización computacional de la dinámica del canal, a partir de estructuras cristalográficas estáticas. Un estudio reciente investigó cómo los gliceroles, pequeñas moléculas nutritivas que necesitan algunas bacterias, pasan por los puntos de control realizados a través del canal de glicerol GlpF. GlpF proporciona cuatro canales paralelos que fueron monitorizados computacionalmente utilizando NAMD y un novedoso algoritmo que explora la energética del canal con la suficiente rapidez como para ser metodológicamente factible en los ordenadores actuales. Los resultados muestran cómo las características físicas del glicerol, su capacidad para formar los llamados enlaces de hidrógeno, sus momentos dipolares eléctricos, su movilidad difusiva y su flexibilidad intrínseca se sondean a lo largo del canal (Henin et al, Biophysical Journal, en prensa ).
Nuestra investigación sobre acuaporinas en las noticias
|
Equipo Aquaporin
|
Publicaciones
-//W3C//DTD XHTML 1.0 Transitional//ES» «http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd»>Publications Base de datos Difusión del glicerol a través de la aquagliceroporina GlpF de Escherichia coli.Jerome Henin, Emad Tajkhorshid, Klaus Schulten y Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, and Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze y P. Kjellbom. Nature, 439:688-694, 2006. Qué hace que una acuaporina sea un canal de glicerol: A comparative study of AqpZ and GlpF.Yi Wang, Klaus Schulten, and Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetic theory and simulation of single-channel water transport.Emad Tajkhorshid, Fangqiang Zhu, and Klaus Schulten. En S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Países Bajos, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, and Klaus Schulten. En Boris Martinac y Andrzej Kubalski, editores, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Collective diffusion model for water permeation through microscopic channels.Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 páginas). Computational studies of membrane channels.Benoit Roux and Klaus Schulten. Structure, 12:1343-1351, 2004.