Diferencia principal – tensión estérica vs torsional
La tensión es la repulsión entre los electrones de enlace de una molécula. La disposición de una molécula depende de la tensión, ya que los pares de electrones de enlace se disponen de manera que se minimice la tensión. Hay tres tipos principales de tensiones que se pueden encontrar en una molécula. Son la tensión angular, la tensión torsional y la tensión estérica. La deformación angular se produce cuando los ángulos de enlace de las moléculas reales son diferentes a los de las moléculas ideales. La deformación torsional se produce cuando una molécula gira alrededor de un enlace. La tensión estérica se forma cuando dos o más grupos voluminosos se acercan entre sí. La principal diferencia entre la tensión estérica y la torsional es que la tensión estérica no puede reducirse girando la molécula alrededor de un enlace, mientras que la tensión torsional puede reducirse girando la molécula alrededor de un enlace.
Aspectos clave
1. Qué es la tensión estérica
– Definición, explicación con ejemplos
2. Qué es la tensión torsional
– Definición, explicación con ejemplos
3. Cuál es la diferencia entre la tensión estérica y la torsional
– Comparación de las diferencias clave
Términos clave: Tensión angular, par de electrones de enlace, tensión estérica, tensión torsional

Qué es la tensión estérica
La tensión estérica es la repulsión entre dos átomos o grupos de átomos cuando se disminuye la distancia entre ellos. También se denomina impedimento estérico. La tensión estérica es muy importante para determinar la disposición de una molécula, ya que todas y cada una de las moléculas se disponen de tal manera que la tensión estérica se minimiza. Cuando la tensión estérica se minimiza, la energía potencial de esa molécula disminuye. Como la materia es estable cuando tiene un nivel de energía más bajo, el nivel de energía más bajo de una molécula la convierte en una molécula estable.
El concepto de tensión estérica es muy importante para predecir los productos de una reacción química. Esto se debe a que los grupos de átomos se unen a un átomo de carbono de tal manera que el impedimento estérico se minimiza. Por lo tanto, una reacción química dará una mezcla de moléculas en la que se incluyen productos estables y productos inestables. Pero el componente mayoritario de esta mezcla será siempre el producto estable con un impedimento estérico minimizado.

Figura 1: Tensión estérica en compuestos orgánicos
Como se muestra en la imagen anterior, la energía potencial de una molécula se incrementa en función de la tensión estérica que tengan. Cuando la distancia entre dos grupos metilo disminuye, la energía potencial aumenta.
Figura 2: La tensión estérica aumenta cuando hay grupos voluminosos
La imagen anterior muestra que la tensión estérica aumenta cuando hay grupos voluminosos. Las moléculas con más obstáculos estéricos tienen una mayor energía potencial en comparación con las moléculas con menos obstáculos estéricos. Por lo tanto, las moléculas con menos impedimentos estéricos son más estables.
Qué es la tensión torsional
La tensión torsional es la repulsión que surge entre átomos o grupos de átomos cuando una molécula gira alrededor de un enlace sigma. Es la repulsión que se observa cuando los electrones del enlace pasan unos al lado de otros. Este tipo de tensión es importante para determinar las conformaciones estables de los compuestos orgánicos. Estas conformaciones pueden representarse mediante proyecciones de Newman. La proyección de Newman de una molécula es la conformación de esa molécula cuando se mira a través del enlace C-C desde la dirección frontal-posterior.
La deformación torsional surge cuando el ángulo diedro de los grupos voluminosos es bajo. El ángulo diedro es el ángulo entre dos enlaces de dos átomos de carbono diferentes en una proyección de Newman. Si el ángulo diedro es alto, entonces la tensión torsional es baja.
Las proyecciones de Newman pueden encontrarse en dos tipos como conformación escalonada y conformación eclipsada. La conformación eclipsada muestra una alta tensión torsional que la de la conformación escalonada.
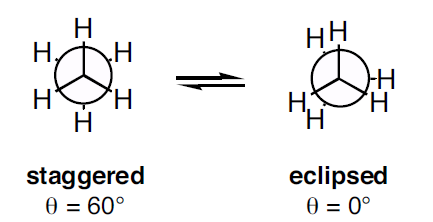
Figura 3: Dos tipos de proyección de Newman
Como se muestra en la imagen anterior, la conformación escalonada muestra un ángulo diedro de 60o y la conformación eclipsada muestra un ángulo diedro de 0o. Pero cuando la molécula se gira, la conformación cambia. La tensión torsional en la conformación escalonada es menor que la de la conformación eclipsada. Cuando la molécula se rota, la conformación eclipsada puede convertirse en la conformación escalonada; por lo tanto, la tensión torsional se reduce.
Diferencia entre tensión estérica y torsional
Definición
Tensión estérica: La tensión estérica es la repulsión entre dos átomos o grupos de átomos cuando se disminuye la distancia entre ellos.
Tensión torsional: La tensión torsional es la repulsión que surge entre átomos o grupos de átomos cuando una molécula gira alrededor de un enlace sigma.
Rotación de la molécula
Tensión estérica: La tensión estérica no puede reducirse girando la molécula alrededor de un enlace sigma.
Tensión de torsión: La tensión torsional puede reducirse girando la molécula alrededor de un enlace sigma.
Causa de la tensión
Tensión estérica: La deformación estérica se produce cuando disminuye la distancia entre los grupos voluminosos de una molécula.
Distensión torsional: La deformación torsional se produce cuando los electrones de enlace pasan unos al lado de otros cuando la molécula está girando.
Conclusión
La deformación de una molécula es la repulsión entre los electrones de enlace o pares de electrones solitarios presentes en dicha molécula. Esta repulsión hace que la energía potencial de una molécula aumente. Entonces, hace que la molécula sea inestable. La tensión estérica de una molécula está determinada por los grupos voluminosos presentes en una molécula y la distancia entre esos grupos voluminosos. La proyección de Newman es una estructura simple que muestra la disposición de los átomos o grupos de átomos en una molécula orgánica. Puede utilizarse para determinar la tensión torsional de una molécula. La principal diferencia entre la tensión estérica y la torsional es que la tensión estérica no puede disminuirse girando la molécula alrededor de un enlace mientras que la tensión torsional puede disminuirse girando la molécula alrededor de un enlace.
1. «Tensión torsional». OChemPal, Disponible aquí. Consultado el 28 de agosto de 2017.
2. «Strain (Chemistry)». Wikipedia, Fundación Wikimedia, 25 de julio de 2017, Disponible aquí. Consultado el 28 ago. 2017.
3. «Dihedral Angle». OChemPal, Disponible aquí. Consultado el 28 ago. 2017.
Imagen cortesía:
1. «Napthalene phenanthraene methyl-methyl strai» By DMacks – Own work (Public Domain) via Commons Wikimedia
2. «Steric hindrance disp» By Mwolf37 – Own work (CC BY-SA 3.0) via Commons Wikimedia
3. «Escalonada e eclipsada» By Pauloquimico – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()
.