INTRODUCCIÓN
La amiloidosis es una enfermedad de depósito causada por la acumulación extracelular de fibrillas cuyo origen consiste en proteínas con una estructura inestable que se pliegan, se agregan y sufren un depósito.1 Este depósito puede alterar la estructura de los tejidos y perjudicar la función de varios órganos y sistemas.2
Las fibrillas amiloides son insolubles y resistentes a la proteólisis y suelen teñirse con rojo Congo, mostrando una intensa birrefringencia amarillo-verde bajo luz polarizada.3 Más de 30 proteínas pueden causar depósitos amiloides, pero sólo 5 causan depósitos significativos en el tejido cardíaco1:
- –
Cadenas ligeras, que causan la amiloidosis primaria (AL).
- –
Transtiretina (TTR), que causa la amiloidosis TTR (ATTR).
- –
Apolipoproteína A.
- –
Fibrinógeno.
- –
Proteína amiloide A del suero, que produce la amiloidosis secundaria.
La amiloidosis primaria y la ATTR son las formas más comunes de amiloidosis cardíaca, considerándose históricamente que la forma AL es más común en los países desarrollados.3
La mayor parte de la información sobre la amiloidosis cardíaca se ha basado en la AL. Sin embargo, aunque el número de pacientes con AL ha permanecido estable, el número de diagnósticos de ATTR ha aumentado recientemente y ahora se piensa que la ATTR puede ser mucho más prevalente que la AL.2
La amiloidosis de transtiretina ha sido muy a menudo objeto de diagnósticos erróneos o de importantes retrasos hasta su diagnóstico correcto. Las razones incluyen la heterogeneidad de sus formas, la necesidad de confirmación histológica, la escasez de equipos especializados y la creencia errónea de algunos cardiólogos de que es una enfermedad rara sin opciones de tratamiento.2,3
Sin embargo, estos aspectos están cambiando. El diagnóstico tiene implicaciones para el manejo de los pacientes. Se han desarrollado terapias específicas que pueden retrasar o estabilizar el depósito y que son más eficaces en las fases iniciales. Por lo tanto, el diagnóstico precoz es crucial. En esta revisión se describen importantes avances recientes en el diagnóstico y el tratamiento de la ATTR, que ofrecen esperanza a los pacientes con esta enfermedad.
AMILOIDOSIS CARDÍATICA DE LA TRANSTIRETINA
La transtiretina es una proteína plasmática tetramérica responsable del transporte de tiroxina y de la proteína unida al retinol. Se sintetiza principalmente en el hígado y, de forma secundaria, en el plexo coroideo y en el epitelio pigmentario de la retina.4
La transtiretina tiende a disociarse en dímeros y monómeros, que se desensamblan en fibrillas y se depositan. Las mutaciones puntuales o el efecto de la edad pueden aumentar esta tendencia, dando lugar a las dos formas clínicas de ATTR: la mutante (ATTRm) y la de tipo salvaje (ATTRwt).
AMILOIDOSIS DE LA TRANSTRETINA MUTANTE
Actualmente se conocen más de 120 mutaciones que causan la ATTRm. Estas mutaciones presentan un patrón de herencia autosómico dominante, con penetrancia variable.4 Debido a su amplia diversidad geográfica, es difícil establecer la prevalencia de la ATTR, pero se considera una enfermedad rara con una prevalencia inferior a 1/100 000 habitantes2 (Tabla 1).
Principales características clínicas y diagnósticas de la transtiretina cardíaca mutante y de tipo salvaje.Tipo Transtiretina Amiloidosis Cardíaca
| ATTRwt | ATTRm | |
|---|---|---|
| Prevalencia | Desconocida. Aparentemente muy frecuente | |
| Estudio genético | Ausencia de mutaciones en TTR | Mutación en TTR |
| Edad típica de presentación | > 60 años | Variable según la mutación causante |
| Sexo | Predominio masculino. 80% pacientes | Predominio masculino, con fenotipo más agresivo |
| Manifestaciones extracardiacas | – Síndrome del túnel carpiano (33%-49%) – Estenosis espinal lumbar – Rotura traumática del tendón del bíceps (32%) |
– Polineuropatía sensomotora bilateral ascendente – Disautonomía: hipotensión ortostática, diarrea-estreñimiento, disfunción eréctil – Afectación ocular: glaucoma, deposición intravítrea, pupilas festoneadas |
| Deterioro cardíaco | Constante | Variable según la mutación causante |
| Salida cardíaca | – Insuficiencia cardíaca (53%-86%) – Trastornos de la conducción – FA (43%-67%) – EA degenerativa |
– Trastornos de la conducción – Insuficiencia cardíaca – FA infrecuente (10%) |
| Técnicas de diagnóstico | ||
| ECG | – Patrón de pseudoinfarto (63%-66%) – Bajo voltaje (22%-33%) – HVI de Sokolow (6%-13%) |
– Patrón de pseudoinfarto (18%-69%) – Bajo voltaje (2%-25%) – HVI de Sokolow (3%-8%) |
| ECHO | – Hipertrofia moderada-severa – FEVI deprimida leve-moderada (30%) |
– Hipertrofia moderada – FEVI típicamente conservada |
| RMN cardiaca | – Realce tardío – T1 y EV nativos elevados |
|
| Gammagrafía 99mTc DPD | – Grado 2-3 | – Grado 0: Portadores asintomáticos – Grado 1: afectación cardíaca inicial – Grado 2-3: afectación cardiaca significativa |
AF, fibrilación auricular; AoS, estenosis aórtica; ATTRm, amiloidosis de transtiretina mutante; ATTRwt, amiloidosis de transtiretina de tipo salvaje; ECG: electrocardiograma; ECO: ecocardiograma; EV: volumen extracelular; FEVI: fracción de eyección del ventrículo izquierdo; HVI: hipertrofia del ventrículo izquierdo; TTR: transtiretina.
Las primeras mutaciones de TTR se comunicaron como polineuropatía amiloide familiar (o enfermedad de Andrade) y, por consiguiente, la ATTRm se ha considerado hasta hace poco una enfermedad neurológica. Sin embargo, descubrimientos recientes muestran una afectación cardíaca en más de la mitad de los casos.3
Existe una fuerte correlación genotipo-fenotipo, asociándose las mutaciones con enfermedad puramente neurológica o puramente cardíaca.3 Sin embargo, la división de la ATTRm en enfermedad cardiaca o neurológica puede ser una simplificación excesiva, ya que existe un solapamiento considerable entre las 2 formas clínicas del espectro de la enfermedad.
La mutación Val30Met (ahora conocida como Val50Met después de que se añadieran 20 posiciones al nombre tradicional de la mutación en la ATTRm) es la mutación más frecuente en todo el mundo y es endémica en Portugal, Japón y Suecia. Su incidencia estimada en Portugal es de 1 por cada 538 habitantes.2 Mallorca (España) y Valverde del Camino (Huelva, España) también se consideran zonas en las que la ATTRm es endémica. La prevalencia estimada en Mallorca en pacientes sintomáticos es de 3/100 000 habitantes.5
La mutación Val30Met causa una afección predominantemente neurológica con polineuropatía sensomotora simétrica, que comienza en las extremidades inferiores y sigue un patrón ascendente. Puede asociarse a disautonomía con hipotensión ortostática, disfunción eréctil, incontinencia urinaria y síntomas gastrointestinales. Suele comenzar al final de la segunda o tercera década de la vida, y hasta el 43% de los pacientes tienen afectación cardíaca que es una causa frecuente de muerte4 (Tabla 1).
De especial relevancia es la mutación Val122Ile (p. Val142Ile), que está presente en el 3% al 4% de la población negra norteamericana.3 Aunque su penetrancia es incompleta,3 esta mutación se ha asociado a un aumento del 47% del riesgo de desarrollar insuficiencia cardíaca (IC).6 Un estudio reciente demostró que la amiloidosis Val122Ile era la cuarta causa más común de IC en la población afrocaribeña británica.7 Aunque hasta el 30% de los pacientes con esta mutación pueden presentar rasgos de neuropatía leve,6 el fenotipo clínico suele ser similar al de la ATTRwt.4 Val122Ile no debe considerarse una mutación exclusiva de la población negra, ya que también puede estar presente en la población blanca. Por ejemplo, hemos identificado esta mutación en 4 familias blancas españolas sin ascendencia negra.
AMILOIDOSIS DE TRANSTIRETINA DE TIPO SILVESTRE
La amiloidosis de transtiretina de tipo silvestre se describió por primera vez en 1876. Anteriormente se denominaba amiloidosis senil, pero su diagnóstico en pacientes de entre 40 y 60 años ha hecho que este término quede obsoleto. Cabe destacar que el primer caso conocido de esta mutación se encontró en un paciente estadounidense de 47 años.8
La prevalencia exacta de la ATTRwt sigue siendo desconocida. Sin embargo, los estudios sugieren que está infradiagnosticada y que puede ser la forma más frecuente de amiloidosis cardíaca.2,3 Los siguientes resultados apoyan esta hipótesis:
- –
En pacientes de más de 80 años, la prevalencia del depósito de TTR es del 25% en la autopsia.3
- –
En pacientes con IC con fracción de eyección preservada (ICFE), el depósito de TTR moderado-grave es del 5% en la autopsia.9
- –
En pacientes de más de 60 años ingresados por ICpEF e hipertrofia ventricular izquierda (HVI) ≥ 12mm, nuestro grupo encontró recientemente una prevalencia del 13%.10
A diferencia de la ATTRm, la ATTRwt es una enfermedad esporádica que suele comenzar después de los 70 años.4 Se encuentra principalmente en hombres, y las series publicadas han informado de tasas que oscilan entre el 89% y el 98%.11,12 Sin embargo, en una serie reciente de pacientes diagnosticados con ATTRwt en 2 hospitales (Madrid, España y Bolonia, Italia), nuestro grupo encontró que el 20% eran mujeres. Además, otros estudios de autopsias también han sugerido que la ATTRwt en mujeres puede estar más extendida de lo que se había informado anteriormente. Por lo tanto, el sexo femenino no debería disminuir la sospecha clínica de ATTRwt (Tabla 1).13
Los resultados de las autopsias muestran que el depósito de TTR está disperso en diferentes órganos en la ATTRwt. Sin embargo, el depósito es mucho mayor en el corazón debido al tropismo cardíaco de la TTR, y la afectación cardíaca es la principal manifestación clínica.4 Los pacientes pueden presentar síntomas de depósito de TTR extracardíacos, como estenosis del canal lumbar, rotura atraumática del tendón del bíceps o «signo de Popeye», y síndrome del túnel carpiano (STC)3 (Figura 1). Todas estas características pueden ayudar a orientar y establecer rápidamente el diagnóstico. El STC puede acompañar a otros subtipos de amiloidosis, pero es más frecuente en la ATTRwt. La deposición puede preceder a las manifestaciones cardíacas en varios años.6 Puede utilizarse como indicación en pacientes ancianos con HVI, especialmente si tienen STC bilateral no asociada a actividades laborales específicas y se encuentran en clase funcional ≥ II de la New York Heart Association (datos no publicados).
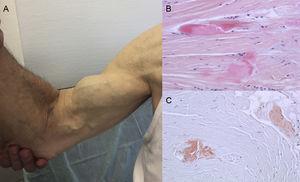
Signos y síntomas de la amiloidosis por transtiretina. A: rotura no traumática del tendón del bíceps derecho («signo de Popeye»). B y C: tinción con hematoxilina-eosina (B) y rojo Congo (C), ambas ×200, de una muestra de ligamento carpiano que muestra densos haces de colágeno con material no celular. Cortesía de la Dra. Clara Salas Antón.
DIAGNÓSTICO DE LA AMILOIDOSIS TRANSTRETINAPresentación clínica
El amiloide puede infiltrarse en cualquier estructura cardíaca.1 Normalmente, el depósito aumenta el grosor de la pared ventricular, lo que provoca una disminución gradual de la distensibilidad que conduce a una disfunción diastólica grave. Por ello, la ATTR se ha incluido tradicionalmente como causa de miocardiopatía restrictiva.
Sin embargo, el espectro clínico de la ATTR es mucho más amplio y heterogéneo. El síntoma más común de la ATTR es la IC. Como se ha mencionado, un estudio publicado por nuestro grupo en 2015 sugirió que un protocolo basado en la gammagrafía con 99mTc-3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) puede ser útil para el diagnóstico de la ATTRwt en una proporción significativa (13%) de pacientes mayores de 60 años ingresados por ICpEF.10 Basándose en este resultado, la gammagrafía con 99mTc-DPD se incluyó en las directrices europeas de 2016 sobre IC como una herramienta útil para la identificación de pacientes con ATTR.14 Sin embargo, la ATTR no debe sospecharse exclusivamente en pacientes con ICpEF porque, a medida que avanza el depósito de amiloide, la función contráctil empeora y, en consecuencia, la ATTR puede asociarse a diferentes grados de disfunción sistólica.
La amiloidosis de transtiretina es una fenocopia de la miocardiopatía hipertrófica (MCH) y puede confundirse con ella. Un reciente estudio multicéntrico francés informó de que el 5% de los pacientes con MCH tienen ATTRm.15 Sin embargo, nuestros resultados no coinciden con esta elevada tasa, que podría estar relacionada con la gran población negra de Francia.
Las anomalías de la conducción cardíaca pueden ser la primera manifestación de la ATTR. La infiltración amiloide de los nodos sinusales y auriculares1 puede indicar la necesidad de implantar un marcapasos (Tabla 1). El estudio mencionado anteriormente, realizado en España e Italia, encontró que los trastornos de la conducción eran la primera manifestación de la ATTRwt en el 7% de los pacientes con esta enfermedad.13
Las arritmias auriculares también son muy frecuentes en los pacientes con ATTRwt13 (Figura 2A), y la primera manifestación de la enfermedad puede ser el ictus.4 De hecho, el grupo de la Clínica Mayo ha sugerido recientemente que la ATTRwt debe descartarse ante un diagnóstico de fibrilación auricular (FA) no valvular en pacientes de edad avanzada.8 En cambio, la FA es mucho menos frecuente en los pacientes con ATTRm (tabla 1).
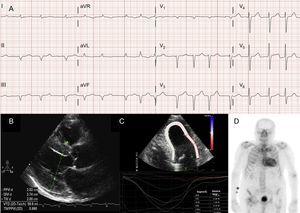
Técnicas de diagnóstico en la amiloidosis cardíaca por transtiretina (ATTR). A: electrocardiograma de un paciente con amiloidosis de transtiretina de tipo salvaje (ATTRwt), que muestra fibrilación auricular y patrón de pseudoinfarto en derivaciones inferiores. B: ecocardiograma de un paciente con amiloidosis de transtiretina mutante con mutación Val30Met, con marcada hipertrofia ventricular izquierda concéntrica y leve derrame pericárdico. C: tensión regional longitudinal de paciente con ATTRwt, que muestra valores conservados en el segmento apical y valores deprimidos en los segmentos basal y medioventricular. D, gammagrafía con 99mTc-DPD (99mTc-3,3-difosfono-1,2-propanodicarboxílico) de un paciente con ATTRwt, que muestra una captación biventricular superior a la ósea, correspondiente al grado 3 de Perugini.
Finalmente, observamos que la ATTR y la estenosis aórtica degenerativa pueden coexistir en el mismo paciente. En 2016, varios estudios llamaron la atención sobre esta posibilidad, y un estudio prospectivo informó de que la ATTRwt tenía una prevalencia del 6% en pacientes mayores de 65 años sometidos a una sustitución de la válvula aórtica16. Este estudio sugirió que los pacientes con ambas entidades tenían un pronóstico postoperatorio mucho peor que los que no tenían ATTRwt (mortalidad del 50% frente al 6,9% tras una mediana de seguimiento de 2,3 años).16 Otro estudio reciente con gammagrafía de 99mTc-DPD en 43 pacientes con estenosis aórtica de bajo flujo/bajo gradiente identificó a 5 pacientes con ATTRwt (prevalencia del 12%). 17 Los pacientes con estenosis aórtica grave y ATTRwt comparten el mismo perfil demográfico, y el tratamiento adecuado para los pacientes con ambas enfermedades está aún por determinar.Utilidad de las técnicas de diagnóstico
El diagnóstico de la ATTR es un reto en la práctica clínica diaria. Aunque el electrocardiograma y la ecocardiografía desempeñan un papel en el diagnóstico, las nuevas técnicas no invasivas han adquirido un papel clave en la evaluación de los pacientes con ATTR.
Electrocardiograma
La asociación entre el bajo voltaje y la amiloidosis cardíaca se ha considerado indiscutible durante mucho tiempo.3 Los criterios más utilizados en la práctica clínica son la amplitud del QRS 1 Aunque los bajos voltajes electrocardiográficos en el entorno de la HVI deberían establecer la sospecha, la prevalencia en una serie contemporánea de ATTR fue tan baja como del 20% al 25%.3,4,13 La prevalencia también varía según los criterios aplicados. Por ejemplo, el uso del criterio de Sokolow (onda S en la derivación V1 + onda R en la derivación V5 o V6
1,5 mV) puede aumentar la prevalencia calculada a entre el 46% y el 58%.13 Se ha recomendado la relación entre el grosor de la pared del ventrículo izquierdo y el voltaje total del QRS para evaluar mejor las disparidades entre los resultados de las dos técnicas.2,3 Sin embargo, hasta el 20% de los pacientes con ATTR pueden cumplir los criterios electrocardiográficos de HVI.2,3
En la mayoría de las series de pacientes con amiloidosis cardíaca, el patrón de pseudoinfarto es el hallazgo electrocardiográfico más común2,3,13 (Figura 2A). Debido a la posible afectación del sistema de conducción, también son frecuentes los bloqueos completos o incompletos de rama del haz.3
Ecocardiografía
Aunque la ecocardiografía es la piedra angular del diagnóstico inicial de la ATTR, no hay hallazgos específicos.3 La amiloidosis de transtiretina se ha asociado típicamente a un ventrículo izquierdo normal o pequeño con hipertrofia concéntrica.3 El 10º Simposio Internacional sobre Amiloide y Amiloidosis celebrado en 2004 estableció el criterio ecocardiográfico de cardiopatía debida a AL en ausencia de otras causas de HVI como la presencia de HVI con un punto de corte de 12 mm para el grosor de la pared septal interventricular.4 Este criterio se extrapoló posteriormente a otras formas de amiloidosis (figura 2B), lo que confirió un alto grado de especificidad pero una baja sensibilidad.
Aunque clásicamente se ha descrito la HVI concéntrica, las series actuales sugieren que alrededor del 20% tienen HVI asimétrica.13
A pesar de la clásica asociación entre una fracción de eyección del ventrículo izquierdo (FEVI) normal o ligeramente disminuida y la amiloidosis cardiaca,2 el rango de FEVI es muy variable.8 En un estudio reciente realizado en la Clínica Mayo, una FEVI de 8 mientras que en nuestra serie una FEVI de 13 Además, el uso de la FEVI en la evaluación de la función sistólica en la amiloidosis cardíaca es limitado, porque los valores ligeramente deprimidos ya son indicativos de una enfermedad cardíaca relevante. Esta limitación puede superarse mediante el uso de las velocidades Doppler tisulares, las imágenes de deformación y la fracción de contracción miocárdica, que se han propuesto como índices más apropiados para evaluar la función cardíaca.2
Otros signos ecocardiográficos clásicos son la hipertrofia del ventrículo derecho, la dilatación biatrial, el derrame pericárdico leve, el engrosamiento de la válvula auriculoventricular, el engrosamiento de la pared del tabique auricular y el aspecto granular espumoso del miocardio.3,6 Sin embargo, dado que algunas de estas características se observaron en una serie muy seleccionada de pacientes en estadios avanzados de la enfermedad, no es necesario que todas ellas estén presentes para establecer la sospecha.1
Las imágenes de deformación regional son una técnica muy útil para el diagnóstico precoz de los pacientes con ATTR. En los pacientes con ATTR, el strain longitudinal está deprimido en los segmentos basales y medioventriculares, pero está preservado en los segmentos apicales18 (Figura 2C). Este patrón típico puede ser útil en el diagnóstico diferencial de la ATTR respecto a otras cardiopatías.4
Biomarcadores
Existen menos datos sobre el papel de la prohormona N-terminal del propéptido natriurético cerebral (NT-proBNP) y de la troponina en la ATTR que en la AL.4 Los niveles de NT-proBNP en la ATTR suelen ser más bajos que en la AL,4 lo que refleja dos mecanismos fisiopatológicos diferentes: la toxicidad directa de la cadena ligera en la AL frente al daño tisular inducido por las protofibrillas en la ATTR.
Recientemente, el grupo de la Clínica Mayo propuso un sistema de estratificación similar al vigente para la AL. En una cohorte de 360 pacientes con ATTRwt, ambos biomarcadores demostraron ser predictores de mortalidad. Los pacientes en estadio III (NT-proBNP > 3000 pg/mL y troponina T > 0,05 ng/mL) tuvieron una mediana de supervivencia de 20 meses, mientras que los pacientes en estadio I y II tuvieron una mediana de supervivencia de 66 meses y 40 meses (sin biomarcador o sólo con un biomarcador por encima de los puntos de corte establecidos, respectivamente).
Resonancia magnética cardiaca
La resonancia magnética cardiaca (RMC) puede utilizarse para obtener información estructural y funcional y caracterizar la composición del tejido miocárdico.3 La RMC es esencial en la identificación precoz de la ATTR, y en su diagnóstico diferencial de otras enfermedades cardíacas.
La caracterización del tejido mediante RMC se basa en las siguientes características:
- –
Realce tardío: Un patrón global subendocárdico es prácticamente patognomónico de amiloidosis cardíaca, pero sólo está presente en una cuarta parte de los pacientes. Otros patrones, como el transmural (el más común) o el parcheado, también son compatibles (Figura 3). A pesar de su alta sensibilidad y especificidad, hay que tener en cuenta que puede haber una posible ausencia de realce tardío (15% de los pacientes) y, en nuestra experiencia, un porcentaje no despreciable de falsos negativos por razones técnicas.3 El patrón de realce transmural se asocia a peor pronóstico y es un predictor independiente de mortalidad.19
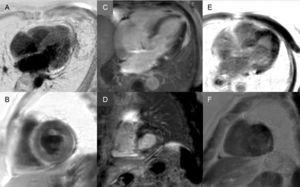 Figura 3.
Figura 3.Diversidad de patrones de realce tardío por resonancia magnética cardíaca en la amiloidosis por transtiretina. A y B: secuencias de realce tardío, plano de 4 cámaras y eje corto a nivel medio, respectivamente, de un paciente con amiloidosis de transtiretina mutante (ATTRm), que muestra un depósito transmural de gadolinio patológico difuso. C y D: secuencias de realce tardío, nivel basal de 4 cámaras y eje corto, respectivamente, de pacientes con ATTRm que muestran depósito patológico de gadolinio con un patrón parcheado, con área focal inferior inferoseptal e inferolateral basal. E y F, secuencias de realce tardío, plano de 4 cámaras y eje corto a nivel apical, respectivamente, de pacientes con ATTRm, que muestran un extenso depósito transmural patológico, excepto en los segmentos basal y anterolateral medio. Cortesía del Dr. Jesús González Mirelis.
(0.15MB). - –
Tiempos T1 largos: El mapeo T1 es una técnica en la que se mide una señal miocárdica cuantitativa antes (T1 nativo) o después de la administración de contraste. Los tiempos T1 nativos son muy largos en la amiloidosis cardíaca.3 El mapeo T1 no requiere la administración de contraste, por lo que puede utilizarse en la insuficiencia renal. Los tiempos T1 pueden incluso ser anormales antes de que se observe la HVI.3 Los tiempos T1 son más largos en la ATTR que en la MCH y los controles (1097ms ± 43 ms vs 1026ms ± 64 ms vs 9,67ms ± 34ms, respectivamente; P
ms ± 68 ms; P = 0,01).20
La administración de contraste puede utilizarse para calcular el volumen extracelular (VEC) y evaluar el aumento del espacio extracelular. Los valores de VEC en la amiloidosis cardíaca son más elevados que en otras cardiopatías, excepto en las zonas de infarto de miocardio.21 En 2016, nuestro grupo, en colaboración con otros centros nacionales, comunicó que la cuantificación del VEC puede identificar la afectación cardíaca en la ATTRm y, por primera vez, la correlacionó con el grado de afectación neurológica, lo que apoya el uso de esta técnica en el diagnóstico precoz y el seguimiento de la ATTRm.22
Las técnicas de mapeo cuantitativo de T1 y de cálculo del VEC pueden ser muy útiles en la ATTR para el diagnóstico precoz, el seguimiento clínico y la evaluación de la respuesta al tratamiento (figura 4).
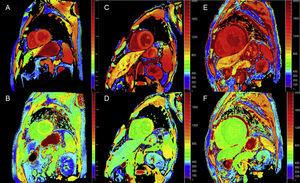
Mapas T1, antes y después del contraste, con inversión-recuperación de look-locker modificada (MOLLI) en resonancia magnética cardiaca de 3T en control sano, paciente con amiloidosis de transtiretina y paciente con amiloidosis primaria de cadena ligera. A y B: mapa T1 nativo y volumen extracelular (VE), respectivamente, en un control sano, mostrando valores normales (VE = 0,214). C y D: mapa de T1 nativo y EV, respectivamente, en un paciente con amiloidosis de transtiretina mutante con daño neurológico e incipiente afectación cardíaca, T1 nativo elevado y EV ligeramente elevado (0,361). E y F: mapeo de T1 nativo y EV, respectivamente, en un paciente con amiloidosis cardíaca por transtiretina de tipo salvaje, T1 nativo elevado y EV muy alto (0,626), lo que refleja una infiltración amiloide masiva. Cortesía del Dr. Jesús González Mirelis.
Gammagrafía cardíaca
En la década de 1980, la observación de la captación cardíaca de varios trazadores de difosfonatos óseos se correlacionó histológicamente con la presencia de amiloidosis cardíaca.23 El mecanismo de captación no está bien caracterizado, pero puede estar relacionado con el contenido de calcio de los depósitos amiloides.
Un estudio temprano del grupo de Bolonia utilizando 99mTc-DPD encontró captación cardíaca en 15 pacientes con ATTR y su ausencia en 10 pacientes con AL, utilizando una puntuación basada en la captación biventricular igual o superior a la captación ósea (puntuación Perugini)24 (Figura 2D). Nuestro grupo y otros informaron posteriormente de resultados similares.25 La captación leve (puntuación 1) y la captación moderada (puntuación 2) pueden encontrarse en el 30% y el 10% de los pacientes con AL, respectivamente.24
Dada su alta sensibilidad y especificidad, esta técnica es extremadamente útil para establecer el diagnóstico de ATTR y puede mostrar la afectación cardíaca incluso cuando los hallazgos de la ecocardiografía y la RM siguen siendo normales. De hecho, después de la gammagrafía para indicaciones oncológicas o reumatológicas, los hallazgos incidentales de ATTR no son infrecuentes.26
El Tc-DPD no está disponible en los Estados Unidos, pero se han comunicado resultados similares utilizando imágenes de 99mTc-PYP (pirofosfato).27
Actualmente se están estudiando otros radiotrazadores. Por ejemplo, el 18F-florbetapir, que ya ha sido aprobado para la obtención de imágenes del beta-amiloide cerebral,4 se ha estudiado en pacientes con AL y ATTR. Los resultados muestran que el 18F-florbetapir puede detectar depósitos miocárdicos de AL y ATTR.28 Aunque los datos disponibles se obtuvieron en estudios de casos29 y el elevado coste de este radiotrazador limita su uso, se están realizando varios estudios sobre la ventaja potencial de su uso sobre el de Tc-DPD como técnica de cribado para los 2 tipos más comunes de amiloidosis.
Diagnóstico invasivo
El diagnóstico definitivo de ATTR se basa en la demostración histológica de fibrillas amiloides. Aunque puede haber depósitos extracardiacos, la probabilidad de demostrar amiloide por histología varía según el órgano.2 Hay pocos estudios sobre la rentabilidad de la biopsia extracardiaca (por ejemplo, grasa abdominal, gingival, glándula salival, gastrointestinal) en la ATTR, que es mayor en la ATTRm que en la ATTRwt. Sin embargo, una biopsia negativa de un órgano clínicamente no afectado no excluye el diagnóstico de ATTR.4
Al igual que en la ATTRwt, la biopsia endomiocárdica está indicada en pacientes sin afectación extracardíaca o con enfermedad cardíaca únicamente.3,4 La biopsia endomiocárdica es un procedimiento de bajo riesgo (especialmente en centros con experiencia) y los errores de muestreo son poco probables.6
Después de la confirmación histológica de la amiloidosis, que a veces puede requerir la interpretación por parte de personal capacitado,6 la clasificación correcta del subtipo es crucial.4 Actualmente, la clasificación depende de una combinación de inmunohistoquímica, análisis genético y proteómica:
- –
La inmunohistoquímica se basa en el uso de anticuerpos específicos contra proteínas amiloides conocidas. Aunque los resultados de esta técnica suelen ser definitivos, es menos sensible en el reconocimiento de las cadenas ligeras.4
- –
Esta limitación puede superarse mediante el uso de la espectrometría de masas, que proporciona resultados definitivos y es el estándar de criterio en la confirmación del subtipo de amiloide.2 Aunque esta técnica sólo está disponible en centros especializados, es especialmente útil en los casos no concluyentes o en los que son positivos para varios anticuerpos en la inmunohistoquímica, lo que en nuestra experiencia ocurre en alrededor del 20% al 30% de los casos. 4
- –
Debido a que las técnicas clínicas o histológicas no pueden distinguir la ATTRm de la ATTRwt, se recomienda realizar estudios genéticos en todos los casos de ATTR. El hallazgo de una mutación causal puede ser importante para ofrecer asesoramiento genético y seguimiento a los portadores asintomáticos, 4,30 que podrían beneficiarse de próximas terapias que retrasen o incluso prevengan la aparición de la enfermedad.31
Diagnóstico no invasivo
Hasta hace poco, los estudios histológicos se consideraban esenciales en el diagnóstico de la ATTR.3 Sin embargo, para facilitar el diagnóstico, en 2016 un estudio multicéntrico internacional propuso un nuevo algoritmo para el diagnóstico no invasivo de la ATTR.32
El estudio analizó los resultados de 1217 pacientes. La presencia de signos clásicos de amiloidosis cardíaca mediante técnicas de imagen, la captación de Tc-DPD/PYP de grado 2 o 3 en la gammagrafía y la ausencia de una proteína monoclonal tenían una especificidad y un valor predictivo positivo para la ATTR del 100%32 (figura 5).
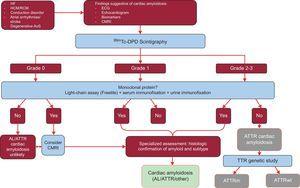
Algoritmo de diagnóstico para pacientes con sospecha de amiloidosis cardíaca. Sistema de graduación de la gammagrafía con 99mTc-DPD: grado 0, sin captación cardíaca; grado 1, captación ligeramente inferior a la ósea; grado 2, captación moderada igual a la ósea; grado 3, captación grave superior a la ósea. ACV: accidente cerebrovascular; AL: amiloidosis primaria de cadena ligera; AoS: estenosis aórtica; ATTR: amiloidosis de transtiretina; ATTRm: amiloidosis de transtiretina mutante; ATTRwt: amiloidosis de transtiretina salvaje; ECG: electrocardiograma; HCM: miocardiopatía hipertrófica; IC: insuficiencia cardíaca; MCR: miocardiopatía restrictiva; TTR: transtiretina.
Una característica clave de este algoritmo es la ausencia de una proteína monoclonal que podría causar AL en el ensayo de cadena de suero (Freelite, The Binding Site, Reino Unido) y en la electroforesis de inmunofijación de sangre y orina. La presencia de una proteína monoclonal es una indicación para la biopsia endomiocárdica para distinguir entre ATTR y AL.32 Hasta el 5% de la población de más de 65 años tiene una gammapatía monoclonal de significado indeterminado.2 En los individuos de edad avanzada, un aumento moderado de las cadenas ligeras circulantes no debería conducir directamente al diagnóstico de AL. Se ha descrito que hasta el 10% de los pacientes ancianos con ATTRwt y gammapatía monoclonal de significado indeterminado en centros de referencia habían recibido previamente un diagnóstico erróneo de AL.3,33 Es necesario un diagnóstico correcto para evitar una quimioterapia inadecuada. Es interesante que nuestro hospital haya documentado 2 casos de pacientes con mieloma múltiple y ATTRwt concomitante en la espectrometría de masas.TRATAMIENTO DE LA AMILOIDOSIS CARDÍATICA TRANSTRETINA
El tratamiento de los pacientes con ATTR tiene 2 objetivos: proporcionar apoyo médico y, si es posible, detener o retrasar el depósito de amiloide mediante el uso de tratamientos específicos.
Tratamiento médico
Las siguientes secciones describen los cuidados cardíacos de apoyo para los pacientes con ATTR.
Manejo de la insuficiencia cardíaca
La uvolemia debe mantenerse en los pacientes con amiloidosis cardíaca. La dieta y las medidas de estilo de vida son muy importantes. Los diuréticos son fundamentales para el tratamiento de la IC en la ATTR. Sin embargo, debido a que el uso excesivo de diuréticos puede provocar hipotensión (frecuentemente debido a la disfunción autonómica) y empeorar la situación clínica, especialmente en la ATTRm, debe extremarse el cuidado en su manejo.
En el tratamiento de la IC en la ATTR, debe tenerse en cuenta que el deterioro de la disfunción diastólica y la reducción del volumen sistólico conducen a una taquicardia compensatoria para mantener el gasto cardíaco. Por lo tanto, los betabloqueantes deben utilizarse con cuidado y de forma individualizada para cada paciente. La práctica habitual es suprimirlos en ausencia de dificultades para controlar la frecuencia cardíaca. Este enfoque es aún más importante, si cabe, en la ATTRwt debido a la frecuente presencia de trastornos de la conducción.6 Los antagonistas del calcio y la digoxina pueden unirse a las fibrillas amiloides y, por tanto, están contraindicados en la ATTR debido al riesgo de toxicidad incluso a dosis terapéuticas.6
A diferencia de la IC con disfunción sistólica debida a otras etiologías, no hay pruebas que apoyen un beneficio pronóstico debido al uso de betabloqueantes, inhibidores de la enzima convertidora de la angiotensina o antagonistas de los receptores de la angiotensina II en la amiloidosis cardíaca. De hecho, su uso puede conducir a un empeoramiento clínico debido a la hipotensión y al bajo gasto: una publicación reciente ha informado de un peor pronóstico en la ATTRm y de un efecto neutro en la ATTRwt.34
Manejo de las arritmias auriculares
El manejo de la FA en la ATTR es un reto. Mantener el ritmo sinusal a largo plazo es difícil. Sin embargo, puede intentarse la cardioversión eléctrica porque puede dar lugar a una mejora clínica.
El riesgo tromboembólico en los pacientes con ATTR es muy elevado. Además, la infiltración amiloide crónica puede provocar una disfunción auricular mecánica, que puede ser la causa subyacente del desarrollo de trombos auriculares en algunos pacientes sin FA. El tratamiento anticoagulante en la ATTR no debe basarse en la puntuación CHADS2-VASC y debe ser el tratamiento estándar en la FA. Los eventos hemorrágicos son menos frecuentes que en la AL, por lo que algunos hospitales recomiendan el tratamiento anticoagulante en los pacientes con ritmo sinusal si hay una mala función auricular según las velocidades del Doppler transmitral. Aunque no existen estudios comparativos sobre la eficacia de los anticoagulantes orales directos frente a los antagonistas de la vitamina K, nuestro hospital ha administrado anticoagulantes orales directos a pacientes seleccionados.
Función de los dispositivos
Las recomendaciones actuales para la implantación de marcapasos son las mismas en la ATTR y en la población general. Sin embargo, algunos grupos están a favor de la implantación profiláctica, especialmente en pacientes con ATTRm y trastornos de la conducción.35 No estamos a favor de esta estrategia preventiva y no hemos encontrado una tasa tan alta de trastornos de la conducción que justifique la implantación profiláctica en pacientes con ATTRm.
El papel del uso del desfibrilador cardioversor implantable (DCI) en la ATTR no está bien establecido. En una serie pequeña, el implante de DAI no mejoró significativamente la supervivencia, aunque tuvo un efecto adecuado en múltiples pacientes durante los primeros 2 años.36
Trasplante de corazón
El trasplante de corazón ha desempeñado un papel menor en la ATTR porque la ATTRm puede afectar a varios órganos y la ATTRwt suele afectar a pacientes de edad avanzada. Sin embargo, la ausencia de afectación extracardíaca en los pacientes con ATTRwt los convierte en buenos candidatos para el procedimiento. La bibliografía ofrece ejemplos de trasplantes con éxito en pacientes menores de 70 años con ATTRwt o con ATTRm y afectación cardíaca predominante.4
Tratamiento específico de la amiloidosis cardíaca por transtiretina
En la actualidad, no existe ningún tratamiento aprobado para el tratamiento específico de la amiloidosis cardíaca por transtiretina, aunque el trasplante de hígado (TxH) solo o en combinación con el trasplante de corazón se ha utilizado en la ATTRm desde la década de 1990 como forma de eliminar la principal fuente de TTR precursora.4
Trasplante de hígado
El Registro Mundial de Trasplantes de Polineuropatía Amiloidótica Familiar37 informó de que más de 2000 pacientes con ATTRm han sido sometidos a TxH en 20 países.4 Los pacientes con la mutación Val30Met y un cuadro clínico predominantemente neurológico tienen una tasa de supervivencia de más del 50% a los 20 años.3 Estos prometedores resultados se basan en una estricta selección de los pacientes según la edad, el tipo de mutación y el estadio de la enfermedad. La indicación más comúnmente aceptada para la TxH es la combinación de edad joven, la mutación Val30Met y los estadios tempranos de la enfermedad.
Sin embargo, las principales limitaciones de esta técnica son la escasez de donantes, la necesidad de inmunosupresión crónica, la edad avanzada en el momento de la presentación y los peores resultados obtenidos en pacientes con mutaciones distintas de la mutación Val30Met.
Además, la teórica supresión de la producción de la proteína mutada se ve contrarrestada por el depósito progresivo de TTR nativa tras el implante,4,6 cuyo mecanismo no se conoce completamente. De hecho, el depósito cardíaco de TTR tras la TxH afecta a la morbilidad y la mortalidad.
La necesidad de comprender mejor la patogénesis de la ATTR y las limitaciones de la TxH ha estimulado el desarrollo de varios fármacos.
Estos nuevos compuestos actúan en diferentes puntos de la cascada de amiloidogénesis de la TTR (Figura 6). El tratamiento siempre implicará la reducción de la proteína precursora, aunque evitar el depósito y eliminar los depósitos existentes será igualmente importante. Por lo tanto, creemos que, en el futuro, el enfoque de esta enfermedad será en forma de tratamiento combinado.
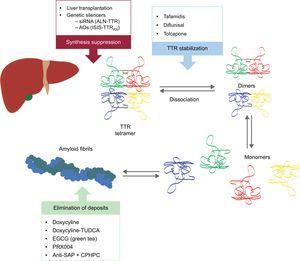
Terapias específicas en la amiloidosis cardíaca por transtiretina y principales objetivos. AntiSAP + CPHPC, componente antisuero del amiloide P + ácido (R)-1–6-oxo-hexanoil]pirrolidina-2-carboxílico; AOs, oligonucleótidos en antisentido; EGCG, galato de epigalocatequina-3; siRNA, small interfering RNA; TTR, transtiretina; TUDCA, ácido tauroursodesoxicólico.
Supresión de la síntesis de transtiretina
Se están llevando a cabo dos líneas de investigación sobre la inhibición de la expresión hepática de la TTR: el uso de pequeños ARN interferentes (siRNA) y el uso de fármacos de oligonucleótidos antisentido (AO).
- –
Los ARNsi son moléculas de ARN de doble cadena que silencian las secuencias de ARN mensajero al unirse específicamente a ellas, impidiendo la formación de proteínas. Se ha descubierto que Patisiran (ALN-TTR02) reduce la producción de TTR en un 80%.38 En pacientes con ATTRm, la reducción de TTR fue del 87%.39 Un ensayo de fase 2 ha mostrado resultados prometedores, demostrando parámetros ecocardiográficos, funcionales y analíticos estables a los 12 meses y a los 24 meses.40 Los resultados del estudio neurológico de fase 3 en pacientes con ATTRm y un subanálisis de pacientes con afectación cardíaca se esperan en 2017 (Tabla 2). Otro fármaco, revusiran (ALN-TTR01), se administra por vía subcutánea y se diferencia de patisiran en las nanopartículas lipídicas que encapsulan el siRNA. Este fármaco fue objeto de un ensayo clínico de fase III en pacientes con ATTRm que padecen enfermedades cardíacas. El estudio se interrumpió el año pasado debido a un aumento inesperado de la mortalidad en el grupo de tratamiento (Tabla 2).
Tabla 2.Principales ensayos clínicos en curso en la amiloidosis cardíaca por transtiretina
Mecanismo de acción Compuesto Ensayo Diseño. Pacientes (N) y subtipo de ATTR Intervención Puntos finales primarios Situación/resultados Supresión de la síntesis de TTR Patisiran (ALN-TTR02) NCT01961921 Estudio de fase II, multicéntrico 27
ATTRm (11 afectaciones cardíacas)Patisiran 0.30 mg/kg IV cada 3 semanas durante 2 años Seguridad a largo plazo. Criterios de valoración secundarios: Efecto sobre los trastornos neurológicos y los parámetros cardíacos Fármaco bien tolerado, con un perfil de seguridad similar en el fenotipo neurológico y cardíaco
Troponina I, NT-proBNP y datos ecocardiográficos se mantuvieron estables a los 12 y 24 mesesNCT01960348 (APOLLO) Fase III, aleatorizado, doble ciego, controlado con placebo, multicéntrico 225
ATTRm con afectación neurológicaInfusión de patisiran IV vs placebo 2:1 Cambios en mNIS+7 Previsto para noviembre de 2017
Subanálisis de pacientes con afectación cardíaca previstaNCT02510261 Estudio de extensión de APOLLO Patisiran infusión IV vs placebo 2:1 durante 52 semanas Seguridad y efectos adversos a largo plazo En curso Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Fase III, aleatorizado, doble ciego, controlado con placebo 206
ATTRm con afectación cardíacaRevusiran 500mg 5 d, luego semanalmente durante 2 años frente a placebo Cambios en la prueba de caminata de 6 m y en los valores de TTR en plasma Se interrumpió debido al aumento de la mortalidad en el brazo de revusiran IS-TTRRX NCT01737398 Fase II/III, aleatorizado, doble ciego, controlado con placebo, multicéntrico 172
ATTRm con neuropatía; 50% de afectación cardíaca concomitanteIS-TTRRX 300mg SC cada 12 h durante 1 wk, luego semanalmente durante 64 semanas frente a placebo Cambios en el mNIS+7 y en el cuestionario de calidad de vida de Norfolk Previsto para septiembre de 2017
Se han notificado casos de trombocitopenia grave y hemorragias
Análisis de parámetros ecocardiográficos y NT-proBNP esperado en pacientes sin hipertensión con HVI > 12 mmTratamiento de la cardiomiopatía por TTR con oligonucleótido antisentido específico para TTR Fase II, abierta, no aleatoria 20
ATTRm con afectación cardíaca y ATTRwtIS-TTRRX 300mg SC cada 12 h/semana Parámetros ecocardiográficos y resonancia magnética cardíaca frente a controles históricos Sin deterioro del strain y disminución de la masa del VI de alrededor del 5%
6 pacientes completaron 12 mo; 15 pacientes 6 mo; 1 paciente TxCNCT02627820 Fase II, abierta, no aleatoria 50
ATTRwtISIS-TTRRX 300mg SC cada 12 h durante 1 sem, luego 1 semana durante 18 semanas Cambios en la tensión medidos por speckle tracking Cancelado sin iniciar el reclutamiento de pacientes Estudio de fase III con ISIS-TTRRX para el tratamiento de la cardiopatía amiloide por TTR Fase III, aleatorizado, doble ciego, controlado con placebo, multicéntrico 490
ATTRwt y ATTRm con afectación cardíacaISIS-TTRRX 300mg SC cada 12 h durante 1 semana, luego semanal durante 16 semanas con placebo, luego semanalmente durante 24 meses Muerte, TxC o ingreso por causas cardiovasculares En espera Estabilización de TTR Tafamidis NCT01994889 Fase III, aleatorio, doble ciego, controlado con placebo, multicéntrico 441
ATTRwt y ATTRm con afectación cardíacaTafamidis 20 mg u 80 mg por vía oral cada 24 horas durante 30 meses frente a placebo Mortalidad por todas las causas y hospitalización cardiovascular .causa y hospitalización cardiovascular Fin de febrero de 2018 NCT02791230 Extensión Fase III NCT01994889 330
ATTRwt y ATTRm con afectación cardíacaTafamidis 20 mg u 80 mg por vía oral cada 24 h durante 60 mo Mortalidad por todas las causas e incidencia de efectos adversos Tafamidis 20 mg u 80 mg por vía oral cada 24 h durante 30 meses frente a placebo.mortalidad por todas las causas e incidencia de efectos adversos Prevista para diciembre de 2021 NCT00935012 Fase II, ensayo abierto de eficacia y seguridad 31
ATTRwt o ATTRm p.Val122Ile con afectación cardíacaTafamidis 20mg oral Seguridad y eficacia En curso hasta diciembre de 2021 Diflunisal NCT00294671 Fase III, aleatorizado, doble ciego, controlado con placebo, multicéntrico 130
ATTRm con fenotipo neurológico (50% con afectación cardíaca)Diflunisal 250mg por vía oral cada 12 h vs placebo durante 24 mo NIS+7 a los 24 mo NIS+7 diflunisal vs placebo 16.3 (P No hay reducción del grosor o tensión ventricular en pacientes con afectación cardíaca frente a placebo Eliminación de depósitos Doxiciclina + TUDCA/UDCA NCT01171859 Fase II, abierta, no aleatoria, prospectiva 40
ATTR (25 ATTRm, 13 ATTRwt, y 2 receptores de trasplante de hígado en dominó)Doxiciclina 100 mg cada 12 h + TUDCA 250 mg cada 8 h durante 12 mo, luego 6 meses sin terapia Aumento 14 pacientes se retiraron
Reacciones cutáneas adversas, 16 pacientes
El 68% de los 25 pacientes evaluables cumplieron el criterio de valoración principal
Mejora global de la tensión a los 12 meses y empeoramiento tras 6 meses sin terapiaNCT01855360 Fase II, abierto, no aleatorizado, prospectivo frente a controles históricos 30
Amiloidosis ATTR cardíaca (27 ATTRwt y 3 ATTRm). Controles históricos, 14 pacientes con ATTRwtDoxiciclina 100 mg cada 12 h + TUDCA 250 mg cada 8h durante 18 meses Cambios en el strain longitudinal cada 6 meses 22 pacientes completaron el estudio y fueron evaluables
Mayor deterioro del strain en los controles frente al grupo de tratamiento
Aumento del NT-proBNP en el grupo de tratamiento; no se midió en los controlesNCT01677286 Fase II, abierta, no aleatoria, prospectivo 25
Amiloidosis sistémica (6 ATTRwt y 3 ATTRm)Doxiciclina 100 mg cada 12 h durante 12 meses Seguridad del fármaco
Respuesta de los órganos afectadosEmpeoramiento del NT-proBNP y de la función renal
No hubo mejora en otros parámetros estudiados
El 60% de los pacientes tuvo complicaciones cutáneas y el 30% se retiró por problemas cutáneos o gastrointestinalesNCT01171859 Fase II, abierto, no aleatorizado, prospectivo 45
35 con afectación cardíaca; 25 ATTRm; 5 ATTRm con TxH; 13 ATTRwt; y 2 receptores de trasplante hepático en dominóDoxiciclina 100 mg cada 12 h + TUDCA 250 mg cada 8 h durante 12 meses
Fase de seguimiento posterior sin tratamiento durante 6 mesesRespuesta al fármaco definida como una Respuesta cardíaca evaluada en 25 pacientes
El 68% tuvo respuesta cardíaca
Aumento de NT-proBNP y deterioro de la tensión durante el seguimiento sin tratamiento
Alto número de abandonos por efectos adversos
14 se retiraron en la fase de tratamiento y 5 suspendieron en la fase sin tratamientoEfecto de la doxiciclina + UDCA en la ATTR Fase II, abierta, no aleatoria, prospectivo 28
ATTR con afectación cardíaca (27 ATTRm y 1 ATTRwt)Doxiciclina 200 mg/d durante 4 semanas, luego suspendida 2 semanas, luego UDCA 750 mg/d durante 12 meses
Fase de seguimiento posterior sin tratamiento durante 6 mesesCambios en el NT-proBNP y la puntuación de Kumamoto Sólo el 14% completó el estudio y el 36% completó 12 meses
No hubo cambios en el NT-proBNP a los 6 meses y empeoramiento a los 12 meses
HLV estable
Empeoramiento de la puntuación de Kumamoto a los 12 mesesEGCG Fase II, abierto, no aleatorizado, prospectivo 25
ATTRwt600 mg, EGCG durante 12 meses Cambios en ECHO y RMN cardiaca (n = 14) Disminución de la masa del VI en un 6% por RMN cardiaca (P = 0.03)
Flujo de vida, grosor del miocardio y MAPSE por ECHO sin cambiosAntiSAP + CPHPC NCT03044353 Fase II, abierta, aleatorizada 40
Cohorte 1: amiloidosis ATTR cardiaca
Cohorte 2: amiloidosis primaria después de 6 meses de quimioterapiaAntiSAP + CPHPC mensual durante 6 meses Carga de amiloide reducida por RMN cardiaca y ECHO Inicio en 2017 AntiSAP + CPHPC, componente antisuero del amiloide P + ácido (R)-1–6-oxo-hexanoil]pirrolidina-2-carboxílico; ATTRm: amiloidosis de transtiretina mutante; ATTRwt: amiloidosis de transtiretina salvaje; BNP: péptido natriurético cerebral; ECHO: ecocardiograma; EGCG: galato de epigalocatequina-3; IV: intravenoso; MAPSE: excursión sistólica del plano anular mitral; MRI: resonancia magnética; LV: ventrículo izquierdo; LVEF: fracción de eyección del ventrículo izquierdo; NIS: Neuropathy Impairment Score; NIS-LL: Neuropathy Impairment Score of the Lower Limbs; NT-proBNP: péptido natriurético aminoterminal; SC: subcutáneo; TTR: transtiretina; TUDCA: ácido tauroursodesoxicólico; TxC: trasplante de corazón; TxH: trasplante de hígado; UDCA: ácido ursodesoxicólico.
Los AOs son hebras cortas de oligonucleótidos que se unen específicamente al ARN, impidiendo la traducción y la síntesis de proteínas objetivo.4 ISIS-TTRRX es un AO subcutáneo, con reducciones demostradas dependientes de la dosis en los valores de TTR del 75% al 90% en voluntarios sanos.4 El ensayo de fase III en pacientes con ATTRm y fenotipo neurológico terminó en marzo de 2017 y sus resultados se esperan para finales de 2017. Sin embargo, la Administración de Alimentos y Medicamentos de los Estados Unidos pospuso el inicio de un ensayo de fase III en pacientes con ATTRwt y ATTRm con enfermedad cardíaca debido a los casos de trombocitopenia grave en el estudio neurológico (Tabla 2). Dado que el 50% de los participantes en el estudio neurológico tenían enfermedad cardíaca, los resultados de este subestudio cardíaco determinarán si se reanuda el ensayo de fase III. Por otra parte, existen datos preliminares de un ensayo de fase II abierto. En este estudio, 22 pacientes con ATTRwt y ATTRm con enfermedad cardíaca recibieron una inyección semanal de ISIS-TTRRX. Según el informe, el perfil de seguridad del fármaco es muy favorable y los datos intermedios sobre la progresión de la enfermedad cardíaca mediante RMC, NT-proBNP y pruebas de 6 minutos son positivos.41
Estabilización de la transtiretina
La disociación del tetrámero TTR en subunidades es un paso crucial en la formación de fibrillas ATTR. Diflunisal y tafamidis son dos estabilizadores de la TTR con eficacia demostrada en la polineuropatía ATTRm.
- –
Tafamidis es una pequeña molécula administrada por vía oral que se une a la TTR en los sitios de unión de la T4 estabilizando la proteína y evitando su disociación. Tras la publicación de los resultados de un ensayo aleatorio a doble ciego en 125 pacientes con ATTRm y la mutación Val30Met en las fases iniciales de la enfermedad neurológica,42 la Agencia Europea del Medicamento aprobó su uso en 2011 como medicamento huérfano para retrasar la progresión neurológica. Datos recientes demuestran la eficacia del fármaco para lograr la estabilidad neurológica en al menos el 60% de los participantes tras más de 4 años de seguimiento. Hasta la fecha, su uso en la enfermedad ATTR y cardiológica es limitado. Un estudio de fase II en 21 pacientes con ATTRm y diferentes mutaciones demostró que el NT-proBNP y los parámetros ecocardiográficos se mantenían estables a los 12 meses.43 Los datos de un estudio de cohorte de 5 años confirmaron que el fármaco era bien tolerado a una dosis de 20 mg, aunque pocos pacientes con ATTRwt permanecían estables a los 3,5 años.44 El ensayo ATTR-ACT es un ensayo de fase III de 30 meses de duración que evalúa la eficacia, seguridad y tolerabilidad de dosis de 20 mg y 80 mg de tafamidis frente a placebo en 440 pacientes con ATTRm, ATTRwt e IC. El criterio de valoración principal incluye la mortalidad y el ingreso hospitalario. Sus resultados se esperan en 2018.3,27
- –
Diflunisal es un agente antiinflamatorio no esteroideo que estabiliza las moléculas de TTR in vitro. No está disponible en España, pero puede solicitarse médicamente desde el extranjero para uso compasivo. Un estudio de fase III de ATTRm en pacientes con afectación predominantemente neurológica, más de la mitad de los cuales tenían cardiopatía, no encontró diferencias significativas en los parámetros ecocardiográficos a lo largo del periodo de estudio (Tabla 2).45 Su potencial de efectos adversos gastrointestinales, insuficiencia renal, retención de líquidos e hipertensión lo hacen inadecuado para pacientes con cardiopatía. La evidencia sobre el diflunisal en pacientes con ATTR es muy limitada. Existe un estudio, pero está limitado por tener un diseño no aleatorizado en un solo centro, con poco seguimiento y pocos pacientes (n = 13). No hubo ingresos por descompensación de la IC, pero sí un empeoramiento significativo de la función renal.46
- –
Más recientemente, un grupo español demostró que la tolcapona (un inhibidor oral de la catecol-O-metiltransferasa utilizado en el tratamiento de la enfermedad de Parkinson) tiene la capacidad de unirse in vitro a la TTR de pacientes con ATTRwt y Val122Ile con mayor afinidad que otros estabilizadores.47
Eliminación de los depósitos amiloides
Los depósitos amiloides son muy estables y parece que el organismo humano tiene poca capacidad para eliminarlos. Sin embargo, los tratamientos que impiden la producción de nuevos amiloides, como la quimioterapia en la AL, pueden eliminar gradualmente los depósitos a diferentes ritmos específicos de cada órgano. El aclaramiento cardíaco es especialmente bajo y hasta ahora las pruebas de regresión son escasas. Actualmente se están investigando varias moléculas para acelerar el aclaramiento cardíaco del amiloide en la ATTR:
- –
La doxiciclina (un antibiótico de uso común) interrumpe la formación de fibrillas amiloides. Se ha demostrado que el efecto sinérgico de la doxiciclina combinada con el ácido biliar tauroursodesoxicólico (TUDCA), que se utiliza en el tratamiento de las enfermedades hepáticas, elimina los depósitos de TTR en modelos animales. Un estudio de fase II con 20 pacientes no mostró ninguna progresión cardiaca o neurológica tras 1 año de tratamiento con doxiciclina/TUDCA, con un perfil de seguridad y tolerabilidad aceptable.4 Otros estudios de fase II han intentado confirmar estos hallazgos utilizando la combinación de doxiciclina/TUDCA, doxiciclina/ácido ursodesoxicólico o doxiciclina sola.48-50 Los resultados preliminares de uno de estos estudios sugieren un efecto protector, con un menor empeoramiento de la función cardiaca debido a la tensión en el grupo de tratamiento. Otro de estos estudios obtuvo resultados similares en 40 pacientes con ATTR: los parámetros de NT-proBNP, clase funcional, FEVI y grosor miocárdico, entre otros, se mantuvieron estables a los 12 meses (tabla 2). No obstante, todos estos estudios tuvieron una elevada tasa de abandono (35%-44%), principalmente debido a efectos adversos, en particular hipersensibilidad al sol y molestias gastrointestinales (hasta un 30%)48-50
- –
El EGCG (galato de epigalocatequina-3) es la catequina más abundante en el té verde, y se ha demostrado in vitro y en un modelo murino que inhibe la formación de amiloide y elimina los depósitos existentes4. El CMRI demostró que la administración diaria de 600 mg de EGCG se asociaba a la estabilización de la masa ventricular izquierda en un grupo de 25 pacientes (Tabla 2).51
- –
El PRX004 es un anticuerpo monoclonal que actúa uniéndose a epítopos específicos de monómeros y a la TTR mal plegada. Así, provoca la eliminación de los depósitos mediante la activación de la fagocitosis.52 La base de su mecanismo de acción es similar a la de un anticuerpo utilizado en la AL. Los estudios de fase II de este anticuerpo están mostrando resultados prometedores. Está previsto que en 2017 comience un ensayo de fase I-II de este nuevo anticuerpo.
- –
Independientemente del tipo de proteína precursora del amiloide, todos los depósitos contienen el componente amiloide sérico P (SAP). Utilizando esta molécula como objetivo, se ha demostrado que los anticuerpos anti-SAP provocan una reacción mediada por macrófagos y dependiente del complemento que causó una importante eliminación de los depósitos amiloides viscerales en un modelo murino. El compuesto de bis-D-prolina CPHPC puede neutralizar el SAP plasmático, y la coadministración con IgG anti-SAP permite que el anticuerpo alcance los depósitos que contienen SAP en el tejido.53 Un estudio de fase I publicado en 2015 demostró la eliminación de los depósitos hepáticos en 15 pacientes con amiloidosis sistémica sin afectación cardíaca, con pocos efectos adversos.53 Un estudio de fase II de pacientes con amiloidosis cardíaca ATTR y AL está previsto que comience en 2017 (Tabla 2).
CONCLUSIONES
La amiloidosis cardíaca por transtiretina se diagnostica cada vez con mayor frecuencia. La gammagrafía con 99mTc-DPD y la RMC son ejemplos de técnicas que pueden utilizarse para la identificación sencilla y precoz de los pacientes con ATTR.
Varios fármacos específicos para ATTR se encuentran actualmente en las fases finales de investigación. Por lo tanto, creemos que la amiloidosis cardíaca ATTR pronto se considerará una entidad tratable y no una enfermedad mortal.
FINANCIACIÓN
Este trabajo se ha realizado con la ayuda parcial del Instituto de Salud Carlos III y de la Sociedad Española de Cardiología (beca de investigación 2016 a E. González-López). La ayuda del Instituto de Salud Carlos III está financiada por el Fondo Europeo de Desarrollo Regional «Otra forma de hacer Europa».
CONFLICTOS DE INTERÉS
E. González-López ha participado como ponente en actividades organizadas por Pfizer. P. García-Pavía ha recibido pagos como ponente en actividades organizadas por Pfizer y como consultor de Alnylam, Prothena y Pfizer. E. González-López, A. López-Sainz y P. Garcia-Pavia declaran que Pfizer ha financiado proyectos de investigación de su institución.