El elemento químico hidrógeno se clasifica como un no metal. Puede convertirse en metálico a presiones muy elevadas. Fue descubierto en 1766 por Henry Cavendish.

Zona de Datos
| Clasificación | El hidrógeno es un no metal. Puede convertirse en metálico a presiones muy altas. |
| Color | Incoloro |
| Peso atómico | 1.0079 |
| Estado | gas |
| Punto de fusión | -259,14 oC, 14,01 K |
| Punto de ebullición | -252,87 oC, 20.28 K |
| Electrones: | 1 |
| Protones: | 1 |
| Neutrones en el isótopo más abundante: | 0 |
| Capas de electrones | 1 |
| Configuración de electrones | 1s1 |
| Densidad a 20oC | 0.0000899 g/cm3 |
Mostrar más, incluyendo: Calores, Energías, Oxidación,
Reacciones, Compuestos, Radios, Conductividades
| Volumen atómico | 14.4 cm3/mol |
| Estructura | hcp: hexagonal cerrada (como sólido a bajas temperaturas) |
| Dureza | – |
| Capacidad calorífica específica | 14.304 J g-1 K-1 |
| Calor de fusión | 0,117 kJ mol-1 del H2 |
| Calor de atomización | 218 kJ mol-1 |
| Calor de vaporización | 0.904 kJ mol-1 de H2 |
| Primera energía de ionización | 1312 kJ mol-1 |
| Segunda energía de ionización | kJ mol-1 |
| Tercera energía de ionización | 11815.0 kJ mol-1 |
| Afinidad de los electrones | 72.7711 kJ mol-1 |
| Número mínimo de oxidación | -1 |
| Número mínimo de oxidación común | -1 |
| Número máximo de oxidación | 1 |
| Número máximo de oxidación común | 1 |
| Electronegatividad (escala de Pauling) | 2,18 |
| Volumen de polarizabilidad | 0.7 Å3 |
| Reacción con el aire | vigorosa, ⇒ H2O |
| Reacción con 15 M HNO3 | ninguna |
| Reacción con 6 M HCl | ninguna |
| Reacción con 6 M NaOH | ninguno |
| Óxido(s) | H2O |
| Hidruro(s) | H2 |
| Cloruro(s) | HCl |
| Radio atómico | 25 pm |
| Radio iónico (ion 1+) | – |
| Radio iónico (ion 2+) | – |
| Radio iónico (ion 3+) | – |
| Radio iónico (1- ion) | – |
| Radio iónico (2- ion) | – |
| Radio iónico (3- ion) | – |
| Conductividad térmica | 0.1805 W m-1 K-1 |
| Conductividad eléctrica | – |
| Punto de congelación/fusión: | -259,14 oC, 14,01 K |

Imagen de la NASA: Vastas cantidades de hidrógeno en galaxias remotas.

Teofrasto Paracelso – La primera persona que generó hidrógeno: «El aire surge y se desprende como un viento.»
Descubrimiento del hidrógeno
Un experimento de química escolar favorito es añadir un metal como el magnesio a un ácido. El metal reacciona con el ácido, formando una sal y liberando hidrógeno del ácido. El gas hidrógeno burbujea desde el líquido y los estudiantes lo recogen en pequeñas cantidades para otros experimentos, como la «prueba del estallido».
El primer caso registrado de hidrógeno producido por la acción humana fue en la primera mitad del siglo XVI, mediante un método similar al que se utiliza ahora en las escuelas.Theophrastus Paracelsus, un médico, disolvió hierro en ácido sulfúrico y observó la liberación de un gas. Se dice que dijo del experimento: «El aire surge y se desprende como un viento». Sin embargo, no descubrió ninguna de las propiedades del hidrógeno.(1)
Turquet De Mayerne repitió el experimento de Paracelso en 1650 y descubrió que el gas era inflamable.(2) Ni Paracelso ni De Mayerne propusieron que el hidrógeno pudiera ser un nuevo elemento. De hecho, Paracelso creía que sólo había tres elementos -la tria prima-, la sal, el azufre y el mercurio, y que todas las demás sustancias estaban hechas de diferentes combinaciones de estos tres. (3) (¡La química todavía tenía un largo camino que recorrer!)
En 1670, el científico inglés Robert Boyle añadió hierro al ácido sulfúrico. Demostró que el gas resultante (hidrógeno) sólo ardía si había aire y que una fracción del aire (que ahora llamaríamos oxígeno) se consumía en la combustión.(4)
El hidrógeno fue reconocido por primera vez como un elemento distinto en 1766 por el científico inglés Henry Cavendish, cuando lo preparó haciendo reaccionar ácido clorhídrico con zinc. Describió el hidrógeno como «aire inflamable de los metales» y estableció que era el mismo material (por sus reacciones y su densidad) independientemente del metal y del ácido que utilizara para producirlo.(1) Cavendish también observó que cuando la sustancia se quemaba, producía agua.
El científico francés Antoine Lavoisier nombró posteriormente al elemento hidrógeno (1783). El nombre proviene del griego «hydro», que significa agua, y «genes», que significa formación: el hidrógeno es uno de los dos elementos formadores de agua.
En 1806, con el hidrógeno bien establecido como elemento, el químico inglés Humphry Davy impulsó una fuerte corriente eléctrica a través del agua purificada.
Encontró que se formaban hidrógeno y oxígeno. El experimento demostró que la electricidad podía separar las sustancias en sus elementos constitutivos. Davy se dio cuenta de que las sustancias estaban unidas por un fenómeno eléctrico; había descubierto la verdadera naturaleza del enlace químico.(5)
Visita la página de datos sobre el hidrógeno de Chemicool.

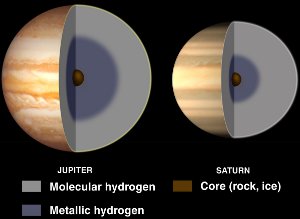
Interiores de Júpiter y Saturno, con hidrógeno metálico líquido. Cortesía de NASA/JPL-Caltech.

Nasa: El tanque de combustible externo del transbordador espacial (naranja) lleno de hidrógeno y oxígeno líquidos.

Los coches de hidrógeno emiten agua en lugar de contaminantes.

Electrólisis de laboratorio del agua. La energía eléctrica se utiliza para dividir el agua. El hidrógeno se reúne en una probeta y el oxígeno en la otra.
Aspecto y características
Efectos nocivos:
El hidrógeno es muy inflamable y tiene una llama casi invisible, que puede provocar quemaduras accidentales.
Características:
El hidrógeno es el elemento más simple de todos, y el más ligero. También es, con diferencia, el elemento más común del Universo. Más del 90% de los átomos del Universo son de hidrógeno.
En su forma más común, el átomo de hidrógeno está formado por un protón, un electrón y ningún neutrón. El hidrógeno es el único elemento que puede existir sin neutrones.
El hidrógeno es un gas incoloro e inodoro que existe, a temperatura y presión estándar, como moléculas diatómicas, H2.
Se quema y forma mezclas explosivas en el aire y reacciona violentamente con los oxidantes.
En la Tierra, la mayor localización del hidrógeno es en el agua, H2O. Hay poco hidrógeno libre en la Tierra porque el hidrógeno es tan ligero que no es retenido por la gravedad del planeta. Todo el hidrógeno que se forma acaba escapando de la atmósfera al espacio.
Aunque el hidrógeno es normalmente un no metal, se convierte en un metal líquido cuando se le aplican enormes presiones.
Tales presiones se encuentran dentro de los planetas gigantes gaseosos como Júpiter y Saturno. Se cree que el elevado campo magnético de Júpiter (14 veces el de la Tierra) se debe a un efecto dínamo resultante del hidrógeno metálico conductor de la electricidad que circula a medida que el planeta gira.
Usos del hidrógeno
Se utilizan grandes cantidades de hidrógeno en el proceso Haber (producción de amoníaco), la hidrogenación de grasas y aceites, la producción de metanol, el hidrocraqueo y la hidrodesulfuración. El hidrógeno también se utiliza en el refinado de metales.
El hidrógeno líquido se utiliza como combustible para cohetes, por ejemplo para impulsar el despegue y la puesta en órbita del transbordador espacial. El hidrógeno líquido y el oxígeno se encuentran en el gran tanque de combustible externo del transbordador. (Ver imagen de la izquierda.)
Los dos isótopos más pesados del hidrógeno (deuterio y tritio) se utilizan en la fusión nuclear.
La economía del hidrógeno se ha propuesto como sustituto de nuestra actual economía basada en los hidrocarburos (petróleo, gas y carbón).
La base de la economía del hidrógeno es que la energía se produce cuando el hidrógeno entra en combustión con el oxígeno y el único subproducto de la reacción es el agua.
Por el momento, sin embargo, el hidrógeno para los coches impulsados por hidrógeno se produce a partir de hidrocarburos. Sólo cuando las energías solar o eólica, por ejemplo, puedan utilizarse comercialmente para dividir el agua en hidrógeno y oxígeno, será posible una verdadera economía del hidrógeno.
Abundancia e isótopos
Abundancia corteza terrestre: 1400 partes por millón en peso (0,14%), 2,9% en moles
Abundancia sistema solar: 75% en peso, 93% en moles
Costo, puro: $12 por 100g
Costo, a granel: $ por 100g
Fuente: El hidrógeno se prepara comercialmente haciendo reaccionar vapor sobrecalentado con metano o carbono. En el laboratorio, el hidrógeno puede producirse por la acción de ácidos sobre metales como el zinc o el magnesio, o por la electrólisis del agua (mostrada a la izquierda).
Isótopos: El hidrógeno tiene tres isótopos, 1H (protio), 2H (deuterio) y 3H (tritio). Sus dos isótopos más pesados (deuterio y tritio) se utilizan para la fusión nuclear. El protio es el isótopo más abundante y el tritio el menos abundante. El tritio es inestable, con una vida media de unos 12 años y 4 meses. El hidrógeno natural es una mezcla de los dos isótopos 1H y 2H con abundancias naturales del 99,99% y 0,01% respectivamente.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen, (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s «The Sceptical Chymist».
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Cite esta página
Para enlazarla en línea, copie y pegue uno de los siguientes elementos:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
o
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Para citar esta página en un documento académico, utilice la siguiente cita conforme a la MLA:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.