Propiedades químicas del ciclopentano,usos,producción
Propiedades físicas y químicas
El ciclopentano, también conocido como «pentametileno», es un tipo de cicloalcano con la fórmula C5H10. Tiene un peso molecular de 70,13. Existe como un tipo de líquido inflamable. Tiene un punto de fusión de 94,4 °C, un punto de ebullición de 49,3 °C, una densidad relativa de 0,7460 y un índice de refracción de 1,4068. Es soluble en alcohol, éter e hidrocarburos y no es soluble en agua. El ciclopentano no es un anillo plano y tiene dos conformaciones: conformaciones envolventes y conformaciones semicabeza. El ángulo de enlace carbono-carbono-carbono es cercano a 109 ° 28 ‘ con la tensión molecular no grande y el anillo es relativamente estable. Tiene una propiedad química similar a la de los alcanos. La concentración letal en el aire para las ratas fue de 3,8 × 10-2. Presenta un color amarillo rojizo al reaccionar con ácido sulfúrico fumante, mientras que genera nitrociclopentano y ácido glutárico por reacción con ácido nítrico. Método: puede obtenerse a partir del destilado de éter de petróleo, mediante el craqueo a alta presión del ciclohexano en presencia de aluminio o la hidrogenación catalítica del ciclopenteno y el ciclopentadieno. Propósitos: se utiliza principalmente como disolvente.
Figura 1 la estructura del ciclopentano.
Cicloalcano
Los cicloalcanos son hidrocarburos saturados en los que los átomos de carbono de la molécula están dispuestos en un anillo y se combinan un número suficiente de átomos de hidrógeno. Los cicloalcanos que se presentan en el petróleo son principalmente el ciclopentano y el ciclohexano.
Los cicloalcanos tienen un punto de fusión, un punto de ebullición y una densidad relativa mayores que los correspondientes alcanos de cadena recta. Podemos utilizar el petróleo crudo aromático nafténico para producir gasolina de alto octanaje de cadena recta, siendo su antiexplosión mejor que la de la parafina normal. El petróleo crudo nafténico con bajo contenido de azufre, no sólo es fácil de procesar, sino también una excelente materia prima para la producción de lubricantes avanzados. El petróleo que contiene relativamente muchos compuestos nafténicos policíclicos de cadena lateral larga es un material ideal para los lubricantes de alta calidad.
A temperatura ambiente y presión atmosférica, los cicloalcanos que contienen cuatro o menos átomos de carbono se encuentran en forma de gas, mientras que los que contienen más de cuatro carbonos existen en forma líquida. El ciclopropano y el ciclobutano aparecen en forma de gas, el ciclopentano hasta el cicloundecano aparecen en forma líquida; el ciclododecano y superiores aparecen en forma sólida.
La naturaleza química del cicloalcano está relacionada con el número de átomos de carbono que forman el anillo. Se denomina anillo de tres miembros y anillo de cuatro miembros, como anillo pequeño; el anillo de cinco a siete miembros como anillo normal; el anillo de ocho a once como anillo normal; el anillo de doce miembros y superior como anillo grande. Las líneas de los núcleos de carbono en los anillos pequeños no coinciden con el eje del orbital de enlace. En el ciclopropano, el anillo formado por las líneas de los núcleos de los átomos de carbono es un triángulo equilátero en el que cada ángulo es de 60°, mientras que el ángulo del eje del orbital híbrido sp3 de los enlaces simples carbono-carbono formado por cada carbono es de 104° (véase la figura 2 a continuación). Por lo tanto, el orbital no ha conseguido el mayor grado de solapamiento, lo que provoca una gran tensión angular. El ciclobutano también tiene tensión angular, pero siendo menor. Esto lleva a la poca estabilidad del anillo pequeño, causando su propiedad química similar a las olefinas que pueden tener reacción de adición de apertura de anillo con muchos reactivos. El otro anillo tiene menos o ninguna tensión angular. Los cicloalcanos y los alcanos tienen propiedades químicas similares, son menos propensos a tener reacciones de apertura de anillos como la reacción con el hidrógeno. El ciclohexano y el cicloalcano superior son más difíciles de sufrir la hidrogenación.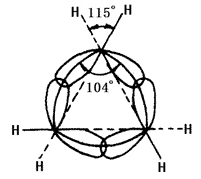
La figura 2 es una representación esquemática del solapamiento de los orbitales de hibridación sp3 en el ciclopropano.
El ciclopropano (a temperatura ambiente) y el ciclobutano (en las condiciones de calentamiento) pueden tener reacciones de adición con halógenos y haluros de hidrógeno.
El anillo abierto se produce entre los dos átomos que conectan el mayor y el menor número de hidrógeno. La adición satisface la regla markoviana. Mientras que el anillo normal, bajo la estimulación de la luz o el calor puede tener reacción de sustitución con el halógeno.
A temperatura ambiente, el cicloalcano no puede ser oxidado por el permanganato de potasio.
El ciclopentano, el ciclohexano y sus productos sustituidos con alquilo se presentan en ciertos aceites de petróleo. Los cicloalcanos también pueden sintetizarse por métodos adecuados, como la ciclización de dihaloalcanos y la hidrogenación de hidrocarburos aromáticos.
Esta información ha sido editada por Xiaonan de Chemicalbook (2015-08-17).
Situación de peligro
La ingestión y la inhalación son moderadamente tóxicas. (2) Ser inflamable con mayor riesgo de combustión. La concentración permitida en el aire es de 600ppm (1720mg/m3) en Estados Unidos.
Efectos nocivos y síntomas de envenenamiento
La inhalación de altas concentraciones de ciclopentano puede provocar la inhibición del sistema nervioso central, aunque su toxicidad aguda es baja. Los síntomas de la exposición aguda incluyen excitación al principio, seguida de la aparición de trastornos del equilibrio, e incluso estupor, coma. Raramente se dan casos de muerte por insuficiencia respiratoria. Se ha informado de que los animales alimentados con esta mercancía pueden sufrir una diarrea severa, lo que provoca un colapso vascular del corazón, los pulmones y el hígado y una degeneración cerebral.
Medidas de protección
Puede utilizarse para mejorar el equipo de producción. Utilizar cremas protectoras de la piel o guantes para proteger la piel.
Cuidados médicos
Tras un examen físico regular, prestar atención al efecto potencial de irritación de la piel y las vías respiratorias, así como a cualquier complicación del riñón y el hígado.
Requisitos de transporte
Líquido inflamable de grado I. Código de Reglamentos de Peligrosidad: 61013. El recipiente deberá estar marcado con una marca de «líquido inflamable» en el transporte.
Agente extintor
Ver «ciclohexano».
Métodos recomendados de eliminación de residuos
Incineración;
Propiedades químicas
Se presenta como un líquido incoloro con un punto de fusión de-93,9 °C, el punto de ebullición de 49,26 ° C, la densidad relativa de 0,7460 (20/4 ° C), el índice de refracción de 1,4068 y el punto de inflamación de-37 °C. Es miscible con alcohol, éter y otros disolventes orgánicos, no siendo fácil de disolver en agua.
Usos
(1) Puede utilizarse como disolvente para la polimerización en solución de caucho de poliisopreno y éter de celulosa. Puede utilizarse como sustituto del freón como material aislante en frigoríficos y congeladores, así como agente espumante para otras espumas duras de PU, y como patrón de análisis cromatográfico.
(2) Se utiliza como sustancia patrón para análisis cromatográfico, disolventes, combustibles para motores, agentes de destilación azeotrópica.
Método de producción
El ciclopentano es un componente del éter de petróleo en el rango de punto de ebullición de 30-60 °C cuyo contenido es generalmente del 5% al 10%. Se aplica la destilación atmosférica; a una relación de reflujo de 60: 1 y se lleva a cabo en una torre de 8 m de altura; primero se destila el isopentano y el n-pentano; se continúa el fraccionamiento para obtener un ciclopentano con una pureza superior al 98%. El ciclopentano también puede obtenerse mediante reducción de ciclopentanona o hidrogenación catalítica de ciclopentadieno.
Peligros &Información de seguridad
Categoría Líquidos inflamables
Grado de toxicidad: Baja toxicidad
Toxicidad aguda: DL50 oral-rata: 11400 mg/kg; DL50 oral-ratón: 12800 mg/kg
Propiedad peligrosa de los explosivos: ser explosivo al mezclarse con el aire
Inflamabilidad y situaciones peligrosas: ser inflamable en caso de incendio, alta temperatura y oxidante con combustión liberando humo irritante
Características de almacenamiento: Almacén: ventilado, baja temperatura y seco; Almacénelo con oxidante por separado
Agente extintor: Polvo seco, dióxido de carbono, espuma, agente extintor 1211
Norma ocupacional: TWA 1720 mg/m3; STEL 2150 mg/kg
Propiedades químicas
Líquido incoloro con olor a petróleo
Propiedades químicas
El ciclopentano es un líquido incoloro.
Propiedades físicas
Líquido incoloro, móvil e inflamable con un olor parecido al ciclohexano.
Usos
El ciclopentano es un producto del petróleo. Se forma a partir del craqueo catalítico a alta temperatura del ciclohexano o por reducción del ciclopentadieno. Se encuentra en fracciones de éter de petróleo y en muchos disolventes comerciales, y se utiliza como disolvente para la pintura, en la extracción de cera y grasa, y en la industria del calzado.
Usos
Como reactivo de laboratorio; en la fabricación de productos farmacéuticos; se encuentra en los disolventes y en el éter de petróleo; agente presurizador de propulsores.
Métodos de producción
El ciclopentano se encuentra en fracciones de éter de petróleo y se prepara por craqueo de ciclohexano en presencia de alúmina a alta temperatura y presión o por reducción de ciclopentadieno.
Definición
ChEBI: Un cicloalcano que consta de cinco carbonos unidos cada uno con dos hidrógenos por encima y por debajo del plano. El padre de la clase de los ciclopentanos.
Descripción general
Líquido transparente e incoloro con olor a petróleo. Punto de inflamación de -35°F. Menos denso que el agua e insoluble en agua. Los vapores son más pesados que el aire.
Aire &Reacciones en el agua
Altamente inflamable. Insoluble en agua.
Perfil de reactividad
El CICLOPENTANO es incompatible con agentes oxidantes fuertes como el cloro, el bromo, el flúor. .
Peligro para la salud
La inhalación provoca mareos, náuseas y vómitos; los vapores concentrados pueden provocar pérdida de conocimiento y colapso. El vapor provoca un ligero escozor en los ojos. El contacto con el líquido causa irritación de los ojos y puede irritar la piel si se deja. La ingestión causa irritación del estómago. La aspiración produce irritación pulmonar severa y edema pulmonar de rápido desarrollo; excitación del sistema nervioso central seguida de depresión.
Peligro para la salud
El ciclopentano es un tóxico poco agudo. Su exposición a altas concentraciones puede producir depresión del sistema nervioso central con síntomas de excitabilidad, pérdida de equilibrio, estupor y coma. Puede producirse un fallo respiratorio en ratas a partir de 30-60 minutos de exposición a 100.000-120.000 ppm en el aire. Es un irritante para el tracto respiratorio superior, la piel y los ojos. No hay información disponible en la literatura sobre los efectos crónicos de la exposición prolongada al ciclopentano.
Peligro de incendio
Comportamiento en caso de incendio: Los contenedores pueden explotar.
Reactividad química
Reactividad con el agua Ninguna reacción; Reactividad con materiales comunes: Ninguna reacción; Estabilidad durante el transporte: Estable; Agentes neutralizadores de ácidos y cáusticos: No pertinente; Polimerización: No pertinente; Inhibidor de la polimerización: No pertinente.
Perfil de seguridad
Ligeramente tóxico por ingestión e inhalación. Altas concentraciones tienen acción narcótica. Es un riesgo de incendio muy peligroso cuando se expone al calor o a las llamas; puede reaccionar con los oxidantes. Para combatir el fuego, utilizar espuma, CO2, producto químico seco. Cuando se calienta hasta su descomposición emite humo y vapores acres.
Exposición potencial
El ciclopentano se utiliza como disolvente.
Fuente
Componente de la gasolina de alto octanaje (citado, Verschueren, 1983). Harley et al. (2000) analizaron los vapores del espacio de cabeza de tres grados de gasolina sin plomo a los que se añadió etanol para sustituir al metil tert-butil éter. Se detectó ciclopentano en una concentración idéntica de 1,4% en peso en los vapores del espacio de cabeza de los grados normal, medio y superior.
Schauer et al. (1999) informaron de la presencia de ciclopentano en los gases de escape de un camión mediano con motor diesel con una tasa de emisión de 410 μg/km.
La gasolina reformulada Fase II de California contenía ciclopentano en una concentración de 4,11g/kg. Las tasas de emisión del tubo de escape de los automóviles de gasolina con y sin convertidores catalíticos fueron de 0,78 y 85,4 mg/km, respectivamente (Schauer et al., 2002).
Destino ambiental
Biológico. El ciclopentano puede ser oxidado por microbios a ciclopentanol, que puede oxidarse a ciclopentanona (Dugan, 1972).
Fotolítica. Se informaron las siguientes constantes de velocidad para la reacción del octano y los radicales OH en la atmósfera: 3,7 x 10-12 cm3/molécula?s a 300 K (Hendry y Kenley, 1979); 5,40x 10-12 cm3/molécula?s (Atkinson, 1979); 4,83 x 10-12 cm3/molécula?s a 298 K (DeMore yBayes, 1999); 6,20 x 10-12, 5,24 x 10-12 y 443 x 10-12 cm3/molécula-segundo a 298, 299 y 300 K, respectivamente (Atkinson, 1985), 5,16 x 10-12 cm3/molécula-segundo a 298 K (Atkinson, 1990) y 5,02x 10-12 cm3/mol-segundo a 295 K (Droege y Tilly, 1987).
Química/Física. El ciclopentano no se hidroliza porque no tiene ningún grupo funcional hidrolizable. La combustión completa en el aire produce dióxido de carbono y agua.
A temperaturas elevadas, se produce la ruptura del anillo formando etileno y presumiblemente aleno e hidrógeno (Rice y Murphy, 1942).
Envío
UN1146 Ciclopentano, Clase de peligro: 3; Etiquetas:3-Líquido inflamable.
Métodos de purificación
Libérelo del ciclopenteno mediante dos pases a través de una columna de gel de sílice activado cuidadosamente secado y desgasificado. Se encuentra en el petróleo y es ALTAMENTE INFLAMABLE.
Incompatibilidades
Puede formar una mezcla explosiva con el aire.Puede acumular cargas eléctricas estáticas, y puede provocar la ignición de sus vapores. El contacto con oxidantes fuertes puede causar fuego y explosión.
Eliminación de residuos
Disolver o mezclar el material con un disolvente combustible y quemarlo en un incinerador químico equipado con postcombustión y depurador. Deben cumplirse todas las normas medioambientales federales, estatales y locales.