Un aducto (del latín adductus, «atraído hacia», alternativamente, una contracción de «producto de adición») es un producto de una adición directa de dos o más moléculas distintas, que da lugar a un único producto de reacción que contiene todos los átomos de todos los componentes. El resultante se considera una especie molecular distinta. Los ejemplos incluyen la adición de bisulfito de sodio a un aldehído para dar un sulfonato. Puede considerarse simplemente como un producto único resultante de la combinación directa de diferentes moléculas que comprende todos los átomos de las moléculas reaccionantes.
Los aductos se forman a menudo entre ácidos de Lewis y bases de Lewis. Un buen ejemplo es la formación de aductos entre el ácido de Lewis borano y el átomo de oxígeno de las bases de Lewis, tetrahidrofurano (THF): BH3-O(CH2)4 o éter dietílico: BH3-O(CH3CH2)2. En el modelo ECW se han examinado muchos ácidos y bases de Lewis que reaccionan en fase gaseosa o en disolventes no acuosos para formar aductos. El trimetilboro, el cloruro de trimetilestaño y el bis(hexafluoroacetilacetonato)cobre(II) son ejemplos de ácidos de Lewis que forman aductos que presentan efectos estéricos. Por ejemplo: el cloruro de trimetilestaño, al reaccionar con éter dietílico, presenta repulsión estérica entre los grupos metilo del Sn y los grupos etilo del oxígeno. Pero cuando la base de Lewis es el tetrahidrofurano, la repulsión estérica se reduce. El modelo ECW puede proporcionar una medida de estos efectos estéricos.
-
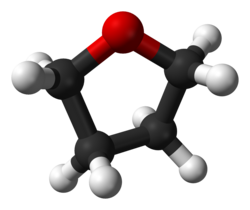
Molécula de THF
-
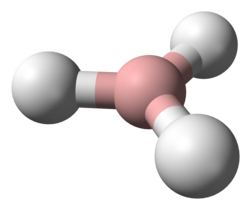
Molécula de BH3
-
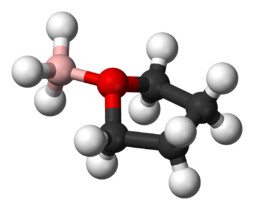
Aducto de Lewis entre el BH3 y el THF
Los compuestos o mezclas que no pueden formar un aducto debido al impedimento estérico se llaman pares de Lewis frustrados.
Los aductos no son necesariamente de naturaleza molecular. Un buen ejemplo de la química del estado sólido son los aductos de etileno o monóxido de carbono de CuAlCl4. Este último es un sólido con una estructura de red extendida. Al formarse el aducto, se forma una nueva fase extendida en la que las moléculas de gas se incorporan (se insertan) como ligandos de los átomos de cobre dentro de la estructura. Esta reacción también puede considerarse como una reacción entre una base y un ácido de Lewis con el átomo de cobre en el papel de receptor de electrones y los electrones pi de la molécula de gas en el papel de donador de electrones.


