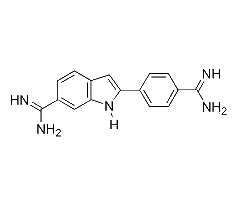
 Esta página resume los datos de absorción y emisión óptica de 4′,6-Diamidino-2-fenilindol, que están disponibles en el paquete PhotochemCAD, versión 2.1a (Du 1998, Dixon 2005). He reelaborado sus datos para producir estos gráficos interactivos y proporcionar enlaces directos a los archivos de texto que contienen los datos brutos y manipulados. Aunque he intentado ser cuidadoso, es posible que haya introducido algunos errores; se recomienda al usuario precavido que compare estos resultados con las fuentes originales.
Esta página resume los datos de absorción y emisión óptica de 4′,6-Diamidino-2-fenilindol, que están disponibles en el paquete PhotochemCAD, versión 2.1a (Du 1998, Dixon 2005). He reelaborado sus datos para producir estos gráficos interactivos y proporcionar enlaces directos a los archivos de texto que contienen los datos brutos y manipulados. Aunque he intentado ser cuidadoso, es posible que haya introducido algunos errores; se recomienda al usuario precavido que compare estos resultados con las fuentes originales.
Puede cambiar el tamaño de cualquiera de los gráficos haciendo clic y arrastrando un rectángulo. Si pasa el ratón por encima del gráfico, verá una ventana emergente que muestra las coordenadas. Uno de los iconos de la esquina superior derecha le permitirá exportar el gráfico en otros formatos.
Absorción
Esta medición de la absorción óptica del 4′,6-Diamidino-2-fenilindol, fue realizada por R.-C. A. Fuh en el verano de 1997 utilizando un Cary 3. Los valores de absorción se recogieron utilizando un ancho de banda espectral de 1,0 nm, un tiempo de promediación de la señal de 0,133 s, un intervalo de datos de 0,25 nm y una velocidad de exploración de 112,5 nm/min.
Estas mediciones se escalaron para que el coeficiente de extinción molar coincidiera con el valor de 27.000cm-1/M a 3440nm (Haugland, 1992).
Datos originales |Datos de extinción
Fluorescencia
El espectro de emisión de fluorescencia del 4′,6-Diamidino-2-fenilindol, disuelto en agua. La longitud de onda de excitación fue de 350 nm. El rendimiento cuántico de esta molécula es de 0,043 (HÃÂärd, 1990).Este espectro fue recogido por en el verano de 1997 utilizando un Spex FluoroMax. Los monocromadores de excitación y emisión se ajustaron a 1 mm, dando un ancho de banda espectral de 4,25 nm. El intervalo de datos fue de 0,5 nm y el tiempo de integración fue de 2,0 seg.
Las muestras se prepararon en celdas de cuarzo de 1 cm de longitud de trayecto con una absorbencia inferior a 0,1 en la excitación y en todas las longitudes de onda de emisión para iluminar uniformemente toda la muestra y evitar el efecto de filtro interior. Se restaron los recuentos oscuros y se corrigieron los espectros para tener en cuenta la sensibilidad del instrumento dependiente de la longitud de onda.
Datos originales |Datos de emisión
Notas
No pudimos registrar un espectro de fluorescencia, por lo que no se incluye ningún archivo.
Dixon, J. M., M. Taniguchi y J. S. Lindsey (2005), «PhotochemCAD 2. A Refined Program with Accompanying Spectral Databases for Photochemical Calculations, Photochem. Photobiol, 81, 212-213.
Du, H., R.-C. A. Fuh, J. Li, L. A. Corkan y J. S. Lindsey (1998) PhotochemCAD: Una herramienta de diseño e investigación asistida por ordenador en fotoquímica. Photochem. Photobiol. 68, 141-142.
Haugland, R. P. (1992-1994) Molecular Probes. Handbook of Fluorescent Probes and Research Chemicals.
HÃÂärd, T., P. Fan y D. R. Kearns (1990) A fluorescence study of the binding of Hoechst 33258 and DAPI to halogenated DNAs. Photochem. Photobiol. 51, 77-86.