El principio más general que rige la fuerza de los ácidos puede enunciarse así: los ácidos fuertes tienen bases conjugadas relativamente estables. En general, cuanto más estable sea la base conjugada, más fuerte será el ácido. Es importante recordar que la estabilidad y la reactividad son inversas. Cuanto más estable es una sustancia, menos reactiva es, y viceversa. Por lo tanto, otra forma de enunciar la regla anterior es decir que los ácidos fuertes tienen bases conjugadas débiles. HCl y H3O+ son ácidos fuertes. En consecuencia, las bases conjugadas correspondientes, Cl- y H2O, son débiles (muy estables). El ion cloruro es estable porque la carga negativa reside en un átomo muy electronegativo. La molécula de agua es una de las sustancias más estables que se conocen.
¿Cómo sabemos qué protón es el más ácido en una molécula (como el ácido acético) que contiene más de un tipo de protón? Recuerda que cuanto mayor sea el grado de carácter positivo del protón, más ácido es. El examen de una tabla de pKa revela algunas tendencias para los protones ácidos. Las siguientes pautas pueden utilizarse para predecir la acidez.
1. Los hidrógenos directamente unidos a átomos muy electronegativos como el oxígeno, el azufre y los halógenos conllevan un grado sustancial de acidez.
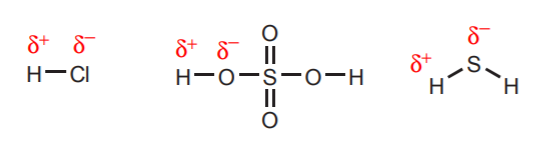
2. Los hidrógenos unidos a un nitrógeno, oxígeno o azufre con carga positiva son ácidos. La alta electronegatividad de estos átomos hace que se sientan incómodos con la carga positiva. Buscan difundir la carga entre los átomos vecinos retirándoles la densidad de electrones. Esto puede demostrarse dibujando estructuras de resonancia como las que se muestran.
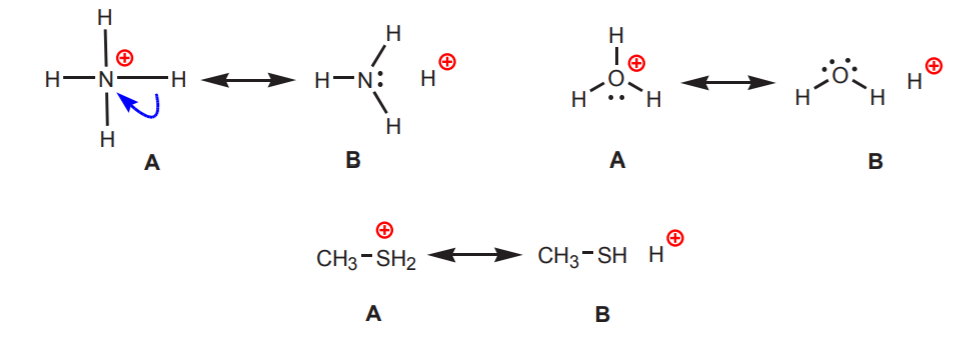
En todos los casos la estructura B revela el carácter positivo del hidrógeno, y por tanto su naturaleza ácida.
3. Como demuestran los valores de pKa de los alcanos y alquenos, los hidrógenos unidos al carbono son de muy baja acidez. Normalmente, estas sustancias no se consideran ácidos en absoluto. Sin embargo, algunos hidrocarburos pueden ser débilmente ácidos si sus bases conjugadas son iones estables. Esto puede ocurrir en los siguientes casos.
a) Hay uno o más átomos electronegativos cerca del protón considerado. El efecto inductor de estos átomos electronegativos deja a los hidrógenos de la vecindad privados de densidad electrónica y, por tanto, con carácter positivo parcial.
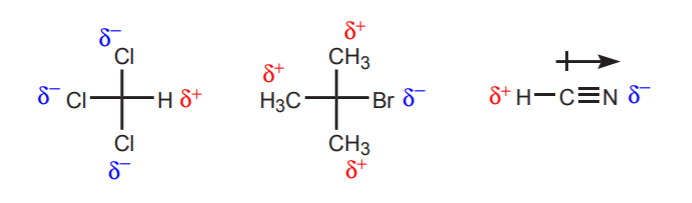
b) Un átomo de hidrógeno unido a un carbono que, a su vez, está unido a otro carbono que lleva una carga positiva parcial o total es ácido.
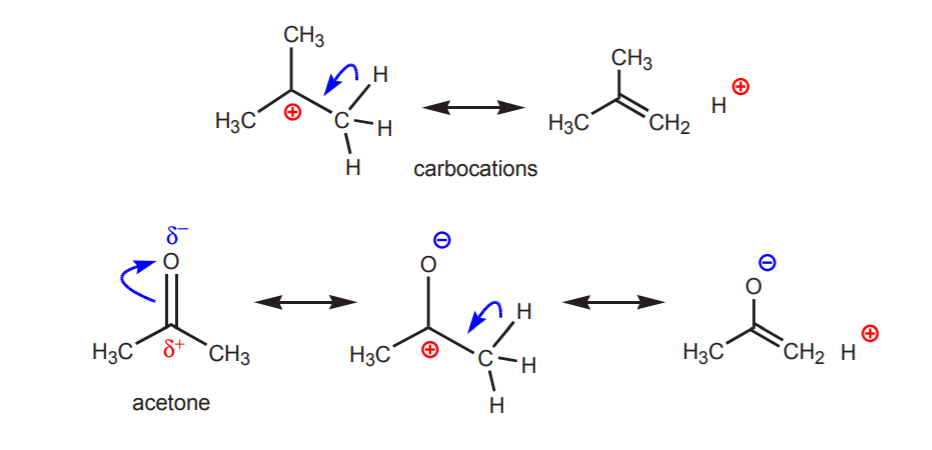
La acidez de los protones mostrados se pone de manifiesto en las reacciones de eliminación (capítulo 6) y en la química de los enoles (capítulo 22), cuando la presencia de una base conduce a la formación de alquenos o iones enolato a través de un paso que implica una transferencia de protones.
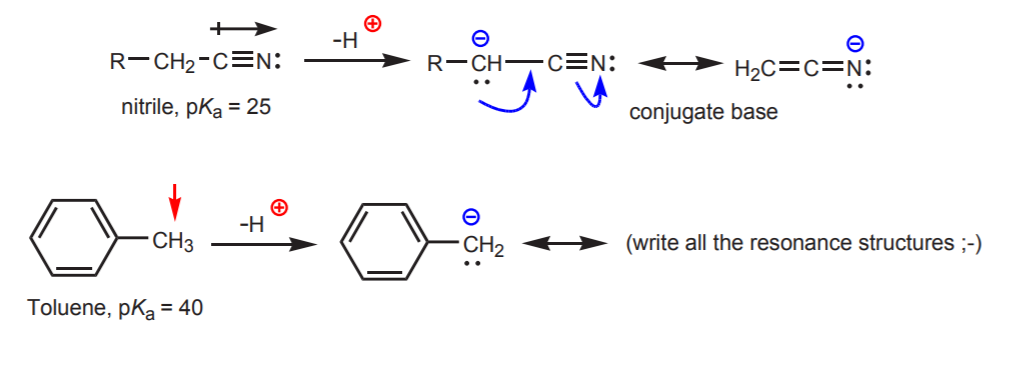
c) La base conjugada está estabilizada por resonancia. Este efecto es más importante cuando hay otro factor que aumenta la acidez, como la presencia de un dipolo o un átomo electronegativo (como en el grupo funcional nitrilo, -CN). De lo contrario, la estabilización por resonancia no es suficiente para aumentar drásticamente la acidez de un hidrógeno unido al carbono (como en el tolueno, donde el pKa es sólo 40).
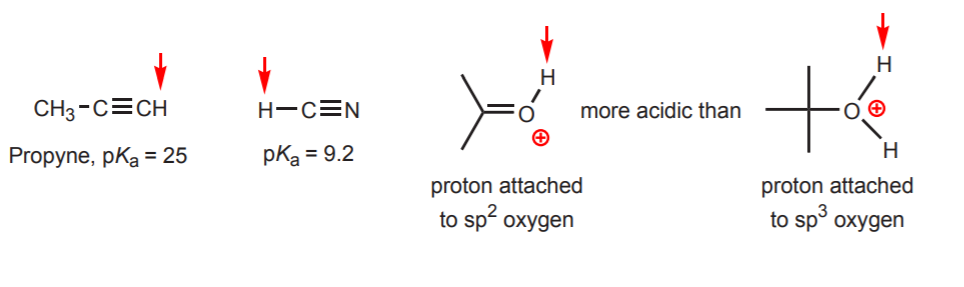
d) El hidrógeno está unido a un carbono hibridado. Los efectos de la hibridación en la acidez se discuten en el capítulo 9. Las tendencias de hibridación pueden extenderse al oxígeno y al nitrógeno además del carbono, como en el ejemplo de la derecha.