ÚVOD
Amyloidóza je depozitní onemocnění způsobené extracelulárním hromaděním fibril, jejichž zdrojem jsou proteiny s nestabilní strukturou, které se skládají, agregují a podléhají depozici.1 Takové ukládání může změnit strukturu tkání a zhoršit funkci různých orgánů a systémů.2
Amyloidní fibrily jsou nerozpustné a odolné vůči proteolýze a obvykle se barví konžskou červení a v polarizovaném světle vykazují intenzivní žlutozelený dvojlom.3 Více než 30 proteinů může způsobovat ukládání amyloidu, ale pouze 5 z nich způsobuje významné ukládání v srdeční tkáni1:
- –
Světelné řetězce, které způsobují primární amyloidózu (AL).
- –
Transtyretin (TTR), který způsobuje TTR amyloidózu (ATTR).
- –
Apolipoprotein A.
- –
Fibrinogen.
- –
Sérový amyloid-protein A, který způsobuje sekundární amyloidózu.
Primární amyloidóza a ATTR jsou nejčastější formy srdeční amyloidózy, přičemž AL forma je historicky považována za častější ve vyspělých zemích.3
Většina informací o srdeční amyloidóze byla založena na AL. Avšak přestože počet pacientů s AL zůstává stabilní, počet diagnóz ATTR se v poslední době zvýšil a nyní se předpokládá, že ATTR může být mnohem častější než AL.2
Transtyretinová amyloidóza byla velmi často předmětem chybné diagnózy nebo značných prodlev do jejího správného stanovení. Mezi důvody patří heterogenita jejích forem, nutnost histologického potvrzení, nedostatek specializovaného vybavení a mylné přesvědčení některých kardiologů, že se jedná o vzácné onemocnění bez možností léčby.2,3
Tyto aspekty se však mění. Stanovení diagnózy má důsledky pro léčbu pacientů. Byly vyvinuty specifické léčebné postupy, které mohou oddálit nebo stabilizovat ukládání a které jsou účinnější v časných stadiích. Včasná diagnóza má proto zásadní význam. Tento přehled popisuje významné nedávné pokroky v diagnostice a léčbě ATTR a nabízí naději pro pacienty s tímto onemocněním.
TRANSTHYRETINOVÁ KARDIATICKÁ AMYLOIDÓZA
Transthyretin je tetramerní plazmatický protein zodpovědný za transport tyroxinu a bílkovin vázaných na retinol. Primárně je syntetizován v játrech a sekundárně v cévnatkovém plexu a pigmentovém epitelu sítnice.4
Transtyretin má tendenci disociovat na dimery a monomery, které se nesprávně sestavují do fibril a podléhají ukládání. Bodové mutace nebo vliv věku mohou tuto tendenci zvýšit, čímž vznikají 2 klinické formy ATTR: mutantní (ATTRm) a divoký typ (ATTRwt).
MUTANTNÍ AMYLOIDÓZA TRANSTYRETINU
V současné době je známo více než 120 mutací způsobujících ATTRm. Tyto mutace vykazují autozomálně dominantní vzorec dědičnosti s různou penetrancí.4 Vzhledem k velké geografické rozmanitosti je obtížné stanovit prevalenci ATTR, ale považuje se za vzácné onemocnění s prevalencí menší než 1/100 000 obyvatel2 (tabulka 1).
Hlavní klinické a diagnostické charakteristiky mutantních a divoce žijících pacientůTransthyretinového typu srdeční amyloidózy
| ATTRwt | ATTRm | |
|---|---|---|
| Prevalence | Neznámá. Zřejmě velmi častý | |
| Genetická studie | Přítomnost mutací v TTR | Mutace v TTR |
| Typický věk při prezentaci | > 60 let | Různé podle příčinné mutace |
| Pohlaví | Převaha mužů. 80 % pacientů | Mužská převaha, s agresivnějším fenotypem |
| Extrakardiální projevy | – Syndrom karpálního tunelu (33-49 %) – Lumbální spinální stenóza – Traumatická ruptura bicepsové šlachy (32 %) |
– Ascendentní bilaterální senzomotorická polyneuropatie – Dysautonomie: ortostatická hypotenze, průjem-zácpa, erektilní dysfunkce – Postižení očí: glaukom, intravitreální depozice, hřebenovité zornice |
| Postižení srdce | Konstantní | Různé podle příčinné mutace |
| Srdeční výkon | – Srdeční selhání (53-86 %) – Poruchy vedení – AF (43 %-67%) – Degenerativní AoS |
– Poruchy vedení – Srdeční selhání – Nečastá AF (10%) |
| Diagnostické techniky | ||
| EKG | – Pseudoinfarktový obraz (63%-.66%) – Nízké napětí (22%-33%) – Sokolova LVH (6%-13%) |
– Pseudoinfarktový vzor (18%-69%) – Nízké napětí (2%-25%) – Sokolova LVH (3%-8%) |
| ECHO | – Středně těžká hypertrofie – Mírná-středně těžká deprese LVEF (30%) |
– Středně těžká hypertrofie – LVEF, obvykle zachovalá |
| MRI srdce | – Pozdní enhancement – Zvýšené nativní T1 a EV |
|
| 99mTc DPD scintigrafie | – Stupeň 2-3 | – Stupeň 0: Stupeň 1: počáteční postižení srdce – Stupeň 2-3: |
AF, fibrilace síní; AoS, aortální stenóza; ATTRm, mutantní transtyretinová amyloidóza; ATTRwt, transtyretinová amyloidóza divokého typu; EKG, elektrokardiogram; ECO, echokardiogram; EV, extracelulární objem; LVEF, ejekční frakce levé komory; LVH, hypertrofie levé komory; TTR, transtyretin.
První mutace TTR byly popsány jako familiární amyloidní polyneuropatie (nebo Andradeho nemoc), a proto byla ATTRm donedávna považována za neurologické onemocnění. Nejnovější poznatky však ukazují postižení srdce ve více než polovině případů.3
Existuje silná korelace mezi genotypem a fenotypem, přičemž mutace jsou spojeny s čistě neurologickým onemocněním nebo čistě srdečním onemocněním.3 Rozdělení ATTRm na kardiální nebo neurologické onemocnění však může být přílišným zjednodušením, protože obě klinické formy se ve spektru onemocnění značně překrývají.
Mutace Val30Met (nyní známá jako Val50Met poté, co bylo k tradičnímu názvu mutace v ATTRm přidáno 20 pozic) je celosvětově nejčastější mutací a je endemická v Portugalsku, Japonsku a Švédsku. Její výskyt v Portugalsku se odhaduje na 1 případ na 538 obyvatel.2 Za oblasti s endemickým výskytem ATTRm se považují také Mallorca (Španělsko) a Valverde del Camino (Huelva, Španělsko). Odhadovaná prevalence na Mallorce u symptomatických pacientů je 3/100 000 obyvatel.5
Mutace Val30Met způsobuje převážně neurologické onemocnění se symetrickou senzomotorickou polyneuropatií, která začíná v dolních končetinách a má vzestupný průběh. Může být spojena s dysautonomií s ortostatickou hypotenzí, erektilní dysfunkcí, močovou inkontinencí a gastrointestinálními příznaky. Obvykle začíná na konci druhé nebo třetí dekády života a až 43 % pacientů má postižení srdce, které je častou příčinou úmrtí4 (tabulka 1).
Zvláštní význam má mutace Val122Ile (p. Val142Ile), která se vyskytuje u 3 až 4 % černošské populace v Severní Americe.3 Ačkoli je její penetrance neúplná,3 tato mutace je spojena se 47% zvýšením rizika vzniku srdečního selhání (SS).6 Nedávná studie ukázala, že amyloidóza Val122Ile je čtvrtou nejčastější příčinou SS u britské afrokaribské populace.7 Ačkoli až 30 % pacientů s touto mutací může mít rysy mírné neuropatie,6 klinický fenotyp je obvykle podobný jako u ATTRwt.4 Val122Ile by neměla být považována za mutaci výlučně pro černošskou populaci, protože se může vyskytovat i u bílé populace. Tuto mutaci jsme například identifikovali ve 4 bělošských španělských rodinách bez černošského původu.
DIVOKÝ TYP TRANSTHYRETINOVÉ AMYLOIDÓZY
Transtyretinová amyloidóza Wildova typu byla poprvé popsána v roce 1876. Dříve se nazývala senilní amyloidóza, ale její diagnostika u pacientů ve věku 40 až 60 let učinila tento termín zastaralým. Zajímavostí je, že nejstarší známý případ této mutace byl zjištěn u 47letého amerického pacienta.8
Přesná prevalence ATTRwt zůstává neznámá. Studie však naznačují, že je poddiagnostikována a že se může jednat o nejčastější formu srdeční amyloidózy.2,3 Tuto hypotézu podporují následující výsledky:
- –
U pacientů starších 80 let je prevalence ukládání TTR při pitvě 25 %.3
- –
U pacientů se srdečním selháním se zachovalou ejekční frakcí (HFpEF) je středně závažné ukládání TTR při pitvě 5 %.9
- –
U pacientů starších 60 let přijatých pro HFpEF a hypertrofii levé komory (LVH) ≥ 12 mm naše skupina nedávno zjistila prevalenci 13 %.10
Na rozdíl od ATTRm je ATTRwt sporadické onemocnění, které obvykle začíná po 70. roce věku.4 Vyskytuje se převážně u mužů a publikované série uvádějí výskyt v rozmezí od 89 % do 98 %.11,12 V nedávné sérii pacientů s diagnózou ATTRwt ve 2 nemocnicích (Madrid, Španělsko a Bologna, Itálie) však naše skupina zjistila, že 20 % tvořily ženy. Navíc i další pitevní studie naznačují, že ATTRwt u žen může být rozšířenější, než se dříve uvádělo. Ženské pohlaví by proto nemělo snižovat klinické podezření na ATTRwt (tabulka 1).13
Autoptické nálezy ukazují, že ukládání TTR je u ATTRwt rozptýleno v různých orgánech. V důsledku kardiálního tropismu TTR je však depozita mnohem větší v srdci a postižení srdce je hlavním klinickým projevem.4 Pacienti mohou mít příznaky extrakardiálního ukládání TTR, jako je stenóza bederního kanálu, atraumatická ruptura šlachy bicepsu nebo „Pepkovo znamení“ a syndrom karpálního tunelu (CTS)3 (obr. 1). Všechny tyto znaky mohou pomoci při orientaci a rychlém stanovení diagnózy. CTS může doprovázet i jiné podtypy amyloidózy, ale častější je u ATTRwt. Ukládání může předcházet srdečním projevům o několik let.6 Lze jej použít jako indikaci u starších pacientů s LVH, zejména pokud mají bilaterální CTS nesouvisející se specifickými pracovními aktivitami a jsou ve funkční třídě ≥ II podle New York Heart Association (nepublikované údaje).
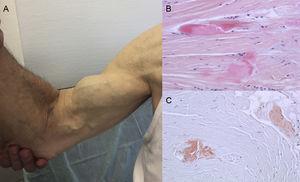
Znaky a příznaky transtyretinové amyloidózy. A: netraumatická ruptura šlachy pravého bicepsu („Pepkovo znamení“). B a C: barvení hematoxylin-eozinem (B) a konžskou červení (C), obojí ×200, vzorku karpálního vazu ukazující husté kolagenní svazky s nebuněčným materiálem. S laskavým svolením Dr. Clary Salas Antón.
DIAGNÓZA TRANSTHYRETINOVÉ AMYLOIDÓZYKlinická prezentace
Amyloid může infiltrovat jakoukoli srdeční strukturu.1 Typicky depozita zvyšují tloušťku komorové stěny, což způsobuje postupný pokles distenzibility vedoucí k těžké diastolické dysfunkci. ATTR je proto tradičně zahrnována mezi příčiny restriktivní kardiomyopatie.
Klinické spektrum ATTR je však mnohem širší a heterogennější. Nejčastějším příznakem ATTR je KV. Jak již bylo zmíněno, studie publikovaná naší skupinou v roce 2015 naznačila, že protokol založený na scintigrafii 99mTc-3,3-difosfono-1,2-propanodikarboxylové kyseliny (99mTc-DPD) může být užitečný pro diagnostiku ATTRwt u významné části (13 %) pacientů starších 60 let přijatých pro HFpEF.10 Na základě tohoto výsledku byla scintigrafie 99mTc-DPD zařazena do evropských pokynů pro HF z roku 2016 jako užitečný nástroj pro identifikaci pacientů s ATTR.14 Podezření na ATTR by však nemělo být vyslovováno výhradně u pacientů s HFpEF, protože s postupujícím ukládáním amyloidu se zhoršuje kontraktilní funkce, a proto může být ATTR spojena s různým stupněm systolické dysfunkce.
Transtyretinová amyloidóza je fenokopií hypertrofické kardiomyopatie (HCM) a může s ní být zaměněna. Nedávná multicentrická francouzská studie uvádí, že 5 % pacientů s HCM má ATTRm.15 Naše výsledky však nejsou v souladu s tímto vysokým výskytem, což může souviset s početnou černošskou populací ve Francii.
Prvním projevem ATTR mohou být poruchy srdečního vedení. Infiltrace sinusového a atrioventrikulárního uzlu amyloidem1 může indikovat nutnost implantace kardiostimulátoru (tabulka 1). Již zmíněná studie provedená ve Španělsku a Itálii zjistila, že poruchy vedení byly prvním projevem ATTRwt u 7 % pacientů s tímto onemocněním.13
Atriální arytmie jsou u pacientů s ATTRwt13 také velmi časté (obr. 2A) a prvním projevem onemocnění může být cévní mozková příhoda.4 Ve skutečnosti skupina z Mayo Clinic nedávno navrhla, že ATTRwt by měl být vyloučen v případě diagnózy nevalvulární fibrilace síní (AF) u starších pacientů.8 Naproti tomu AF se u pacientů s ATTRm vyskytuje mnohem méně často (tabulka 1).
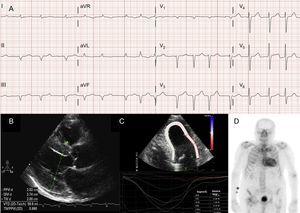
Diagnostické techniky u transtyretinové srdeční amyloidózy (ATTR). A: elektrokardiogram pacienta s transtyretinovou amyloidózou divokého typu (ATTRwt), který ukazuje fibrilaci síní a pseudoinfarktový obraz v dolních svodech. B: echokardiogram pacienta s mutantní transtyretinovou amyloidózou s mutací Val30Met s výraznou koncentrickou hypertrofií levé komory a mírným perikardiálním výpotkem. C: longitudinální regionální deformace pacienta s ATTRwt, ukazující zachovalé hodnoty v apikálním segmentu a snížené hodnoty v bazálním a středokomorovém segmentu. D, 99mTc-DPD (99mTc-3,3-difosfono-1,2-propanodikarboxylová kyselina) sken pacienta s ATTRwt, který ukazuje biventrikulární vychytávání převyšující kostní vychytávání, odpovídající Peruginiho stupni 3.
Nakonec uvádíme, že ATTR a degenerativní aortální stenóza mohou koexistovat u stejného pacienta. V roce 2016 na tuto možnost upozornilo několik studií a prospektivní studie uvádí, že u pacientů starších 65 let, kteří podstoupili náhradu aortální chlopně, je prevalence ATTRwt 6 %16. Tato studie naznačila, že pacienti s oběma entitami měli mnohem horší pooperační prognózu než pacienti bez ATTRwt (mortalita 50 % vs 6,9 % po mediánu sledování 2,3 roku).16 Další nedávná studie se scintigrafií 99mTc-DPD u 43 pacientů s nízkoprůtokovou/nízkogradientní aortální stenózou identifikovala 5 pacientů s ATTRwt (prevalence 12 %). 17 Pacienti s těžkou aortální stenózou a ATTRwt mají stejný demografický profil a vhodná léčba pacientů s oběma onemocněními bude teprve stanovena.
Využitelnost diagnostických technik
Diagnostika ATTR je v každodenní klinické praxi výzvou. Přestože elektrokardiografie a echokardiografie hrají v diagnostice důležitou roli, nové neinvazivní techniky získaly při hodnocení pacientů s ATTR klíčovou roli.
Elektrokardiogram
Spojitost mezi nízkým napětím a srdeční amyloidózou byla dlouho považována za nezpochybnitelnou.3 Nejčastěji používanými kritérii v klinické praxi jsou amplituda QRS 1 Ačkoli by nízká elektrokardiografická voltáž při LVH měla založit podezření, prevalence v současných sériích ATTR byla pouhých 20-25 %.3,4,13 Prevalence se také liší podle použitých kritérií. Například použití Sokolowova kritéria (vlna S ve svodu V1 + vlna R ve svodu V5 nebo V6
1,5 mV) může zvýšit vypočtenou prevalenci na 46 až 58 %.13 K lepšímu posouzení rozdílů mezi výsledky obou technik se doporučuje poměr tloušťky stěny levé komory a celkového napětí QRS.2,3 Až 20 % pacientů s ATTR však může splňovat elektrokardiografická kritéria pro LVH.2,3
Ve většině sérií pacientů se srdeční amyloidózou je nejčastějším elektrokardiografickým nálezem pseudoinfarktový obraz2,3,13 (obr. 2A). Vzhledem k možnému postižení převodního systému jsou časté také úplné nebo neúplné bloky ramének.3
Echokardiografie
Ačkoli je echokardiografie základním kamenem počáteční diagnózy ATTR, žádný nález není specifický.3 Transtyretinová amyloidóza je obvykle spojena s normální nebo malou levou komorou s koncentrickou hypertrofií.3 Na 10. mezinárodním sympoziu o amyloidu a amyloidóze konaném v roce 2004 bylo stanoveno echokardiografické kritérium srdečního onemocnění způsobeného AL při absenci jiných příčin LVH jako přítomnost LVH s hraniční hodnotou 12 mm pro tloušťku stěny interventrikulárního septa.4 Toto kritérium bylo později extrapolováno na další formy amyloidózy (obr. 2B), což mu propůjčovalo vysoký stupeň specificity, ale nízkou senzitivitu.
Ačkoli byla klasicky popsána koncentrická LVH, současné série naznačují, že asi 20 % má asymetrickou LVH.13
Přes klasickou souvislost mezi normální nebo mírně sníženou ejekční frakcí levé komory (LVEF) a srdeční amyloidózou2 je rozsah LVEF velmi variabilní.8 V nedávné studii provedené na Mayo Clinic byla LVEF 8, zatímco v našem souboru byla LVEF 13. Kromě toho je použití LVEF při hodnocení systolické funkce u srdeční amyloidózy omezené, protože mírně snížené hodnoty již svědčí o příslušném srdečním onemocnění. Toto omezení lze překonat použitím tkáňových dopplerovských rychlostí, zobrazení deformace a kontrakční frakce myokardu, které byly navrženy jako vhodnější ukazatele pro hodnocení srdeční funkce.2
Dalšími klasickými echokardiografickými znaky jsou hypertrofie pravé komory, dilatace biatria, mírný perikardiální výpotek, zesílení atrioventrikulární chlopně, zesílení stěny septa síní a zrnitý jiskřivý vzhled myokardu.3,6 Protože však některé z těchto znaků byly pozorovány u vysoce selektované série pacientů v pokročilých stadiích onemocnění, nemusí být pro vyslovení podezření přítomny všechny.1
Zobrazení regionálního napětí je velmi užitečnou technikou pro časnou diagnostiku pacientů s ATTR. U pacientů s ATTR je podélná deformace snížena v bazálních a středokomorových segmentech, ale je zachována v apikálních segmentech18 (obr. 2C). Tento typický vzorec může být užitečný při diferenciální diagnostice ATTR od jiných srdečních onemocnění.4
Biomarkery
O úloze N-terminálního prohormonu mozkového natriuretického propeptidu (NT-proBNP) a troponinu u ATTR je méně údajů než u AL.4 Hladiny NT-proBNP u ATTR jsou obvykle nižší než u AL,4 což odráží 2 různé patofyziologické mechanismy: přímou toxicitu lehkých řetězců u AL vs. indukované poškození tkáně protofibrilami u ATTR.
Nedávno skupina Mayo Clinic navrhla stratifikační systém podobný tomu, který platí pro AL. V souboru 360 pacientů s ATTRwt se oba biomarkery ukázaly jako prediktory mortality. Pacienti ve stadiu III (NT-proBNP > 3000 pg/ml a troponin T > 0,05 ng/ml) měli medián přežití 20 měsíců, zatímco pacienti ve stadiu I a II měli medián přežití 66 měsíců, resp. 40 měsíců (žádný biomarker nebo pouze 1 biomarker nad stanovenými hraničními hodnotami).
Magnetická rezonance srdce
Magnetickou rezonanci srdce (CMRI) lze použít k získání strukturálních a funkčních informací a k charakterizaci složení tkáně myokardu.3 CMRI má zásadní význam pro včasnou identifikaci ATTR a pro její diferenciální diagnostiku od jiných srdečních onemocnění.
Charakterizace tkáně pomocí CMRI je založena na následujících vlastnostech:
- –
Pozdější enhancement: Globální subendokardiální obraz je prakticky patognomonický pro srdeční amyloidózu, ale je přítomen pouze asi u čtvrtiny pacientů. Jiné vzory, jako transmurální (nejčastější) nebo patrové, jsou rovněž slučitelné (obr. 3). Navzdory vysoké senzitivitě a specificitě je třeba vzít v úvahu, že může dojít k možné absenci pozdního enhancementu (15 % pacientů) a podle našich zkušeností i nezanedbatelné procento falešně negativních výsledků z technických důvodů.3 Transmurální vzor enhancementu je spojen s horší prognózou a je nezávislým prediktorem mortality.19
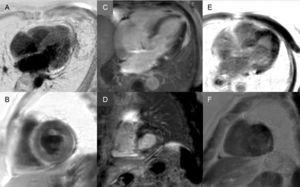 Obrázek 3.
Obrázek 3.Rozmanitost vzorů pozdního zesílení při zobrazování magnetickou rezonancí srdce u transtyretinové amyloidózy. A a B: sekvence pozdního zesílení, 4komorová rovina a krátká osa na střední úrovni, v tomto pořadí, u pacienta s mutantní transtyretinovou amyloidózou (ATTRm), které ukazují difuzní patologické transmurální ukládání gadolinia. C a D: pozdní enhancement sekvence, 4komorová rovina a krátká osa v bazální rovině, v tomto pořadí, u pacienta s ATTRm, ukazující patologické ukládání gadolinia s patchworkovým vzorem, s nižším inferoseptálním a inferolaterálním bazálním ložiskem. E a F, pozdní enhancement sekvence, 4komorová rovina a krátká osa na apikální úrovni, v tomto pořadí, u pacientů s ATTRm, ukazující rozsáhlé patologické transmurální depozice, s výjimkou bazálních a středních anterolaterálních segmentů. S laskavým svolením Dr. Jesús González Mirelis.
(0.15MB). - –
Dlouhé časy T1: T1 mapování je technika, při níž se měří kvantitativní signál myokardu před (nativní T1) nebo po podání kontrastu. Nativní časy T1 jsou u srdeční amyloidózy velmi dlouhé.3 Mapování T1 nevyžaduje podání kontrastu, a proto je lze použít při selhání ledvin. Časy T1 mohou být abnormální i před pozorováním LVH.3 Časy T1 jsou u ATTR delší než u HCM a kontrol (1097 ms ± 43 ms vs 1026 ms ± 64 ms vs 9,67 ms ± 34 ms; P
ms ± 68 ms; P = 0,01).20
Podání kontrastu lze použít k výpočtu extracelulárního objemu (ECV) a posouzení zvětšení extracelulárního prostoru. Hodnoty ECV u srdeční amyloidózy jsou vyšší než u jiných srdečních onemocnění, s výjimkou infarktových zón myokardu.21 V roce 2016 naše skupina ve spolupráci s dalšími národními centry oznámila, že kvantifikace ECV může identifikovat postižení srdce u ATTRm a poprvé ji koreluje se stupněm neurologického postižení, což podporuje využití této techniky v časné diagnostice a sledování ATTRm.22
Kvantitativní techniky mapování T1 a výpočtu ECV mohou být u ATTR velmi užitečné pro včasnou diagnózu, klinické sledování a hodnocení odpovědi na léčbu (obr. 4).
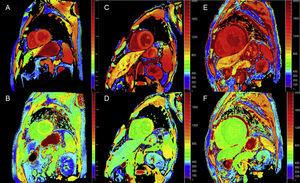
Mapování T1 před kontrastem a po něm pomocí modifikovaného look-locker inversion-recovery (MOLLI) při 3T magnetické rezonanci srdce u zdravé kontroly, pacienta s transtyretinovou amyloidózou a pacienta s primární amyloidózou lehkých řetězců. A a B: nativní T1 mapování a extracelulární objem (EV), resp. u zdravé kontroly, vykazující normální hodnoty (EV = 0,214). C a D: nativní T1 mapování a EV, v tomto pořadí, u pacienta s mutantní transtyretinovou amyloidózou s neurologickým poškozením a počínajícím postižením srdce, zvýšeným nativním T1 a mírně zvýšeným EV (0,361). E a F: nativní T1 mapování a EV u pacienta s divokým typem transtyretinové srdeční amyloidózy, zvýšeným nativním T1 a velmi vysokým EV (0,626), což odráží masivní infiltraci amyloidem. S laskavým svolením Dr. Jesús González Mirelis.
Scintigrafie srdce
V 80. letech 20. století bylo pozorování vychytávání několika kostních difosfonátových tracerů v srdci histologicky korelováno s přítomností srdeční amyloidózy.23 Mechanismus vychytávání není dobře charakterizován, ale může souviset s obsahem vápníku v depozitech amyloidu.
V časné studii boloňské skupiny s použitím 99mTc-DPD bylo zjištěno srdeční vychytávání u 15 pacientů s ATTR a jeho absence u 10 pacientů s AL, přičemž bylo použito skóre založené na biventrikulárním vychytávání, které bylo stejné nebo vyšší než kostní vychytávání (Peruginiho skóre)24 (obr. 2D). Podobné nálezy byly následně hlášeny naší skupinou a dalšími.25 Mírný uptake (skóre 1) a střední uptake (skóre 2) lze nalézt u 30 %, resp. 10 % pacientů s AL.24
Vzhledem k vysoké senzitivitě a specificitě je tato technika velmi užitečná pro stanovení diagnózy ATTR a může prokázat postižení srdce i v případě, že echokardiografický a MRI nález je stále normální. Ve skutečnosti nejsou po scintigrafii z onkologických nebo revmatologických indikací náhodné nálezy ATTR neobvyklé.26
Tc-DPD není ve Spojených státech k dispozici, ale podobné výsledky byly zaznamenány při použití zobrazení 99mTc-PYP (pyrofosfát).27
V současné době se zkoumají další radiotracery. Například 18F-florbetapir, který již byl schválen pro zobrazování beta-amyloidu v mozku,4 byl studován u pacientů s AL a ATTR. Výsledky ukazují, že 18F-florbetapir může detekovat ložiska AL a ATTR v myokardu.28 Ačkoli dostupné údaje byly získány v případových studiích29 a vysoká cena tohoto radiotraceru omezuje jeho použití, probíhá několik studií o potenciální výhodě jeho použití oproti Tc-DPD jako screeningové techniky pro 2 nejčastější typy amyloidózy.
Invazivní diagnostika
Konečná diagnóza ATTR je založena na histologickém průkazu amyloidových fibril. Přestože může dojít k extrakardiálnímu ukládání, pravděpodobnost průkazu amyloidu histologickým vyšetřením se liší podle orgánu.2 Existuje jen málo studií o ekonomické efektivitě extrakardiální biopsie (např. břišní tuk, dásně, slinné žlázy, gastrointestinální trakt) u ATTR, která je větší u ATTRm než u ATTRwt. Negativní biopsie klinicky nepostiženého orgánu však diagnózu ATTR nevylučuje.4
Stejně jako u ATTRwt je endomyokardiální biopsie indikována u pacientů bez extrakardiálního postižení nebo pouze s onemocněním srdce.3,4 Endomyokardiální biopsie je málo rizikový výkon (zejména ve zkušených centrech) a chyby při odběru vzorků jsou nepravděpodobné.6
Po histologickém potvrzení amyloidózy, které může někdy vyžadovat interpretaci vyškoleným personálem,6 je zásadní správná klasifikace podtypu.4 V současné době závisí klasifikace na kombinaci imunohistochemie, genetické analýzy a proteomiky:
- –
Imunohistochemie je založena na použití specifických protilátek proti známým amyloidním proteinům. Ačkoli výsledky této techniky jsou obvykle definitivní, je méně citlivá při rozpoznávání lehkých řetězců.4
- –
Toto omezení lze překonat použitím hmotnostní spektrometrie, která poskytuje definitivní výsledky a je kriteriálním standardem při potvrzení podtypu amyloidu.2 Přestože je tato technika dostupná pouze ve specializovaných centrech, je užitečná zejména v neprůkazných případech nebo v případech, kdy je při imunohistochemickém vyšetření pozitivních několik protilátek, což se podle našich zkušeností vyskytuje asi ve 20-30 % případů. 4
- –
Protože klinické ani histologické techniky nedokážou rozlišit ATTRm od ATTRwt, doporučuje se genetické vyšetření ve všech případech ATTR. Zjištění kauzální mutace může mít význam pro nabídku genetického poradenství a sledování asymptomatických nositelů, 4,30 kteří by mohli mít prospěch z připravované terapie, která oddálí nástup onemocnění nebo mu dokonce zabrání.31
Neinvazivní diagnostika
Do nedávné doby se při diagnostice ATTR považovalo za zásadní histologické vyšetření.3 Pro usnadnění diagnostiky však v roce 2016 navrhla mezinárodní multicentrická studie nový algoritmus pro neinvazivní diagnostiku ATTR.32
Studie analyzovala výsledky 1217 pacientů. Přítomnost klasických známek srdeční amyloidózy pomocí zobrazovacích technik, vychytávání Tc-DPD/PYP 2. nebo 3. stupně při scintigrafii a nepřítomnost monoklonálního proteinu měly specificitu a pozitivní prediktivní hodnotu pro ATTR 100 %32 (obrázek 5).
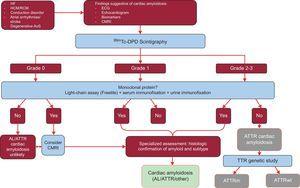
Diagnostický algoritmus pro pacienty s podezřením na srdeční amyloidózu. Systém klasifikace 99mTc-DPD scintigrafie: stupeň 0, žádný srdeční uptake; stupeň 1, mírný nižší uptake než kostní; stupeň 2, střední uptake rovný kostnímu; stupeň 3, závažný uptake převyšující kostní uptake. ACV, cévní mozková příhoda; AL, primární amyloidóza s lehkým řetězcem; AoS, aortální stenóza; ATTR, transtyretinová amyloidóza; ATTRm, mutovaná transtyretinová amyloidóza; ATTRwt, transtyretinová amyloidóza divokého typu; CMRI, magnetická rezonance srdce; EKG, elektrokardiogram; HCM, hypertrofická kardiomyopatie; HF, srdeční selhání; RCM, restriktivní kardiomyopatie; TTR, transtyretin.
Klíčovým rysem tohoto algoritmu je nepřítomnost monoklonálního proteinu, který by mohl způsobit AL při řetězovém testu séra (Freelite, The Binding Site, UK) a při imunofixační elektroforéze krve a moči. Přítomnost monoklonálního proteinu je indikací k endomyokardiální biopsii k rozlišení mezi ATTR a AL.32 Až 5 % populace starší 65 let má monoklonální gamapatii neurčitého významu.2 U starších osob by mírné zvýšení cirkulujících lehkých řetězců nemělo přímo vést k diagnóze AL. Bylo zjištěno, že až 10 % starších pacientů s ATTRwt a monoklonální gamapatií neurčitého významu v referenčních centrech mělo dříve chybně stanovenou diagnózu AL.3,33 Správná diagnóza je nutná, aby se zabránilo nevhodné chemoterapii. Pro zajímavost, na našem pracovišti byly zdokumentovány 2 případy pacientů s mnohočetným myelomem a současným ATTRwt na základě hmotnostní spektrometrie.
LÉČBA TRANSTHYRETINOVÉ KARDIÁLNÍ AMYLOIDÓZY
Léčba pacientů s ATTR má 2 cíle: poskytnout lékařskou podporu a pokud možno zastavit nebo oddálit ukládání amyloidu pomocí specifické léčby.
Léčba
Následující části popisují podpůrnou kardiologickou péči o pacienty s ATTR.
Léčba srdečního selhání
U pacientů se srdeční amyloidózou je třeba udržovat euvolemii. Velmi důležitá jsou dietní opatření a životní styl. Diuretika jsou klíčem k léčbě srdečního selhání u ATTR. Protože však nadměrné užívání diuretik může vést k hypotenzi (často v důsledku autonomní dysfunkce) a zhoršit klinický stav, zejména u ATTRm, je třeba při jejich podávání postupovat mimořádně opatrně.
Při léčbě KV u ATTR je třeba vzít v úvahu, že porucha diastolické dysfunkce a snížený zdvihový objem vedou ke kompenzační tachykardii k udržení srdečního výdeje. Proto musí být beta-blokátory používány opatrně a individuálně pro každého pacienta. Standardním postupem je jejich vysazení při absenci obtíží s kontrolou srdeční frekvence. Tento přístup je u ATTRwt ještě důležitější, pokud je to možné, vzhledem k časté přítomnosti poruch vedení.6 Antagonisté kalcia a digoxin se mohou vázat na amyloidní fibrily, a proto jsou u ATTR kontraindikováni kvůli riziku toxicity i v terapeutických dávkách.6
Na rozdíl od KV se systolickou dysfunkcí způsobenou jinou etiologií neexistují důkazy podporující prognostický přínos užívání beta-blokátorů, inhibitorů angiotenzin konvertujícího enzymu nebo antagonistů receptoru angiotenzinu II u srdeční amyloidózy. Ve skutečnosti může jejich užívání vést ke klinickému zhoršení v důsledku hypotenze a nízkého výdeje: nedávná publikace uvádí horší prognózu u ATTRm a neutrální účinek u ATTRwt.34
Management síňových arytmií
Management AF u ATTR je výzvou. Udržení dlouhodobého sinusového rytmu je obtížné. Lze se však pokusit o elektrickou kardioverzi, protože může vést ke klinickému zlepšení.
Tromboembolické riziko u pacientů s ATTR je velmi vysoké. Chronická infiltrace amyloidem může navíc vést k mechanické dysfunkci síní, která může být základní příčinou vzniku síňového trombu u některých pacientů bez AF. Antikoagulační léčba u ATTR by neměla být založena na skóre CHADS2-VASC a měla by být standardní léčbou u AF. Krvácivé příhody jsou méně časté než u AL, a proto některé nemocnice doporučují antikoagulační léčbu u pacientů se sinusovým rytmem, pokud je špatná funkce síní podle transmitrálních dopplerovských rychlostí. Ačkoli neexistují srovnávací studie o účinnosti přímých perorálních antikoagulancií oproti antagonistům vitaminu K, naše nemocnice podává vybraným pacientům přímá perorální antikoagulancia.
Úloha zařízení
Současná doporučení pro implantaci kardiostimulátoru jsou stejná u ATTR i u běžné populace. Některé skupiny však upřednostňují profylaktickou implantaci, zejména u pacientů s ATTRm a poruchami vedení.35 My tuto preventivní strategii neupřednostňujeme a nezjistili jsme tak vysoký výskyt poruch vedení, který by odůvodňoval profylaktickou implantaci u pacientů s ATTRm.
Úloha použití implantabilního kardioverteru-defibrilátoru (ICD) u ATTR není dobře stanovena. V malé sérii implantace ICD významně nezlepšila přežití, ačkoli měla přiměřený účinek u více pacientů během prvních 2 let.36
Transplantace srdce
Transplantace srdce hraje u ATTR menší roli, protože ATTRm může postihovat různé orgány a ATTRwt obvykle postihuje starší pacienty. Absence extrakardiálního postižení u pacientů s ATTRwt z nich však činí dobré kandidáty pro tento zákrok. V literatuře jsou uvedeny příklady úspěšných transplantací u pacientů mladších 70 let s ATTRwt nebo s ATTRm a převažujícím postižením srdce.4
Specifická léčba transtyretinové srdeční amyloidózy
V současné době neexistuje schválená léčba pro specifickou léčbu srdeční amyloidózy ATTR, ačkoli transplantace jater (TxH) samotná nebo v kombinaci s transplantací srdce se u ATTRm používá od 90. let 20. století jako způsob eliminace hlavního zdroje prekurzoru TTR.4
Transplantace jater
Světový registr transplantací u familiární amyloidotické polyneuropatie37 uvádí, že TxH podstoupilo více než 2000 pacientů s ATTRm ve 20 zemích.4 Pacienti s mutací Val30Met a převážně neurologickým klinickým obrazem mají po 20 letech více než 50% míru přežití.3 Tyto slibné výsledky jsou založeny na přísném výběru pacientů podle věku, typu mutace a stadia onemocnění. Nejčastěji akceptovanou indikací pro TxH je kombinace mladého věku, mutace Val30Met a časného stadia onemocnění.
Hlavními omezeními této techniky jsou však nedostatek dárců, nutnost chronické imunosuprese, pokročilý věk v době prezentace a horší výsledky dosahované u pacientů s jinými mutacemi než mutací Val30Met.
Teoretické potlačení produkce mutovaného proteinu je navíc kompenzováno postimplantačním progresivním nativním ukládáním TTR,4,6 jehož mechanismus není zcela objasněn. Ve skutečnosti srdeční ukládání TTR po TxH ovlivňuje morbiditu a mortalitu.
Potřeba lépe porozumět patogenezi ATTR a omezením TxH podnítila vývoj několika léků.
Tyto nové sloučeniny působí v různých bodech kaskády amyloidogeneze TTR (obr. 6). Léčba bude vždy zahrnovat snížení prekurzorového proteinu, i když stejně důležité bude zabránit ukládání a odstranit stávající depozita. Proto se domníváme, že v budoucnu bude mít přístup k tomuto onemocnění podobu kombinované léčby.
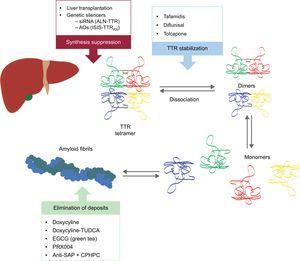
Specifické léčebné postupy u transtyretinové srdeční amyloidózy a hlavní cíle. AntiSAP + CPHPC, antisérum složky amyloidu P + (R)-1–6-oxo-hexanoyl]pyrrolidin-2-karboxylová kyselina; AOs, antisense oligonukleotidy; EGCG, epigalokatechin-3 galát; siRNA, malá interferující RNA; TTR, transtyretin; TUDCA, tauroursodeoxycholová kyselina.
Suprese syntézy transtyretinu
V současné době probíhají dva směry výzkumu inhibice jaterní exprese TTR: použití malé interferující RNA (siRNA) a použití léků s antisense oligonukleotidy (AO).
- –
SiRNA jsou dvouřetězcové molekuly RNA, které umlčují sekvence messengerové RNA tím, že se na ně specificky vážou a zabraňují tvorbě bílkovin. Bylo zjištěno, že Patisiran (ALN-TTR02) snižuje tvorbu TTR o 80 %.38 U pacientů s ATTRm bylo snížení TTR 87 %.39 Studie fáze 2 ukázala slibné výsledky a prokázala stabilní echokardiografické, funkční a analytické parametry po 12 a 24 měsících.40 Výsledky neurologické studie fáze 3 u pacientů s ATTRm a subanalýzy pacientů s postižením srdce se očekávají v roce 2017 (tabulka 2). Další lék, revusiran (ALN-TTR01), se podává subkutánně a od patisiranu se liší lipidovými nanočásticemi, které zapouzdřují siRNA. Tento lék byl předmětem klinické studie fáze III u pacientů s ATTRm, kteří mají onemocnění srdce. Studie byla v loňském roce ukončena z důvodu neočekávaného zvýšení úmrtnosti v léčené skupině (tabulka 2).
Tabulka 2.Hlavní probíhající klinické studie u transtyretinové srdeční amyloidózy
Mechanismus účinku Sloučenina Zkouška Design. Pacienti (N) a podtyp ATTR Intervence Primární koncové body Situace/výsledky Suprese syntézy TTR Patisiran (ALN-.TTR02) NCT01961921 Studie fáze II, multicentrická 27
ATTRm (11 postižení srdce)Patisiran 0.30 mg/kg intravenózně každé 3 týdny po dobu 2 let Dlouhodobá bezpečnost. Sekundární koncové ukazatele: vliv na neurologické poruchy a srdeční parametry Dobře tolerovaný lék, s podobným bezpečnostním profilem u neurologického a srdečního fenotypu
Troponin I, NT-proBNP a echokardiografické údaje zůstaly stabilní po 12 měsících a 24 měsícíchNCT01960348 (APOLLO) Fáze III, randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická 225
ATTRm s neurologickým postiženímPatisiran v infuzi IV vs placebo 2. Ukázka:1 Změny v mNIS+7 Očekává se listopad 2017
Dílčí analýza pacientů s předpokládaným srdečním postiženímNCT02510261 Prodloužení studie APOLLO Patisiran infuze IV vs placebo 2:1 po dobu 52 týdnů Bezpečnost a dlouhodobé nežádoucí účinky Probíhá Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Fáze III, randomizovaná, dvojitě zaslepená, placebem kontrolovaná 206
ATTRm s postižením srdceRevusiran 500 mg 5 d, pak týdně po dobu 2 let oproti placebu Změny v testu chůze na 6 m a v hodnotách TTR v plazmě Přerušeno z důvodu zvýšené úmrtnosti v rameni s revusiranem ISIS-TTRRX NCT01737398 Fáze II/III, randomizovaný, dvojitě zaslepený, placebem kontrolovaný, multicentrický 172
ATTRm s neuropatií; 50 % současného postižení srdceISIS-TTRRX 300 mg SC každých 12 h po dobu 1 týdne, poté týdně po dobu 64 wk oproti placebu Změny v mNIS+7 a Norfolkském dotazníku kvality života Předpokládá se září 2017
Hlášeny případy závažné trombocytopenie a krvácení
Analýza echokardiografických parametrů a NT-proBNP očekávané u pacientů bez hypertenze s LVH > 12 mmLéčba TTR kardiomyopatie pomocí TTR specifického antisense oligonukleotidu Fáze II, otevřená, nerandomizovaná 20
ATTRm s postižením srdce a ATTRwtISIS-TTRRX 300mg SC každých 12 h/týden Echokardiografické parametry a MRI srdce oproti historickým kontrolám Nezhoršilo se napětí a snížila se hmotnost LK asi o 5 %
6 pacientů dokončilo 12 měsíců; 15 pacientů 6 měsíců; 1 pacient TxCNCT02627820 Fáze II, otevřená, nerandomizovaná 50
ATTRwtISIS-TTRRX 300 mg SC každých 12 h po dobu 1 wk, pak 1× za 18 týdnů Změny deformace měřené pomocí speckle tracking Zrušeno bez zahájení náboru pacientů Studie fáze III s přípravkem ISIS-TTRRX pro léčbu amyloidní kardiopatie TTR Fáze III, randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická 490
ATTRwt a ATTRm s postižením srdceISIS-TTRRX 300 mg SC každých 12 h po dobu 1 týdne, poté týdně po dobu 16 týdnů s placebem, pak týdně po dobu 24 měsíců Smrt, TxC nebo přijetí z kardiovaskulárních příčin Na počkání Stabilizace TTR Tafamidis NCT01994889 Fáze III, randomizovaná, dvojitě zaslepená, kontrolovaná placebem, multicentrická 441
ATTRwt a ATTRm s postižením srdceTafamidis 20 mg nebo 80 mg perorálně každých 24 h po dobu 30 měsíců vs placebo Všechny-příčinu úmrtí a kardiovaskulární hospitalizace Konec února 2018 NCT02791230 Prodloužení fáze III NCT01994889 330
ATTRwt a ATTRm s postižením srdceTafamidis 20 mg nebo 80 mg perorálně každých 24 h po dobu 60 měsíců Všech-příčinu úmrtí a výskyt nežádoucích účinků Předpokládaný prosinec 2021 NCT00935012 Fáze II, otevřená studie účinnosti a bezpečnosti 31
ATTRwt nebo ATTRm str.Val122Ile s postižením srdceTafamidis 20 mg perorálně Bezpečnost a účinnost Probíhá do prosince 2021 Diflunisal NCT00294671 Fáze III, randomizovaná, dvojitě zaslepená, placebem kontrolovaný, multicentrický 130
ATTRm s neurologickým fenotypem (50 % s postižením srdce)Diflunisal 250 mg perorálně každých 12 h vs placebo po dobu 24 měsíců NIS+7 po 24 měsících NIS+7 diflunisal vs placebo 16.3 (P Žádné snížení tloušťky nebo napětí komor u pacientů s postižením srdce oproti placebu Eliminace depozit Doxycyklin + TUDCA/UDCA NCT01171859 Fáze II, otevřená, nerandomizovaná, prospektivní 40
ATTR (25 příjemců ATTRm, 13 ATTRwt a 2 příjemci domino transplantace jater)Doxycyklin 100 mg každých 12 h + TUDCA 250 mg každých 8 h po dobu 12 měsíců, poté 6 mo bez léčby Zlepšení 14 pacientů odstoupilo
Nežádoucí kožní reakce, 16 pacientů
68 % z 25 hodnocených pacientů splnilo primární cílový ukazatel
Celkové zlepšení kmene po 12 mo a zhoršení po 6 mo bez léčbyNCT01855360 Fáze II, otevřený, nerandomizovaný, prospektivní vs historické kontroly 30
Kardiální ATTR amyloidóza (27 ATTRwt a 3 ATTRm). Historické kontroly, 14 pacientů s ATTRwtDoxycyklin 100 mg každých 12 h + TUDCA 250 mg každých 8 h po dobu 18 měsíců Změny podélného kmene každých 6 měsíců Studii dokončilo 22 pacientů, kteří byli hodnotitelní
Větší zhoršení kmene u kontrol oproti léčené skupině
Zvýšení NT-proBNP u léčené skupiny; nebylo měřeno u kontrolNCT01677286 Fáze II, otevřená, nerandomizovaná, prospektivní 25
Systémová amyloidóza (6 ATTRwt a 3 ATTRm)Doxycyklin 100 mg každých 12 h po dobu 12 měsíců Bezpečnost léku
Odezva postižených orgánůZhoršení NT-proBNP a renálních funkcí
Žádné zlepšení ostatních studovaných parametrů
60 % pacientů mělo kožní komplikace a 30 % odstoupilo z důvodu kožních nebo gastrointestinálních problémůNCT01171859 Fáze II, otevřená, nerandomizovaná, prospektivní 45
35 s postižením srdce; 25 ATTRm; 5 ATTRm s TxH; 13 ATTRwt; a 2 domino příjemci transplantovaných jaterDoxycyklin 100 mg každých 12 h + TUDCA 250 mg každých 8 h po dobu 12 měsíců
Následná fáze sledování bez léčby po dobu 6 měsícůLéková odpověď definovaná jako Kardiální odpověď hodnocená u 25 pacientů
68 % mělo kardiální odpověď
Zvýšený NT-proBNP a zhoršení zátěže během sledování bez léčby
Vysoký počet odstoupení z důvodu nežádoucích účinků
14 odstoupilo ve fázi léčby a 5 přerušilo ve fázi bez léčbyVliv doxycyklinu + UDCA na ATTR Fáze II, otevřená, nerandomizovaná, prospektivní 28
ATTR s postižením srdce (27 ATTRm a 1 ATTRwt)Doxycyklin 200 mg/d po dobu 4 týdnů, poté přerušen 2 týdny, poté UDCA 750 mg/d po dobu 12 měsíců
Následná fáze sledování bez léčby po dobu 6 měsícůZměny NT-proBNP a Kumamoto skóre Studii dokončilo pouze 14 % a 36 % dokončilo 12 měsíců
Žádné změny NT-proBNP v 6 mo a zhoršení ve 12 mo
Stabilní LVH
Zhoršení Kumamoto skóre ve 12 moEGCG NCT01171859 Fáze II, otevřený, nerandomizovaný, prospektivní 25
ATTRwt600 mg, EGCG po dobu 12 měsíců Změny v ECHO a MRI srdce (n = 14) Snížení hmotnosti LK o 6 % podle MRI srdce (P = 0.03)
LVEF, tloušťka myokardu a MAPSE podle ECHO beze změnyAntiSAP + CPHPC NCT03044353 Fáze II, otevřená, randomizovaná 40
Kohort 1: srdeční ATTR amyloidóza
Kohort 2: primární amyloidóza po 6 měsících chemoterapieAnti-SAP + CPHPC měsíčně po dobu 6 měsíců Snížená zátěž amyloidem podle MRI srdce a ECHO Začátek v roce 2017 AntiSAP + CPHPC, antisérum složky amyloidu P + (R)-1–6-oxo-hexanoyl]pyrrolidin-2-karboxylová kyselina; ATTRm, mutantní transtyretinová amyloidóza; ATTRwt, transtyretinová amyloidóza divokého typu; BNP, mozkový natriuretický peptid; ECHO, echokardiogram; EGCG, epigalokatechin-3 galát; IV, intravenózně; LV, levá komora; LVEF, ejekční frakce levé komory; LVH, hypertrofie levé komory; MAPSE, systolická exkurze v rovině mitrálního prstence; mNIS, Modified Neuropathy Impairment Score; MRI, magnetická rezonance; NIS, Neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, amino-terminální pro-mozkový natriuretický peptid; SC, podkožní; TTR, transtyretin; TUDCA, kyselina tauroursodeoxycholová; TxC, transplantace srdce; TxH, transplantace jater; UDCA, kyselina ursodeoxycholová.
- –
AOs jsou krátké řetězce oligonukleotidů, které se specificky vážou na RNA, zabraňují translaci a syntéze cílových proteinů.4 ISIS-TTRRX je subkutánní AO, u kterého bylo prokázáno snížení hodnot TTR v závislosti na dávce o 75 % až 90 % u zdravých dobrovolníků.4 Studie fáze III u pacientů s ATTRm a neurologickým fenotypem skončila v březnu 2017 a její výsledky se očekávají do konce roku 2017. Americký úřad pro kontrolu potravin a léčiv však odložil zahájení studie fáze III u pacientů s ATTRwt a ATTRm s onemocněním srdce kvůli případům závažné trombocytopenie v neurologické studii (tabulka 2). Vzhledem k tomu, že 50 % účastníků neurologické studie mělo srdeční onemocnění, výsledky této kardiální podstudie rozhodnou o tom, zda bude studie fáze III obnovena. Na druhé straně jsou k dispozici předběžné údaje z otevřené studie fáze II. V této studii dostávalo 22 pacientů s ATTRwt a ATTRm s onemocněním srdce týdenní injekce přípravku ISIS-TTRRX. Podle zprávy je bezpečnostní profil léku velmi příznivý a průběžné údaje o progresi srdečního onemocnění pomocí CMR, NT-proBNP a 6minutových testů jsou pozitivní.41
Stabilizace transthyretinu
Disociace tetrameru TTR na podjednotky je klíčovým krokem při tvorbě fibril ATTR. Diflunisal a tafamidis jsou 2 stabilizátory TTR s prokázanou účinností u polyneuropatie ATTRm.
- –
Tafamidis je perorálně podávaná malá molekula, která se váže na TTR v místech vazby T4 tím, že stabilizuje protein a zabraňuje jeho disociaci. Po zveřejnění výsledků randomizované dvojitě zaslepené studie u 125 pacientů s ATTRm a mutací Val30Met v počátečních stadiích neurologického onemocnění42 schválila Evropská léková agentura v roce 2011 jeho použití jako léčivého přípravku pro vzácná onemocnění k oddálení neurologické progrese. Nejnovější údaje prokazují účinnost léku na dosažení neurologické stability u nejméně 60 % účastníků po více než 4 letech sledování. Dosud má omezené použití u ATTR a kardiologických onemocnění. Studie fáze II u 21 pacientů s ATTRm a různými mutacemi ukázala, že NT-proBNP a echokardiografické parametry zůstávají po 12 měsících stabilní.43 Údaje z pětileté kohortové studie potvrdily, že lék je při dávce 20 mg dobře snášen, i když jen málo pacientů s ATTRwt zůstává po 3,5 letech stabilních.44 Studie ATTR-ACT je 30měsíční studie fáze III hodnotící účinnost, bezpečnost a snášenlivost dávek 20 mg a 80 mg tafamidu oproti placebu u 440 pacientů s ATTRm, ATTRwt a KV. Primární koncový ukazatel zahrnuje hospitalizační mortalitu a hospitalizaci. Její výsledky se očekávají v roce 2018.3,27
- –
Diflunisal je nesteroidní protizánětlivá látka, která stabilizuje molekuly TTR in vitro. Ve Španělsku není dostupný, ale lze si jej vyžádat ze zahraničí pro soucitné použití. Studie fáze III ATTRm u pacientů s převážně neurologickým postižením, z nichž více než polovina měla srdeční onemocnění, nezjistila žádné významné rozdíly v echokardiografických parametrech v průběhu studie (tabulka 2).45 Jeho potenciální gastrointestinální nežádoucí účinky, selhání ledvin, retence vody a hypertenze jej činí nevhodným pro pacienty se srdečním onemocněním. Důkazy o diflunisalu u pacientů s ATTR jsou velmi omezené. Existuje jedna studie, která však byla omezena tím, že měla nerandomizovaný design jednoho centra s malým počtem sledování a malým počtem pacientů (n = 13). Nedošlo k žádnému přijetí pro dekompenzované KV, ale došlo k významnému zhoršení renálních funkcí.46
- –
Nejnověji španělská skupina prokázala, že tolkapon (perorální inhibitor katechol-O-metyltransferázy používaný při léčbě Parkinsonovy choroby) má schopnost vázat se in vitro na TTR pacientů s ATTRwt a Val122Ile s vyšší afinitou než jiné stabilizátory.47
Eliminace amyloidových depozit
Amyloidová depozita jsou velmi stabilní a zdá se, že lidský organismus má malou schopnost je eliminovat. Léčba, která zabraňuje tvorbě nového amyloidu, jako je chemoterapie u AL, však může postupně eliminovat depozita různou rychlostí specifickou pro jednotlivé orgány. Srdeční clearance je obzvláště nízká a důkazů o regresi je zatím málo. V současné době se zkoumá několik molekul, které by urychlily srdeční clearance amyloidu u ATTR:
- –
Doxycyklin (běžně používané antibiotikum) narušuje tvorbu amyloidních fibril. Bylo prokázáno, že synergický účinek kombinace doxycyklinu a tauroursodeoxycholové žlučové kyseliny (TUDCA), která se používá při léčbě onemocnění jater, eliminuje depozita TTR na zvířecích modelech. Studie fáze II s 20 pacienty neprokázala po 1 roce léčby doxycyklinem/TUDCA žádnou srdeční ani neurologickou progresi s přijatelným profilem bezpečnosti a snášenlivosti.4 Další studie fáze II se pokusily potvrdit tato zjištění s použitím kombinovaného doxycyklinu/TUDCA, doxycyklinu/kyselinyursodeoxycholové nebo samotného doxycyklinu.48-50 Předběžné výsledky jedné z těchto studií naznačují protektivní účinek s menším zhoršením srdeční funkce v důsledku zátěže v léčené skupině. Další z těchto studií získala podobné výsledky u 40 pacientů s ATTR: NT-proBNP, funkční třída, LVEF a parametry tloušťky myokardu zůstaly po 12 měsících mimo jiné stabilní (tab. 2). Nicméně všechny tyto studie měly vysokou míru vyřazení z léčby (35-44 %), a to především z důvodu nežádoucích účinků, zejména přecitlivělosti na slunce a gastrointestinálních obtíží (až 30 %).48-50
- –
EGCG (epigalokatechin-3 galát) je nejrozšířenější katechin v zeleném čaji a bylo prokázáno, že in vitro a na myším modelu inhibuje tvorbu amyloidu a eliminuje stávající depozita.4 CMRI ukázala, že denní podávání 600 mg EGCG bylo u skupiny 25 pacientů spojeno se stabilizací hmotnosti levé komory (tabulka 2).51
- –
PRX004 je monoklonální protilátka, která působí vazbou na epitopy specifické pro monomer a chybně složený TTR. Vyvolává tak eliminaci depozit aktivací fagocytózy.52 Základ jejího mechanismu účinku je podobný jako u protilátky používané u AL. Studie fáze II této protilátky vykazují slibné výsledky. Studie fáze I-II této nové protilátky má být zahájena v roce 2017.
- –
Bez ohledu na typ amyloidového prekurzorového proteinu obsahují všechna depozita sérovou amyloidovou složku P (SAP). Při použití této molekuly jako cíle bylo prokázáno, že protilátky anti-SAP vyvolávají reakci zprostředkovanou makrofágy a závislou na komplementu, která způsobila významnou eliminaci viscerálních amyloidových depozit na myším modelu. Sloučenina bis-D-prolinu CPHPC může neutralizovat plazmatický SAP a současné podávání s anti-SAP IgG umožňuje protilátce dosáhnout depozit obsahujících SAP ve tkáni.53 Studie fáze I publikovaná v roce 2015 prokázala eliminaci jaterních depozit u 15 pacientů se systémovou amyloidózou bez srdečního postižení s malými nežádoucími účinky.53 V roce 2017 má být zahájena studie fáze II u pacientů s ATTR srdeční amyloidózou a AL (tabulka 2).
ZÁVĚRY
Transtyretinová srdeční amyloidóza je diagnostikována stále častěji. Scintigrafie 99mTc-DPD a CMRI jsou příklady technik, které lze použít k jednoduché a včasné identifikaci pacientů s ATTR.
V současné době je v závěrečných fázích výzkumu několik léků specifických pro ATTR. Proto věříme, že srdeční amyloidóza ATTR bude brzy považována za léčitelnou jednotku, nikoli za smrtelné onemocnění.
FUNGOVÁNÍ
Tato práce byla provedena za částečné podpory Institutu zdraví Carlose III a Španělské kardiologické společnosti (výzkumný grant 2016 pro E. Gonzáleze-Lópeze). Pomoc Zdravotního ústavu Carlose III. je financována z Evropského fondu pro regionální rozvoj „Another Way to Make Europe“.
KONFLIKTY ZÁJMŮ
E. González-López se jako řečník účastnil aktivit pořádaných společností Pfizer. P. Garcia-Pavia obdržel platby jako řečník na aktivitách organizovaných společností Pfizer a jako konzultant společností Alnylam, Prothena a Pfizer. E. González-López, A. López-Sainz a P. Garcia-Pavia prohlašují, že společnost Pfizer financovala výzkumné projekty jejich instituce
.