Struktur, dynamik og funktion af akvaporiner
 Vinder af Visualization Challenge in Science and Engineering 2004,
Vinder af Visualization Challenge in Science and Engineering 2004, Organiseret af National Science Foundation og Science Magazine. (Se den relaterede Science-artikel.)
Vores film om vandpermeation og 2003Nobelprisen i kemi
The Art of Water Transport in Aquaporins
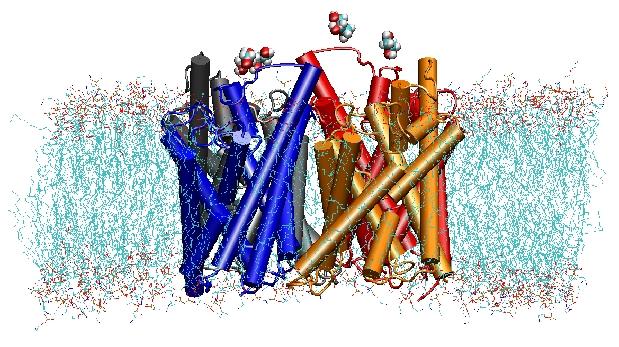
Aquaporiner er membranvandkanaler, der spiller en kritisk rolle i kontrollen af vandindholdet i celler. Disse kanaler er vidt udbredt i alle livets riger, herunder bakterier, planter og pattedyr. Der er fundet mere end ti forskellige akvaporiner i menneskekroppen, og flere sygdomme, såsom medfødt grå stær og nefrogen diabetes insipidus, er forbundet med den nedsatte funktion af disse kanaler. De danner tetramere i cellemembranen og letter transporten af vand og i nogle tilfælde også af andre små opløsningsstoffer gennem membranen. Vandporerne er imidlertid fuldstændig uigennemtrængelige for ladede arter som f.eks. protoner, hvilket er en bemærkelsesværdig egenskab, der er afgørende for bevarelsen af membranens elektrokemiske potentiale, men samtidig paradoksalt, da protoner normalt let kan overføres gennem vandmolekyler. Resultaterne af vores simuleringer har nu givet ny indsigt i den mekanisme, der ligger til grund for denne fascinerende egenskab. Vandmolekyler, der passerer kanalen, tvinges af proteinets elektrostatiske kræfter til at vende sig i midten af kanalen (se animationen), hvorved det alternative donor-acceptor-arrangement, der er nødvendigt for protontranslokation, brydes (læs hele historien i vores Sciencepaper).

Funktionel betydning af en ejendommelig proteinarkitektur
I år 2000 lykkedes det Strouds laboratorium ved UCSF at løse den første højopløste struktur af et aquaporin ved hjælp af røntgenkrystallografi. Den undersøgte struktur var den af E. coliglycerol uptake facilitator (GlpF), som er et aquaglyceroporin, dvs. at kanalen også er permeabel for små lineære sukkermolekyler som f.eks. glycerol. MD-simuleringer på nanosekunder af tetramerisk GlpF i et hydreret POPE-lipiddobbeltlag karakteriserede den fuldstændige vej for substratledning i kanalen. En analyse af substratets hydrogenbindingsinteraktioner med kanalens indre forklarede også for første gang, hvorfor disse kanaler i deres arkitektur indeholder to karakteristiske loops, herunder energetisk ugunstige sekundære strukturelementer, som er bevaret i hele aquaporinfamilien (Jensenet al., Structure, 2001).
Energetik af sukkerpermeation
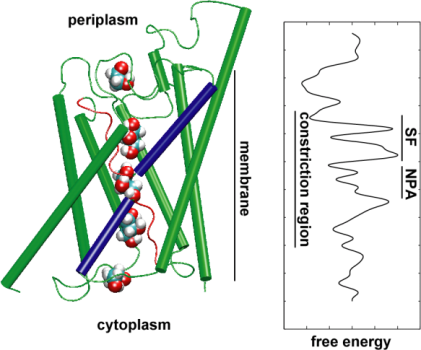
Derefter udforskede vi transporteventets energetik for at forstå, hvilke barrierer et substrat skal overvinde under dets passage gennem kanalen. For at beskrive den frie energiprofil beregnede vi potentialet for middelkraft for den fuldstændige ledningsbegivenhed ud fra de baner, hvor glycerolens bevægelse gennem kanalen blev fremskyndet ved anvendelse af ydre kræfter. Denne teknik, der er kendt som styret molekylær dynamik (SMD), gør det muligt at observere langsomme hændelser inden for den tilgængelige tidsskala for MD-simuleringer. På grund af banernes uligevægtskarakter står man imidlertid ved analysen af resultaterne over for problemet med irreversibelt arbejde, som skal medregnes. Ved hjælp af Jarzinskys identitet, ligheden mellem den frie energi og arbejdet i systemer uden ligevægt, kunne vi fuldstændigt beskrive energien i glyceroltransporten gennem kanalen. Det beregnede potentiale for middelkraft indfanger de vigtigste bindingssteder og barrierer i kanalen i tæt overensstemmelse med resultaterne af ligevægts-MD-simuleringer og krystalstrukturen. Desuden viser den en udtalt asymmetri i sin form, hvilket tyder på, at proteinets asymmetriske struktur kan være funktionelt vigtig for en effektiv optagelse af næringsstofmolekyler fra omgivelserne. (Jensen, etal., PNAS, 2002).
Hvad gør et akvaporin til en glycerolkanal
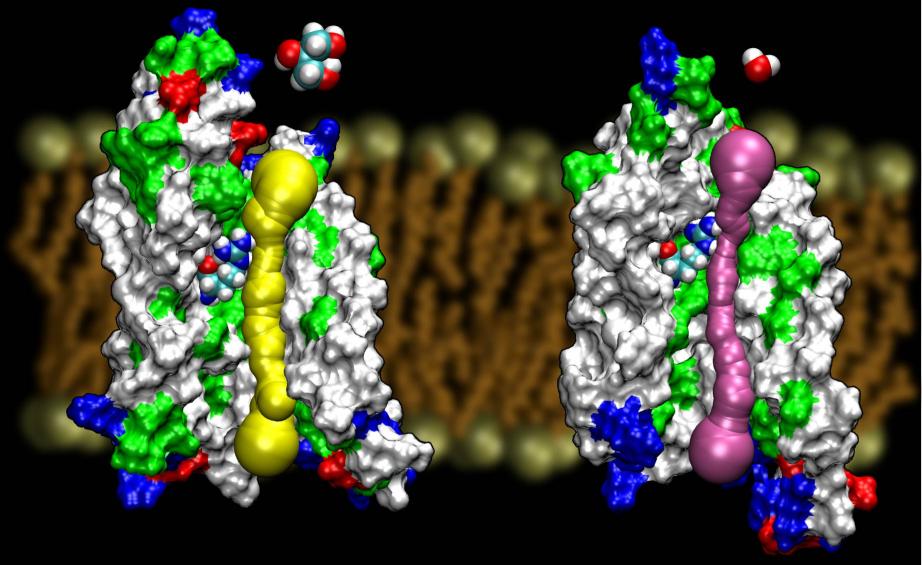
Akvaporiner er en meget heldig familie af membranproteiner, som er notorisk modstandsdygtige over for strukturbestemmelse. Vi har nu fået højopløste strukturer af flere AQP’er: GlpF, AQP1, AQP0 og AqpZ. Flere strukturer forventes snart at dukke op. Tilgængeligheden af strukturen af to AQP’er fra E. coli, hvoraf den ene er en ren vandkanal (AqpZ) og den anden er en glycerolkanal (GlpF), gav os en enestående mulighed for at forstå de selektivitetsprincipper, som naturen anvender ved at bruge to genetisk og strukturelt meget homologe kanaler til membrantrafik af forskellige materialer.En sammenligning af de beregnede barrierer for ledelse af glycerol i disse to kanaler viste, at AqpZ udnytter steriske barrierer til at gøre det vanskeligt for glycerol at passere. Faktisk er porerne i det hele taget smallere end GlpF (se figuren nedenfor). Det ser ud til, at naturen har benyttet sig af en meget grundlæggende mekanisme, nemlig at justere kanalens porestørrelse, for at få to proteiner fra samme familie til at udvise forskellige ledningsegenskaber. Læs hele historien i Wang, etal., STRUCTURE, 2005.
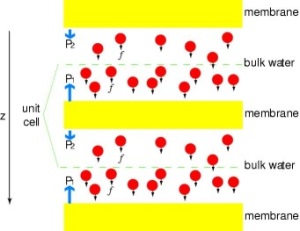
Putting Channels under Pressure
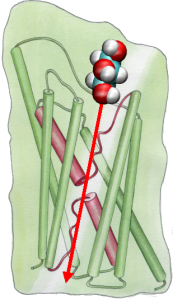
For at kunne sammenligne resultaterne af MD-simuleringer direkte med biokemiske målinger af ledningsevnen af vandkanaler i membraner, hvor osmotiske trykgradienter anvendes til at fremkalde vandstrømmen gennem membranen, har vi udviklet en ny metode til MD-simuleringer. Ved at påføre små kræfter på vandmolekyler i bulkområdet (se figur) genereres en hydrostatisk trykgradient på tværs af membranen. Trykgradienten fremkalder ledningshastigheder, der kan studeres med MD-simuleringer, som normalt er begrænset til nogle få nanosekunder. Metoden er blevet anvendt ved simulering af vandpermeation gennem GlpF og har resulteret i en lineær korrelation mellem det påførte tryk og flowet (Zhu et al., Biophys. J., 2002).
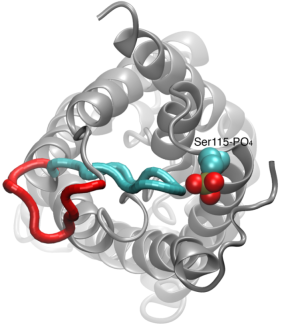
Gating of Water Channels
Vandpermeation gennem aquaporiner er en passiv proces, der følger retningen af det osmotiske tryk på tværs af membranen. Selv om mange aquaporiner fungerer som altid åbne kanaler, har en undergruppe af aquaporiner, især hos planter, udviklet en sofistikeret molekylær mekanisme, hvorved kanalen kan lukkes som reaktion på barske miljøforhold, hvor vandudveksling kan være skadelig for organismen. Som eksempler på sådanne forhold kan nævnes tørke- og oversvømmelsesstress, som udløser visse cellulære signaler (defosforylering og ændring af pH-værdien), der resulterer i lukning af kanalen. En nyligt løst struktur af en akvaporin fra spinat blev simuleret under forskellige betingelser for at undersøge den molekylære mekanisme for gating i disse membrankanaler. Det blev konstateret, at en langstrakt cytoplasmatisk løkke i gating-kompetente aquaporiner fysisk lukker indgangen til vandporen i den lukkede kanal og blokerer adgangen for vandmolekyler til porten. Forskydning af denne løkke som reaktion på fosforylering, som observeret i simuleringer, fjerner løkken fra porens cytoplasmatiske indgang. Desuden vil en hydrofob aminosyre, som er konformationelt tæt koblet til denne løkke, blive trukket tilbage fra kanalen som følge af løkkens bevægelse. Tilsammen resulterer disse molekylære begivenheder i en åben kanal, der er permeabel for vandmolekyler. Undersøgelsen blev offentliggjort i Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
AQP’er er generelt kendt for dereshøje permeabilitet for vand. Det er imidlertid blevet antydet, at de er involveret i andre cellulære funktioner, herunder permeation af andre små molekyler end vand samt celle-cellekommunikation. Tetramerisering er et almindeligt strukturelt træk ved AQP’er. Det forhold, at de fire monomerer hver især danner en funktionelt uafhængig vandpore, men at de kræver en tetramerisk organisation for at fungere, tyder på en synergistisk fordel ved oligomerisering og tvinger således til yderligere analyse af den centrale pores potentielle rolle i AQP’er. Et interessant forslag er den centrale pores mulige inddragelse i ionledning ved cGMP-aktivering. Ved hjælp af MD-simuleringer af membranindlejrede modeller af AQP1 har vi undersøgt denne egenskab ved AQP1 for at bestemme, hvordan og under hvilke konformationelle og hydreringsbetingelser den centrale pore kan lede, og hvordan ledningsevnen reguleres. En af de cytoplasmiske sløjfer, nemlig den argininrige sløjfe D, blev af vores simuleringer foreslået at spille en nøglerolle i cGMP-medieret aktivering af den centrale pore. Den foreslåede rolle af loop D blev verificeret eksperimentelt ved en designet mutant af loop D, der viste et fuldstændigt tab af ionledningsevne ( Yu et al.,Structure, 2006 ) .
Gasmolekyler pendler ind i cellen
Hver morgen kører mange mennesker i bil på arbejde, mens andre måske cykler, tager bussen eller metroen.På samme måde når forskellige biomolekyler i menneskekroppen også frem til deres bestemmelsessted på forskellige måder. For at krydse den cellulære membran diffunderer små hydrofobiske gasmolekyler f.eks. gennem lipidlaget, mens vandmolekyler passerer gennem aquaporiner (AQP’er).Det er interessant, at ligesom man kan komme på arbejde både med bus og i bil, har man for nylig fundet ud af, at nogle gasmolekyler kan have mere end én måde at krydse membranen på, dvs, Ud over diffusion gennem lipider kan ilt og kuldioxid også passere gennem AQP’er.De veje, som disse gasmolekyler tager, er dog fortsat uklare.Ved hjælp af molekylær dynamik udført med NAMD har vi undersøgt AQP1’s gasgennemtrængelighed med to komplementære metoder (eksplicit gasdiffusionssimulering og implicit ligandsampling). Simuleringsresultaterne tyder på, at mens de firemonomere porer i AQP1 fungerer som vandkanaler, kan den centrale pore i AQP1 tjene som en vej for gasmolekyler til at krydse membranen (Wang et al., Journal of Structural Biology, 2007 ).
Molekylær forhindringsbane
Biologiske celler beskytter deres indre gennem deres cellemembraner, men er alligevel afhængige af import af næringsstoffer. De har til denne import udviklet hurtige ledningskanaler, der omfatter pålidelige kontrolpunkter, der skelner mellem ønskelige og uønskede forbindelser. Et kontrolpunkt udgør en veritabel forhindringsbane, som kun de rigtige forbindelser hurtigt kan passere. Det er vanskeligt at forstå kanalens udformning på grund af manglen på detaljerede eksperimentelle data om næringsstoffernes dynamik. På nuværende tidspunkt kommer de mest detaljerede oplysninger fra en beregningsmæssig undersøgelse af kanaldynamikken med udgangspunkt i statiske krystallografiske strukturer. I en nylig undersøgelse blev det undersøgt, hvordan glyceroler, små næringsmolekyler, som nogle bakterier har brug for, passerer gennem checkpoints, der er realiseret gennem glycerolkanalen GlpF. GlpF indeholder fire parallelle kanaler, som blev overvåget beregningsmæssigt ved hjælp af NAMD og en ny algoritme, der udforsker kanalens energetik hurtigt nok til at være metodologisk gennemførlig på de nuværende computere. Resultaterne viser, hvordan glycerolens fysiske egenskaber, deres evne til at danne såkaldte hydrogenbindinger, deres elektriske dipolmomenter, deres diffusionsbevægelighed og deres iboende fleksibilitet undersøges langs kanalen (Henin et al., Biophysical Journal, under tryk ).
Vores akvaporinforskning i nyhederne
|
Aquaporin Team
|
Publikationer
-//W3C//DTD XHTML 1.0 Transitional//EN” “http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Diffusion af glycerol gennem Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, og Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Udforskning af gaspermeabilitet i cellemembraner og membrankanaler med molekylær dynamik: Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten og Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mekanisme for gating og ionledningsevne af en mulig tetramerisk pore i Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten og Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, og P. Kjellbom. Nature, 439:688-694, 2006. Hvad gør en aquaporin til en glycerolkanal: En sammenlignende undersøgelse af AqpZ og GlpF.Yi Wang, Klaus Schulten og Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetisk teori og simulering af vandtransport i en enkelt kanal.Emad Tajkhorshid, Fangqiang Zhu og Klaus Schulten. I S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Nederlandene, 2005. Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor og Klaus Schulten, Towards understanding membrane channels. I Boris Martinac og Andrzej Kubalski, redaktører, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Kollektiv diffusionsmodel for vandpermeation gennem mikroskopiske kanaler: Fangqiang Zhu, Emad Tajkhorshid og Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 sider). Computational studies of membrane channels.Benoit Roux og Klaus Schulten. Structure, 12:1343-1351, 2004.