Det kemiske grundstof hydrogen er klassificeret som et ikke-metal. Det kan blive metallisk ved meget højt tryk. Det blev opdaget i 1766 af Henry Cavendish.

Data Zone
| Klassifikation | Vedstof er et ikke-metal. Det kan blive metallisk ved meget højt tryk. |
| Farve | Farveløs |
| Atomvægt | 1.0079 |
| Status | Gas |
| Smeltepunkt | -259,14 oC, 14,01 K |
| Kogningspunkt | |
| Skoldningspunkt | -252,87 oC, 20.28 K |
| Elektroner: | 1 |
| Protoner: | 1 |
| Neutroner i den hyppigst forekommende isotop: | 0 |
| Elektronskaller | 1 |
| Elektronkonfiguration | 1s1 |
| Densitet @ 20oC | 0.0000899 g/cm3 |
Vis flere, herunder: Varme, energi, oxidation,
reaktioner, forbindelser, radier, ledningsevner
| Atomvolumen | 14.4 cm3/mol |
| Struktur | hcp: hexagonalt tætpakket (som fast stof ved lave temperaturer) |
| Hårdhed | – |
| Specifik varmekapacitet | 14.304 J g-1 K-1 |
| Fusionsvarme | 0,117 kJ mol-1 af H2 |
| Forstøvervarme | 218 kJ mol-1 |
| Fordampervarme | 0.904 kJ mol-1 af H2 |
| 1. ioniseringsenergi | 1312 kJ mol-1 |
| 2. ioniseringsenergi | kJ mol-1 |
| 3. ioniseringsenergi | 11815.0 kJ mol-1 |
| Elektronaffinitet | 72.7711 kJ mol-1 |
| Minimalt oxidationstal | -1 |
| Min. fælles oxidationsnr. | -1 |
| Maksimalt oxidationstal | 1 |
| Maks. fælles oxidationsnr. | 1 |
| Elektronegativitet (Pauling-skala) | 2,18 |
| Polarisérbarhedsmængde | 0.7 Å3 |
| Reaktion med luft | kraftig, ⇒ H2O |
| Reaktion med 15 M HNO3 | ingen |
| Reaktion med 6 M HCl | ingen |
| Reaktion med 6 M NaOH | ingen |
| Oxid(er) | H2O |
| Hydrid(er) | H2 |
| Klorid(er) | HCl |
| Atomradius | 25 pm |
| Ionisk radius (1+ ion) | – |
| Ionisk radius (2+ ion) | – |
| Ionisk radius (3+ ion) | – |
| Ionisk radius (1- ion) | – |
| Ionisk radius (2-ion) | – |
| Ionisk radius (3-ion) | – |
| Varmeledningsevne | 0.1805 W m-1 K-1 |
| Elektrisk ledningsevne | – |
| Frost-/smeltepunkt: | -259,14 oC, 14,01 K |

Nasa-billede: Store mængder brint i fjerntliggende galakser.

Theophrastus Paracelsus – Den første person til at generere brint: “Luft opstår og bryder frem som en vind.”
Opdagelsen af brint
Et yndet kemieksperiment i skolen er at tilsætte et metal som magnesium til en syre. Metallet reagerer med syren, danner et salt og frigør brint fra syren. Brintgassen bobler op fra væsken, og eleverne samler den op i små mængder til yderligere eksperimenter, f.eks. til “pop-testen”.”
Det første registrerede tilfælde af brint fremstillet af menneskelig handling var i første halvdel af 1500-tallet ved en metode, der ligner den, der bruges i skolerne nu: Theophrastus Paracelsus, en læge, opløste jern i svovlsyre og observerede, at der frigjordes en gas. Han siges at have sagt om eksperimentet: “Luft opstår og bryder frem som en vind”. Han opdagede dog ikke nogen af brints egenskaber.(1)
Turquet De Mayerne gentog Paracelsus’ eksperiment i 1650 og fandt, at gassen var brandfarlig.(2) Hverken Paracelsus eller De Mayerne foreslog, at brint kunne være et nyt grundstof. Paracelsus mente nemlig, at der kun fandtes tre grundstoffer – tria prima – salt, svovl og kviksølv – og at alle andre stoffer var lavet af forskellige kombinationer af disse tre. (3) (Kemien havde stadig lang vej at gå!)
I 1670 tilsatte den engelske videnskabsmand Robert Boyle jern til svovlsyre. Han viste, at den resulterende (brint)gas kun brændte, hvis der var luft til stede, og at en brøkdel af luften (vi ville nu kalde det ilt) blev forbrugt ved forbrændingen. 4)
Brint blev først anerkendt som et særskilt grundstof i 1766 af den engelske videnskabsmand Henry Cavendish, da han fremstillede det ved at lade saltsyre reagere med zink. Han beskrev brint som “brændbar luft fra metaller” og fastslog, at det var det samme materiale (ved dets reaktioner og densitet), uanset hvilket metal og hvilken syre han brugte til at fremstille det.(1) Cavendish observerede også, at når stoffet blev brændt, producerede det vand.
Den franske videnskabsmand Antoine Lavoisier gav senere grundstoffet brint et navn (1783). Navnet kommer af det græske “hydro”, der betyder vand, og “genes”, der betyder dannelse – brint er et af de to vanddannende grundstoffer.
I 1806, hvor brint var veletableret som grundstof, skubbede den engelske kemiker Humphry Davy en stærk elektrisk strøm gennem renset vand.
Han fandt, at der blev dannet brint og ilt. Eksperimentet viste, at elektricitet kunne trække stoffer fra hinanden til deres bestanddele. Davy indså, at stoffer var bundet sammen af et elektrisk fænomen; han havde opdaget den sande natur af kemisk binding. 5)
Besøg Chemicool’s Cool Hydrogen Facts Page.

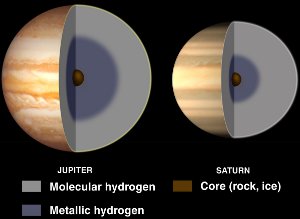
Interiører af Jupiter og Saturn, med flydende metallisk brint. Med venlig hilsen NASA/JPL-Caltech.

Nasa: Space Shuttles eksterne brændstoftank (orange) fyldt med flydende brint og ilt.

Hydrogenbiler udleder vand i stedet for forurenende stoffer.

Laboratorieelektrolyse af vand. Elektrisk energi bruges til at opdele vand. Brint samles i det ene reagensglas, ilt i det andet.
Udseende og egenskaber
Skadelige virkninger:
Brint er letantændeligt og har en næsten usynlig flamme, hvilket kan føre til utilsigtede forbrændinger.
Egenskaber:
Brint er det enkleste grundstof af alle og det letteste. Det er også langt det mest almindelige grundstof i universet. Over 90 procent af atomerne i universet er brint.
I sin mest almindelige form består brintatomet af én proton, én elektron og ingen neutroner. Brint er det eneste grundstof, der kan eksistere uden neutroner.
Brint er en farveløs, lugtfri gas, der ved standardtemperatur og -tryk findes som toatomige molekyler, H2.
Det brænder og danner eksplosive blandinger i luft, og det reagerer voldsomt med oxidanter.
På Jorden findes brint hovedsageligt i vand, H2O. Der er kun lidt frit brint på Jorden, fordi brint er så let, at det ikke holdes fast af planetens tyngdekraft. Alt brint, der dannes, undslipper i sidste ende fra atmosfæren ud i rummet.
Selv om brint normalt er et ikke-metal, bliver det til et flydende metal, når der lægges et enormt tryk på det.
Sådanne tryk findes i gasgiganter som Jupiter og Saturn. Jupiters høje magnetfelt (14 gange Jordens) menes at være forårsaget af en dynamoeffekt, der skyldes elektrisk ledende metallisk brint, der cirkulerer, når planeten roterer.
Brug af brint
Store mængder brint anvendes i Haber-processen (fremstilling af ammoniak), hydrogenering af fedtstoffer og olier, fremstilling af methanol, hydrokrakning og hydroafsvovling. Brint anvendes også til metalraffinering.
Flydende brint anvendes som raketbrændstof, f.eks. til at drive Space Shuttle’s løft og opstigning i kredsløb. Flydende brint og ilt opbevares i rumfærgens store, eksterne brændstoftank. (Se billedet til venstre.)
Brintets to tungere isotoper (deuterium og tritium) anvendes ved kernefusion.
Brintøkonomien er blevet foreslået som en erstatning for vores nuværende kulbrintebaserede økonomi (olie, gas og kul).
Grundlaget for brintøkonomien er, at der produceres energi, når brint forbrændes med ilt, og at det eneste biprodukt fra reaktionen er vand.
I øjeblikket produceres brinten til brintdrevne biler imidlertid fra kulbrinter. Først når f.eks. sol- eller vindenergi kan anvendes kommercielt til at opspalte vand til brint og ilt, vil en ægte brintøkonomi være mulig.
Forsyning og isotoper
Forsyning jordskorpen: 1400 vægtdele pr. million (0,14 %), 2,9 mol%
Forsyning solsystemet: 75 vægtdele, 93 mol%
Kostpris, ren: $12 pr. 100 g
Kostpris, bulk: $ pr. 100 g
Kilde: $ pr. 100 g
Kilde: Brint fremstilles kommercielt ved at lade overophedet damp reagere med metan eller kulstof. I laboratoriet kan brint fremstilles ved syrepåvirkning af metaller som zink eller magnesium eller ved elektrolyse af vand (vist til venstre).
Isotoper: Brint har tre isotoper: 1H (protium), 2H (deuterium) og 3H (tritium). De to tungere isotoper (deuterium og tritium) anvendes til kernefusion. Protium er den hyppigste isotop, og tritium er den mindst hyppige. Tritium er ustabilt med en halveringstid på ca. 12 år og 4 måneder. Naturligt forekommende brint er en blanding af de to isotoper 1H og 2H med naturlige hyppigheder på henholdsvis 99,99 % og 0,01 %.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) s22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen, (2008) s2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s “The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) s8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) s62. Libraries Unlimited.
Cite this Page
For online linking, please copy and paste one of the following:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
or
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
To cite this page in a academic document, please use the following MLA compliant citation:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.