INDLEDNING
Amyloidose er en aflejringssygdom forårsaget af ekstracellulær ophobning af fibriller, hvis kilde består af proteiner med en ustabil struktur, der folder sig, aggregerer og undergår aflejring.1 En sådan aflejring kan ændre vævsstrukturen og forringe funktionen af forskellige organer og systemer.2
Amyloidfibriller er uopløselige og proteolyseresistente og er typisk farvet med congorød og viser intens gulgrøn dobbeltfrekvens under polariseret lys.3 Mere end 30 proteiner kan forårsage amyloidaflejring, men kun 5 forårsager signifikant aflejring i hjertevæv1:
- –
Light chains, som forårsager primær amyloidose (AL).
- –
Transthyretin (TTR), som forårsager TTR-amyloidose (ATTR).
- –
Apolipoprotein A.
- –
Fibrinogen.
- –
Serum amyloid-protein A, som giver sekundær amyloidose.
Primær amyloidose og ATTR er de mest almindelige former for hjerteamyloidose, idet AL-formen historisk set anses for at være mere almindelig i de udviklede lande.3
De fleste oplysninger om kardiel amyloidose har været baseret på AL. Men selv om antallet af patienter med AL har været stabilt, er antallet af ATTR-diagnoser for nylig steget, og man mener nu, at ATTR kan være langt mere udbredt end AL.2
Transthyretinamyloidose har meget ofte været genstand for fejldiagnoser eller betydelige forsinkelser, indtil den korrekte diagnose er stillet. Årsagerne omfatter heterogenitet i dens former, behov for histologisk bekræftelse, mangel på specialudstyr og fejlagtige overbevisninger blandt nogle kardiologer om, at det er en sjælden sygdom uden behandlingsmuligheder.2,3
Men disse aspekter er ved at ændre sig. Diagnosen har konsekvenser for patientbehandlingen. Der er blevet udviklet specifikke behandlinger, som kan forsinke eller stabilisere aflejringen, og som er mere effektive i de tidlige stadier. En tidlig diagnose er derfor afgørende. Denne gennemgang beskriver væsentlige nylige fremskridt inden for diagnosticering og behandling af ATTR og giver håb for patienter med denne tilstand.
TRANSTHYRETIN CARDIAC AMYLOIDOSIS
Transthyretin er et tetramerisk plasmaprotein, der er ansvarlig for transport af thyroxin og retinolbundet protein. Det syntetiseres primært i leveren og sekundært i choroid plexus og det retinale pigmentepithel.4
Transthyretin har tendens til at dissocieres til dimerer og monomerer, som misassocieres til fibriller og undergår aflejring. Punktmutationer eller virkningen af alder kan øge denne tendens, hvilket giver anledning til de 2 kliniske former for ATTR: mutant (ATTRm) og wild-type (ATTRwt).
MUTANT TRANSTHYRETIN AMYLOIDOSIS
Mere end 120 mutationer er i øjeblikket kendt for at forårsage ATTRm. Disse mutationer udviser et autosomalt dominerende arvelighedsmønster med variabel penetrans.4 På grund af den store geografiske spredning er det vanskeligt at fastslå prævalensen af ATTR, men den anses for at være en sjælden sygdom med en prævalens på mindre end 1/100 000 indbyggere2 (tabel 1).
Væsentligste kliniske og diagnostiske karakteristika ved mutant- og vild-Type Transthyretin Cardiac Amyloidosis
| ATTRwt | ATTRm | |
|---|---|---|
| Prævalens | Ukendt. Tilsyneladende meget hyppig | |
| Genetisk undersøgelse | Afvisning af mutationer i TTR | Mutationer i TTR |
| Typisk alder ved præsentation | > 60 år | Variabel i henhold til forårsagende mutation |
| Køn | Mandlig prædominans. 80% patienter | Mandlig prædominans, med mere aggressiv fænotype |
| Ekstrakardiale manifestationer | – Karpaltunnelsyndrom (33%-49%) – Lumbal spinal stenose – Traumatisk biceps senenruptur (32%) |
– Ascenderende bilateral sensorisk-motorisk polyneuropati – Dysautonomi: ortostatisk hypotension, diarré-constipation, erektil dysfunktion – Øjeninvolvering: glaukom, intravitreal deposition, skalloped pupiller |
| Hjertelidelser | Konstant | Variabel alt efter forårsagende mutation |
| Hjertelidelser | – Hjertesvigt (53%-86%) – Konduktionsforstyrrelser – AF (43%-67%) – Degenerativ AoS |
– Ledningsforstyrrelser – Hjertesvigt – Uhyppigt AF (10%) |
| Diagnostiske teknikker | ||
| EKG | – Pseudoinfarktmønster (63%-66%) – Lav spænding (22%-33%) – Sokolow LVH (6%-13%) |
– Pseudoinfarktmønster (18%-69%) – Lav spænding (2%-25%) – Sokolow LVH (3%-8%) |
| ECHO | – Moderat-svær hypertrofi – Mild-moderat nedsat LVEF (30%) |
– Moderat hypertrofi – LVEF, typisk bevaret |
| Cardiac MRI | – Late enhancement – Forhøjet native T1 og EV |
|
| 99mTc DPD scintigrafi | – Grad 2-3 | – Grad 0: asymptomatiske bærere – Grad 1: initial kardiel involvering – Grad 2-3: betydelig kardiel involvering |
AF, atrieflimren; AoS, aortastenose; ATTRm, mutant transthyretin amyloidose; ATTRwt, wild-type transthyretin amyloidose; EKG: elektrokardiogram; ECO: ekkokardiogram; EV: ekstracellulært volumen; LVEF: venstre ventrikulær ejektionsfraktion; LVH: venstre ventrikulær hypertrofi; TTR: transthyretin.
De første TTR-mutationer blev rapporteret som familiær amyloid polyneuropati (eller Andrade-sygdom), og følgelig er ATTRm indtil for nylig blevet betragtet som en neurologisk sygdom. Nyere resultater viser imidlertid kardiel involvering i mere end halvdelen af tilfældene.3
Der er en stærk genotype-fænotype korrelation, hvor mutationer er forbundet med rent neurologisk sygdom eller rent kardiel sygdom.3
Der er en stærk genotype-fænotype korrelation, hvor mutationer er forbundet med rent neurologisk sygdom eller rent kardiel sygdom.3 Opdelingen af ATTRm i kardiel eller neurologisk sygdom kan dog være en oversimplificering, da der er betydelig overlapning mellem de 2 kliniske former på sygdomsspektret.
Den Val30Met-mutation (nu kendt som Val50Met efter at 20 positioner blev tilføjet til det traditionelle mutationsnavn i ATTRm) er den hyppigste mutation på verdensplan og er endemisk i Portugal, Japan og Sverige. Dens anslåede forekomst i Portugal er 1 pr. 538 indbyggere.2 Mallorca (Spanien) og Valverde del Camino (Huelva, Spanien) anses også for at være områder, hvor ATTRm er endemisk. Den anslåede prævalens på Mallorca hos symptomatiske patienter er 3/100 000 indbyggere.5
Val30Met-mutationen forårsager en overvejende neurologisk tilstand med symmetrisk sensorisk-motorisk polyneuropati, som begynder i de nedre lemmer og følger et opadgående mønster. Den kan være forbundet med dysautonomi med ortostatisk hypotension, erektil dysfunktion, urininkontinens og gastrointestinale symptomer. Den begynder typisk i slutningen af det andet eller tredje årti af livet, og op til 43 % af patienterne har hjerteinvolvering, som er en hyppig dødsårsag4 (tabel 1).
Af særlig relevans er Val122Ile-mutationen (p. Val142Ile), som er til stede hos 3 % til 4 % af den sorte nordamerikanske befolkning.3 Selv om dens penetrering er ufuldstændig,3 er denne mutation blevet forbundet med en 47 % øget risiko for at udvikle hjertesvigt (HF).6 En nylig undersøgelse viste, at Val122Ile-amyloidose var den fjerde mest almindelige årsag til HF i den britiske afrokaribiske befolkning.7 Selv om op til 30 % af patienterne med denne mutation kan have træk af mild neuropati,6 ligner den kliniske fænotype normalt den for ATTRwt.4 Val122Ile bør ikke betragtes som en mutation, der udelukkende er forbeholdt den sorte befolkning, da den også kan forekomme i den hvide befolkning. Vi har f.eks. identificeret denne mutation i 4 hvide spanske familier uden sort afstamning.
WILD-TYPE TRANSTHYRETIN AMYLOIDOSIS
Wild-type transthyretin amyloidose blev først beskrevet i 1876. Den blev tidligere kaldt senil amyloidose, men diagnosen hos patienter i alderen 40 til 60 år har gjort dette udtryk forældet. Det er interessant, at det tidligst kendte tilfælde af denne mutation blev fundet hos en 47-årig amerikansk patient.8
Den nøjagtige prævalens af ATTRwt er fortsat ukendt. Undersøgelser tyder dog på, at den er underdiagnosticeret, og at den måske er den hyppigste form for hjerteamyloidose.2,3 Følgende resultater understøtter denne hypotese:
- –
I patienter over 80 år er prævalensen af TTR-aflejring 25 % ved obduktion.3
- –
Hos patienter med HF med bevaret ejektionsfraktion (HFpEF) er moderat-svær TTR-aflejring 5 % ved obduktion9 .
- –
I patienter over 60 år, der er indlagt for HFpEF og venstre ventrikelhypertrofi (LVH) ≥ 12 mm, fandt vores gruppe for nylig en prævalens på 13 %.10
I modsætning til ATTRm er ATTRwt en sporadisk sygdom, der typisk begynder efter 70-års alderen.4 Den findes hovedsageligt hos mænd, og offentliggjorte serier har rapporteret om forekomster på mellem 89 % og 98 %.11,12 I en nylig serie af patienter, der blev diagnosticeret med ATTRwt på 2 hospitaler (Madrid, Spanien og Bologna, Italien), fandt vores gruppe imidlertid, at 20 % var kvinder. Desuden har andre obduktionsundersøgelser også antydet, at ATTRwt hos kvinder kan være mere udbredt end tidligere rapporteret. Derfor bør kvindelig køn ikke mindske den kliniske mistanke om ATTRwt (tabel 1).13
Autopsifund viser, at TTR-aflejring er spredt i forskellige organer i ATTRwt. Imidlertid er aflejringen meget større i hjertet på grund af TTR’s kardiale tropisme, og hjerteinvolvering er den vigtigste kliniske manifestation.4 Patienter kan præsentere symptomer på ekstrakardiel TTR-aflejring såsom lumbalkanalstenose, atraumatisk ruptur af biceps-senen eller “Popeye-tegn” og karpaltunnelsyndrom (CTS)3 (Figur 1). Alle disse træk kan være med til at lede og hurtigt fastslå diagnosen. CTS kan ledsage andre amyloidose-subtyper, men det er mere almindeligt i ATTRwt. Aflejring kan gå flere år forud for kardiale manifestationer.6 Det kan bruges som indikation hos ældre patienter med LVH, især hvis de har bilateral CTS, der ikke er forbundet med specifikke erhvervsaktiviteter, og er i New York Heart Association funktionsklasse ≥ II (upublicerede data).
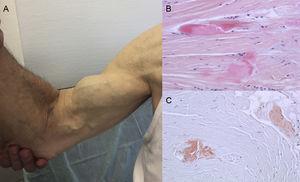
Tegn og symptomer på transthyretinamyloidose. A: ikke-traumatisk ruptur af højre biceps-sene (“Popeye-tegn”). B og C: farvning med hæmatoxylin-eosin (B) og congorødt (C), begge ×200, af karpal ligamentprøve, der viser tætte kollagenbundter med ikke-cellulært materiale. Med venlig hilsen af Dr. Clara Salas Antón.
DIAGNOSE AF TRANSTHYRETIN AMYLOIDOSISKlinisk præsentation
Amyloid kan infiltrere enhver kardiel struktur.1 Typisk øger aflejringen den ventrikulære vægtykkelse, hvilket forårsager et gradvist fald i distensibiliteten, der fører til alvorlig diastolisk dysfunktion. ATTR er derfor traditionelt blevet inkluderet som en årsag til restriktiv kardiomyopati.
Det kliniske spektrum af ATTR er imidlertid meget bredere og mere heterogent. Det mest almindelige symptom ved ATTR er HF. Som nævnt antydede en undersøgelse offentliggjort af vores gruppe i 2015, at en protokol baseret på 99mTc-3,3-diphosphono-1,2-propanodicarboxylsyre (99mTc-DPD) scintigrafi kan være nyttig til diagnosticering af ATTRwt hos en betydelig andel (13 %) af patienter over 60 år indlagt for HFpEF.10 På baggrund af dette resultat blev 99mTc-DPD-scintigrafi inkluderet i de europæiske retningslinjer for HF fra 2016 som et nyttigt værktøj til identifikation af patienter med ATTR.14 ATTR bør dog ikke udelukkende mistænkes hos patienter med HFpEF, fordi den kontraktile funktion forværres, efterhånden som amyloidaflejringen skrider frem, og ATTR kan derfor være forbundet med forskellige grader af systolisk dysfunktion.
Transthyretinamyloidose er en fænokopi af hypertrofisk kardiomyopati (HCM) og kan forveksles med denne. En nyere fransk multicenterundersøgelse rapporterede, at 5 % af patienterne med HCM har ATTRm.15 Vores resultater er imidlertid ikke i overensstemmelse med denne høje rate, hvilket kan være relateret til den store sorte befolkning i Frankrig.
Cardiac conduction abnormalities kan være den første manifestation af ATTR. Amyloidinfiltration af sinus- og atrioventrikulære knuder1 kan indikere behovet for pacemakerimplantation (Tabel 1). Den tidligere nævnte undersøgelse udført i Spanien og Italien fandt, at konduktionsforstyrrelser var den første manifestation af ATTRwt hos 7 % af patienterne med denne sygdom.13
Atriale arytmier er også meget almindelige hos patienter med ATTRwt13 (Figur 2A), og den første manifestation af sygdommen kan være slagtilfælde.4 Faktisk foreslog Mayo Clinic-gruppen for nylig, at ATTRwt bør udelukkes i forbindelse med en diagnose af ikke-valvulært atrieflimmer (AF) hos ældre patienter.8 I modsætning hertil er AF langt mindre almindeligt hos patienter med ATTRm (tabel 1).
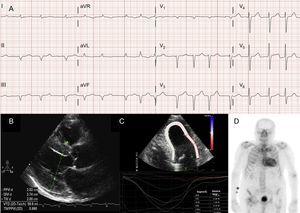
Diagnostiske teknikker i forbindelse med transthyretin hjerteamyloidose (ATTR). A: Elektrokardiogram af en patient med wild-type transthyretin amyloidose (ATTRwt), der viser atrieflimren og pseudoinfarktmønster i inferior afledning. B: ekkokardiogram af en patient med mutant transthyretinamyloidose med Val30Met-mutation, med markant koncentrisk venstre ventrikelhypertrofi og let perikardieudposning. C: longitudinal regional strain hos en patient med ATTRwt, der viser bevarede værdier i det apikale segment og nedsatte værdier i det basale og midtventrikulære segment. D: 99mTc-DPD (99mTc-3,3-diphosphono-1,2-propanodicarboxylsyre) scanning af en patient med ATTRwt, der viser biventrikulær optagelse, der er bedre end knogleoptagelse, svarende til Perugini-grad 3.
Sluttelig bemærker vi, at ATTR og degenerativ aortastenose kan eksistere samtidig hos den samme patient. I 2016 henledte flere undersøgelser opmærksomheden på denne mulighed, og en prospektiv undersøgelse rapporterede, at ATTRwt havde en prævalens på 6 % hos patienter over 65 år, som gennemgik aortaklapudskiftning16 . Denne undersøgelse antydede, at patienter med begge entiteter havde en meget dårligere postoperativ prognose end patienter uden ATTRwt (dødelighed 50 % vs. 6,9 % efter en medianopfølgning på 2,3 år).16 En anden nylig undersøgelse med 99mTc-DPD-scintigrafi hos 43 patienter med aortastenose med lavt flow/lavt gradient identificerede 5 patienter med ATTRwt (prævalens 12 %). 17 Patienter med svær aortastenose og ATTRwt har den samme demografiske profil, og den passende behandling af patienter med begge sygdomme er stadig ikke fastlagt.
Nytte af diagnostiske teknikker
Diagnosen af ATTR er en udfordring i den daglige kliniske praksis. Selv om elektrokardiografi og ekkokardiografi spiller en rolle i diagnosen, har nye ikke-invasive teknikker fået en nøglerolle i vurderingen af patienter med ATTR.
Elektrokardiogram
Sammenhængen mellem lav spænding og hjerteamyloidose har længe været betragtet som ubestridelig.3 De mest udbredte kriterier i klinisk praksis er QRS amplitude 1 Selv om lave elektrokardiografiske spændinger i forbindelse med LVH bør skabe mistanke, var prævalensen i en nutidig serie af ATTR så lav som 20 % til 25 %.3,4,13 Prævalensen varierer også alt efter de anvendte kriterier. For eksempel kan anvendelsen af Sokolow-kriteriet (S-bølge i afledning V1 + R-bølge i afledning V5 eller V6
1,5 mV) øge den beregnede prævalens til mellem 46 % og 58 %.13 Forholdet mellem venstre ventrikels vægtykkelse og den samlede QRS-spænding er blevet anbefalet for bedre at kunne vurdere forskellene mellem resultaterne af de 2 teknikker.2,3 Imidlertid kan op til 20% af patienterne med ATTR opfylde elektrokardiografiske kriterier for LVH.2,3
I de fleste serier af patienter med hjerteamyloidose er pseudoinfarktmønsteret det mest almindelige elektrokardiografiske fund2,3,13 (Figur 2A). På grund af mulig involvering af ledningssystemet er komplette eller ufuldstændige bundle branch blocks også almindelige.3
Echokardiografi
Selv om ekkokardiografi er hjørnestenen i den indledende diagnose af ATTR, er ingen fund specifikke.3 Transthyretin amyloidose har typisk været associeret med en normal eller lille venstre ventrikel med koncentrisk hypertrofi.3 På det 10. internationale symposium om amyloid og amyloidose, der blev afholdt i 2004, blev det ekkokardiografiske kriterium for hjertesygdom på grund af AL i mangel af andre årsager til LVH fastlagt som tilstedeværelsen af LVH med en grænseværdi på 12 mm for interventrikulær septalvægstykkelse4 . Dette kriterium blev senere ekstrapoleret til andre former for amyloidose (Figur 2B), hvilket gav en høj grad af specificitet, men lav sensitivitet.
Selv om koncentrisk LVH er blevet klassisk beskrevet, tyder aktuelle serier på, at ca. 20 % har asymmetrisk LVH.13
Trods den klassiske sammenhæng mellem en normal eller let nedsat venstre ventrikulær ejektionsfraktion (LVEF) og hjerteamyloidose,2 er LVEF-området meget varierende.8 I en nyere undersøgelse udført på Mayo Clinic var en LVEF 8, mens der i vores serie var en LVEF 13 Desuden er brugen af LVEF til vurdering af systolisk funktion ved hjerteamyloidose begrænset, fordi let nedsatte værdier allerede er tegn på relevant hjertesygdom. Denne begrænsning kan overvindes ved brug af vævsdopplerhastigheder, strain imaging og myokardisk kontraktionsfraktion, som er blevet foreslået som mere hensigtsmæssige indeks til vurdering af hjertefunktionen.2
Andre klassiske ekkokardiografiske tegn er højre ventrikelhypertrofi, biatrial dilatation, let perikardieeffusion, atrioventrikulær klapfortykkelse, vægfortykkelse af atrieseptalvæggen og granulært funklende udseende af myokardiet.3,6 Da nogle af disse træk imidlertid blev observeret i en meget udvalgt serie af patienter i avancerede sygdomsstadier, behøver de ikke alle at være til stede for at begrunde mistanke.1
Regional strain imaging er en meget nyttig teknik til tidlig diagnose af patienter med ATTR. Hos patienter med ATTR er den longitudinale belastning nedsat i basale og midventrikulære segmenter, men er bevaret i apikale segmenter18 (Figur 2C). Dette typiske mønster kan være nyttigt ved differentialdiagnostik af ATTR fra andre hjertesygdomme.4
Biomarkører
Der er færre data om den rolle, som N-terminal prohormone of brain natriuretic propeptide (NT-proBNP) og troponin spiller i ATTR, end der er i AL.4 NT-proBNP-niveauerne i ATTR er typisk lavere end i AL,4 hvilket afspejler 2 forskellige patofysiologiske mekanismer: direkte letkædetoksicitet i AL vs. induceret vævsskade af protofibriller i ATTR.
For nylig foreslog Mayo Clinic-gruppen et stratificeringssystem svarende til det, der er gældende for AL. I en kohorte på 360 patienter med ATTRwt blev begge biomarkører vist at være prædiktorer for mortalitet. Patienter i stadie III (NT-proBNP > 3000 pg/mL og troponin T > 0,05 ng/mL) havde en medianoverlevelse på 20 måneder, mens patienter i stadie I og II havde en medianoverlevelse på 66 måneder og 40 måneder (ingen biomarkør eller kun 1 biomarkør over de fastsatte grænseværdier).
Cardiac Magnetic Resonance Imaging
Cardiac magnetic resonance imaging (CMRI) kan anvendes til at opnå strukturelle og funktionelle oplysninger og karakterisere sammensætningen af myokardvævet.3 CMRI er afgørende for den tidlige identifikation af ATTR og for differentialdiagnosen i forhold til andre hjertesygdomme.
Karakteriseringen af væv ved hjælp af CMRI er baseret på følgende egenskaber:
- –
Sene forstærkninger: Et globalt subendokardialt mønster er nærmest patognomonisk for hjerteamyloidose, men er kun til stede hos ca. en fjerdedel af patienterne. Andre mønstre, som f.eks. transmurale (det mest almindelige) eller patching, er også kompatible (figur 3). På trods af den høje sensitivitet og specificitet skal der tages hensyn til, at der kan være et muligt fravær af sen forstærkning (15 % af patienterne) og, efter vores erfaring, en ikke ubetydelig procentdel af falske negativer af tekniske årsager.3 Det transmurale forstærkningsmønster er forbundet med en dårligere prognose og er en uafhængig prædiktor for mortalitet.19
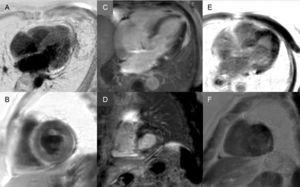 Figur 3.
Figur 3.Diversitet af sene forstærkningsmønstre ved hjertemagnetisk resonansbilleddannelse ved transthyretinamyloidose. A og B: Sen forstærkningssekvenser, henholdsvis 4-kammerplan og kort akse på midterniveau, af en patient med mutant transthyretinamyloidose (ATTRm), der viser diffus patologisk transmural gadoliniumaflejring. C og D: Sen forstærkningssekvenser, henholdsvis 4-kammerplan og kortakset basalplan, af patienter med ATTRm, der viser patologisk gadoliniumaflejring med et lappet mønster, med lavere inferoseptalt og inferolateralt basalt fokalområde. E og F, sene forstærkningssekvenser, henholdsvis 4-kammerplan og kortakset på apikalt niveau, af patienter med ATTRm, der viser omfattende patologisk transmural aflejring, undtagen i basale og midterste anterolaterale segmenter. Med venlig hilsen af Dr. Jesús González Mirelis.
(0.15MB).
Lange T1-tider: T1-kortlægning er en teknik, hvor et kvantitativt myokardialt signal måles før (native T1) eller efter kontrasttilførsel. Native T1-tider er meget lange ved kardielamyloidose.3 T1-mapping kræver ikke indgivelse af kontrast og kan derfor anvendes ved nyresvigt. T1-tider kan endda være unormale, før LVH observeres.3 T1-tider er længere i ATTR end i HCM og kontroller (1097 ms ± 43 ms vs 1026 ms ± 64 ms vs 9,67 ms ± 34 ms, henholdsvis; P
ms ± 68 ms; P = 0,01).20
Kontrastadministration kan bruges til at beregne ekstracellulært volumen (ECV) og vurdere forøgelser af ekstracellulært rum. ECV-værdierne i kardiel amyloidose er højere end i andre hjertesygdomme, undtagen i myokardieinfarktzoner.21 I 2016 rapporterede vores gruppe i samarbejde med andre nationale centre, at ECV-kvantificering kan identificere kardiel involvering i ATTRm og for første gang korrelerede den med graden af neurologisk svækkelse, hvilket understøtter brugen af denne teknik i tidlig diagnose og sporing af ATTRm.22
Kvantitative T1-kortlægnings- og ECV-beregningsteknikker kan være meget nyttige i ATTR til tidlig diagnose, klinisk opfølgning og vurdering af behandlingsrespons (figur 4).
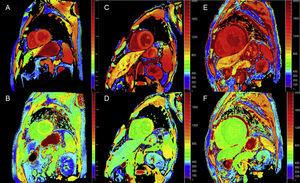
T1-kortlægning, før og efter kontrast, med modificeret look-locker inversion-recovery (MOLLI) i 3T-magnetisk resonansafbildning af hjertet hos raske kontrolpersoner, patient med transthyretinamyloidose og patient med primær letkædeamyloidose. A og B: henholdsvis native T1-kortlægning og ekstracellulært volumen (EV) i en sund kontrol, der viser normale værdier (EV = 0,214). C og D: henholdsvis native T1-kortlægning og EV hos en patient med mutant transthyretin-amyloidose med neurologiske skader og begyndende hjerteinvolvering, forhøjet native T1 og let forhøjet EV (0,361). E og F: henholdsvis native T1-kortlægning og EV hos en patient med wild-type transthyretin-kardiel amyloidose, forhøjet native T1 og meget høj EV (0,626), hvilket afspejler massiv amyloidinfiltration. Med venlig hilsen af Dr. Jesús González Mirelis.
Cardiac Scintigraphy
I 1980’erne blev observation af hjerteoptagelse af flere knoglediphosphonat-tracere histologisk korreleret med tilstedeværelsen af hjerteamyloidose.23 Mekanismen for optagelsen er ikke velkarakteriseret, men den kan være relateret til calciumindholdet i amyloidaflejringer.
En tidlig undersøgelse foretaget af Bologna-gruppen ved hjælp af 99mTc-DPD fandt kardiel optagelse hos 15 patienter med ATTR og fravær heraf hos 10 patienter med AL, idet der blev anvendt en score baseret på biventrikulær optagelse, der var lig med eller højere end knogleoptagelsen (Perugini-score)24 (Figur 2D). Lignende resultater blev efterfølgende rapporteret af vores gruppe og andre.25 Mildt optag (score 1) og moderat optag (score 2) kan findes hos henholdsvis 30 % og 10 % af patienterne med AL.24
Givet dens høje sensitivitet og specificitet er denne teknik yderst nyttig til at fastslå en diagnose af ATTR og kan vise kardiel involvering, selv når ekkokardiografi- og MRI-fund stadig er normale. Faktisk er tilfældige fund af ATTR ikke ualmindelige efter scintigrafi på onkologiske eller reumatologiske indikationer.26
Tc-DPD er ikke tilgængelig i USA, men lignende resultater er blevet rapporteret ved hjælp af 99mTc-PYP (pyrofosfat) billeddannelse.27
Andre radiotracerer er i øjeblikket under undersøgelse. F.eks. er 18F-florbetapir, som allerede er blevet godkendt til afbildning af beta-amyloid i hjernen4 , blevet undersøgt hos patienter med AL og ATTR. Resultaterne viser, at 18F-florbetapir kan påvise myokardiale AL- og ATTR-aflejringer.28 Selv om de tilgængelige data blev opnået i casestudier29 , og de høje omkostninger ved denne radiotracer begrænser dens anvendelse, er der flere undersøgelser i gang om den potentielle fordel ved dens anvendelse i forhold til Tc-DPD som en screeningsteknik for de 2 mest almindelige typer af amyloidose.
Invasiv diagnose
Den endelige diagnose af ATTR er baseret på histologisk påvisning af amyloidfibriller. Selv om der kan være ekstrakardiel aflejring, varierer sandsynligheden for at påvise amyloid ved histologi fra organ til organ.2 Der er kun få undersøgelser af omkostningseffektiviteten af ekstrakardiel biopsi (f.eks. abdominal fedt, gingival, spytkirtel, gastrointestinal) ved ATTR, som er større ved ATTRm end ved ATTRwt. En negativ biopsi af et klinisk upåvirket organ udelukker dog ikke en diagnose af ATTR.4
Som i ATTRwt er endomyokardial biopsi indiceret hos patienter uden ekstrakardiel involvering eller med hjertesygdom alene.3,4 Endomyokardial biopsi er en lavrisikoprocedure (især i erfarne centre), og prøvetagningsfejl er usandsynlige.6
Efter histologisk bekræftelse af amyloidose, som undertiden kan kræve fortolkning af uddannet personale,6 er korrekt klassificering af subtypen afgørende.4 På nuværende tidspunkt afhænger klassificeringen af en kombination af immunohistokemi, genetisk analyse og proteomik:
- –
Immunohistokemi er baseret på brugen af specifikke antistoffer mod kendte amyloidproteiner. Selv om resultaterne af denne teknik typisk er definitive, er den mindre følsom ved genkendelse af lette kæder.4
- –
Denne begrænsning kan overvindes ved brug af massespektrometri, som giver definitive resultater og er kriteriestandard ved bekræftelse af amyloidsubtypen.2 Selv om denne teknik kun er tilgængelig på specialiserede centre, er den især nyttig i ukonklusive tilfælde eller i tilfælde, der er positive for flere antistoffer på immunohistokemi, hvilket efter vores erfaring forekommer i ca. 20-30 % af tilfældene. 4
- –
Da kliniske eller histologiske teknikker ikke kan skelne ATTRm fra ATTRwt, anbefales genetiske undersøgelser i alle tilfælde af ATTR. Opdagelsen af en forårsagende mutation kan være af betydning for at tilbyde genetisk rådgivning og opfølgning til asymptomatiske bærere, 4,30 som kan drage fordel af kommende behandlinger, der forsinker eller endog forhindrer sygdomsudbruddet31 .
Noninvasiv diagnose
Indtil for nylig blev histologiske undersøgelser anset for at være afgørende for diagnosen af ATTR.3 For at lette diagnosen foreslog en international multicenterundersøgelse i 2016 imidlertid en ny algoritme til ikke-invasiv diagnose af ATTR.32
Undersøget analyserede resultaterne af 1217 patienter. Tilstedeværelsen af klassiske tegn på hjerteamyloidose ved hjælp af billeddannelsesteknikker, grad 2 eller 3 Tc-DPD/PYP-optagelse på scintigrafi og fraværet af et monoklonalt protein havde en specificitet og positiv prædiktiv værdi for ATTR på 100 %32 (Figur 5).
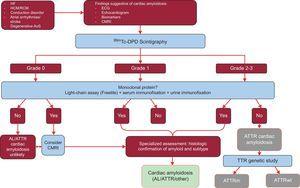
Diagnostisk algoritme for patienter med mistanke om kardiel amyloidose. System til klassificering af 99mTc-DPD-scintigrafi: grad 0, ingen kardiel optag; grad 1, lidt lavere optag end knogleoptag; grad 2, moderat optag svarende til knogleoptag; grad 3, alvorligt optag overlegen i forhold til knogleoptag. ACV, slagtilfælde; AL, primær letkædeamyloidose; AoS, aortastenose; ATTR, transthyretinamyloidose; ATTRm, mutant-transthyretinamyloidose; ATTRwt, wild-type-transthyretinamyloidose; CMRI, cardiac magnetic resonance imaging; ECG, elektrokardiogram; HCM, hypertrofisk kardiomyopati; HF, hjertesvigt; RCM, restriktiv kardiomyopati; TTR, transthyretin.
En vigtig egenskab denne algoritme er fraværet af et monoklonalt protein, der kan forårsage AL på serumkædeassay (Freelite, The Binding Site, UK) og på immunofixeringselektroforese af blod og urin. Tilstedeværelsen af et monoklonalt protein er en indikation for endomyokardialbiopsi for at skelne mellem ATTR og AL.32 Op til 5 % af befolkningen over 65 år har monoklonale gammopatier af ubestemt betydning.2 Hos ældre personer bør en moderat stigning i cirkulerende lyskæder ikke direkte føre til en diagnose af AL. Det er blevet rapporteret, at op til 10 % af ældre patienter med ATTRwt og monoklonal gammopati af ubestemt betydning i referencecentre tidligere havde fået en fejldiagnose af AL.3,33 Det er nødvendigt med en korrekt diagnose for at undgå uhensigtsmæssig kemoterapi. Af interesse har vores hospital dokumenteret 2 tilfælde af patienter med multipel myelom og samtidig ATTRwt på massespektrometri.
BEHANDLING AF TRANSTHYRETIN CARDIAC AMYLOIDOSIS
Behandlingen af patienter med ATTR har 2 mål: at yde medicinsk støtte og om muligt at stoppe eller forsinke amyloidaflejring ved hjælp af specifikke behandlinger.
Medicinsk behandling
De følgende afsnit beskriver understøttende hjertebehandling til patienter med ATTR.
Håndtering af hjertesvigt
Euvolemia skal opretholdes hos patienter med hjerteamyloidose. Kost og livsstilsforanstaltninger er meget vigtige. Diuretika er nøglen til behandling af HF ved ATTR. Da overdreven brug af diuretika imidlertid kan føre til hypotension (ofte på grund af autonom dysfunktion) og forværre den kliniske situation, især i ATTRm, skal der udvises ekstrem forsigtighed i behandlingen.
I behandlingen af HF i ATTR skal der tages hensyn til, at nedsat diastolisk dysfunktion og reduceret slagvolumen fører til kompenserende takykardi for at opretholde hjertekapaciteten. Derfor skal betablokkere anvendes med omhu og individualiseres for hver enkelt patient. Standardpraksis er at fjerne dem i mangel af vanskeligheder med at kontrollere hjertefrekvensen. Denne fremgangsmåde er om muligt endnu vigtigere i ATTRwt på grund af den hyppige forekomst af konduktionsforstyrrelser.6 Calciumantagonister og digoxin kan binde sig til amyloidfibriller og er derfor kontraindiceret i ATTR på grund af risikoen for toksicitet, selv ved terapeutiske doser.6
I modsætning til HF med systolisk dysfunktion som følge af andre ætiologier er der ingen dokumentation til støtte for en prognostisk fordel som følge af brugen af betablokkere, angiotensin-konverterende enzymhæmmere eller angiotensin II-receptorantagonister ved hjerteamyloidose. Faktisk kan brugen af dem føre til klinisk forværring på grund af hypotension og lavt output: en nylig publikation har rapporteret om en dårligere prognose i ATTRm og en neutral effekt i ATTRwt.34
Håndtering af atriearytmier
Håndteringen af AF i ATTR er en udfordring. Det er vanskeligt at opretholde sinusrytme på lang sigt. Elektrisk kardioversion kan dog forsøges, fordi det kan føre til klinisk forbedring.
Tromboembolisk risiko hos patienter med ATTR er meget høj. Desuden kan kronisk amyloidinfiltration føre til mekanisk atriel dysfunktion, hvilket kan være den underliggende årsag til udvikling af atriel trombe hos nogle patienter uden AF. Antikoagulantbehandling ved ATTR bør ikke baseres på CHADS2-VASC-scoren og bør være standardbehandling ved AF. Blødningshændelser er mindre almindelige end i AL, og derfor anbefaler nogle hospitaler antikoagulerende behandling hos patienter med sinusrytme, hvis der er dårlig atriel funktion i henhold til transmitral Doppler-hastighed. Selv om der ikke findes sammenlignende undersøgelser af effektiviteten af direkte orale antikoagulanter vs. vitamin K-antagonister, har vores hospital administreret direkte orale antikoagulanter til udvalgte patienter.
Rolle for udstyr
De nuværende anbefalinger for pacemakerimplantation er de samme i ATTR og i den generelle befolkning. Nogle grupper går dog ind for profylaktisk implantation, især hos patienter med ATTRm og ledningsforstyrrelser.35 Vi går ikke ind for denne forebyggende strategi og har ikke fundet en så høj rate af ledningsforstyrrelser, at profylaktisk implantation er berettiget hos patienter med ATTRm.
Rollen for brug af implantable cardioverter-defibrillatorer (ICD) i ATTR er ikke veletableret. I en lille serie forbedrede ICD-implantation ikke signifikant overlevelsen, selv om den havde en passende effekt hos flere patienter i løbet af de første 2 år.36
Hjerte transplantation
Hjerte transplantation har spillet en mindre rolle i ATTR, fordi ATTRm kan involvere forskellige organer, og ATTRwt typisk rammer ældre patienter. Fraværet af ekstrakardiel involvering hos patienter med ATTRwt gør dem imidlertid til gode kandidater til proceduren. Litteraturen giver eksempler på vellykkede transplantationer hos patienter under 70 år med ATTRwt eller med ATTRm og fremherskende hjerteinvolvering.4
Specifik behandling af Transthyretin Cardiac Amyloidosis
På nuværende tidspunkt er der ingen godkendt behandling til specifik behandling af ATTR hjerteamyloidose, selv om levertransplantation (TxH) alene eller i kombination med hjertetransplantation har været anvendt ved ATTRm siden 1990’erne som en måde at fjerne hovedkilden til forløber-TTR.4
Levertransplantation
The Familial Amyloidotic Polyneuropathy World Transplant Registry37 rapporterede, at mere end 2000 patienter med ATTRm har gennemgået TxH i 20 lande.4 Patienter med Val30Met-mutationen og et overvejende neurologisk klinisk billede har en overlevelsesrate på mere end 50 % efter 20 år.3 Disse lovende resultater er baseret på streng patientudvælgelse i forhold til alder, mutationstype og sygdomsstadie. Den mest almindeligt accepterede indikation for TxH er kombinationen af ung alder, Val30Met-mutationen og tidlige stadier af sygdommen.
De vigtigste begrænsninger ved denne teknik er imidlertid manglen på donorer, behovet for kronisk immunosuppression, høj alder på præsentationstidspunktet og dårligere resultater opnået hos patienter med andre mutationer end Val30Met-mutationen.
Dertil kommer, at den teoretiske undertrykkelse af produktionen af det muterede protein modvirkes af progressiv progressiv indfødt TTR-deponering efter implantationen4,6 , hvis mekanisme ikke er helt forstået. Faktisk påvirker kardiel TTR-aflejring efter TxH morbiditet og mortalitet.
Behovet for bedre at forstå patogenesen af ATTR og begrænsningerne ved TxH har stimuleret udviklingen af flere lægemidler.
Disse nye forbindelser virker på forskellige punkter i TTR-amyloidogenese-kaskaden (figur 6). Behandlingen vil altid omfatte en reduktion af forløberproteinet, selv om det vil være lige så vigtigt at undgå aflejringer og fjerne eksisterende aflejringer. Derfor mener vi, at tilgangen til denne sygdom i fremtiden vil være i form af kombineret behandling.
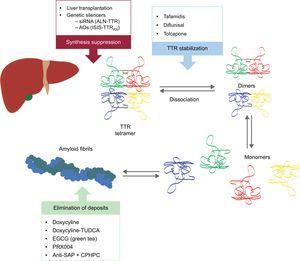
Specifikke behandlinger ved transthyretin hjerteamyloidose og vigtigste mål. AntiSAP + CPHPC, antiserum amyloid P-komponent + (R)-1–6-oxo-hexanoyl]pyrrolidin-2-carboxylsyre; AO’er, antisense oligonukleotider; EGCG, epigallocatechin-3-gallat; siRNA, small interfering RNA; TTR, transthyretin; TUDCA, tauroursodeoxycholsyre.
Suppression af transthyretinsyntese
To forskningslinjer er i gang om hæmning af TTR-leverekspression: brug af small interfering RNA (siRNA) og brug af antisense oligonukleotid (AO)-lægemidler.
- –
SiRNA er dobbeltstrengede RNA-molekyler, der lukker munden på messenger RNA-sekvenser ved specifikt at binde sig til dem og forhindrer proteindannelse. Patisiran (ALN-TTR02) har vist sig at reducere TTR-produktionen med 80 %.38 Hos patienter med ATTRm var TTR-reduktionen 87 %.39 Et fase 2-forsøg har vist lovende resultater med stabile ekkokardiografiske, funktionelle og analytiske parametre efter 12 måneder og 24 måneder.40 Resultaterne af fase 3 neurologisk undersøgelse hos patienter med ATTRm og en subanalyse af patienter med kardiel involvering forventes i 2017 (tabel 2). Et andet lægemiddel, revusiran (ALN-TTR01), administreres subkutant og adskiller sig fra patisiran ved de lipidnanopartikler, der indkapsler siRNA. Dette lægemiddel var genstand for et klinisk fase III-forsøg hos patienter med ATTRm, der har hjertesygdomme. Undersøgelsen blev afbrudt sidste år på grund af en uventet stigning i dødeligheden i behandlingsgruppen (tabel 2).
Tabel 2.Væsentligste igangværende kliniske forsøg med transthyretin-cardiel amyloidose
Virkningsmekanisme Sammensætning Versøg Design Patienter (N) og ATTR-subtype Intervention Primære endepunkter Situation/resultater TTR-synteseundertrykkelse Patisiran (ALN-TTR02) NCT01961921 Phase II-undersøgelse, multicenter 27
ATTRm (11 hjerteinvolvering)Patisiran 0.30 mg/kg IV hver 3. uge i 2 år Langtidssikkerhed. Sekundære endepunkter: effekt på neurologiske lidelser og hjerteparametre Velttolereret lægemiddel, med lignende sikkerhedsprofil i neurologisk og kardiel fænotype
Troponin I, NT-proBNP og ekkokardiografiske data forblev stabile efter 12 mdr. og 24 mdr.NCT01960348 (APOLLO) Fase III, randomiseret, dobbeltblindet, placebokontrolleret, multicenter 225
ATTRm med neurologisk involveringPatisiran infusion IV vs. placebo 2:1 Ændringer i mNIS+7 Forventet november 2017
Subanalyse af patienter med forudsagt kardiel involveringNCT02510261 APOLLO extension study Patisiran infusion IV vs. placebo 2:1 i 52 uger Sikkerhed og bivirkninger på lang sigt Igangværende Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Phase III, randomiseret, dobbeltblind, placebokontrolleret 206
ATTRm med hjerteinvolveringRevusiran 500 mg 5 d, derefter ugentligt i 2 y vs placebo Ændringer i 6-m gangtest og i plasma TTR-værdier Afbrudt på grund af øget mortalitet i revusiran-armen ISISIS-TTRRX NCT01737398 Phase II/III, randomiseret, dobbeltblindet, placebokontrolleret, multicenter 172
ATTRm med neuropati; 50% samtidig hjerteinvolveringISISIS-TTRRX 300 mg SC hver 12. time i 1 uge, derefter ugentligt i 64 uger vs. placebo Ændringer i mNIS+7 og Norfolk spørgeskema om livskvalitet Er ventet september 2017
Fald af alvorlig trombocytopeni og blødning rapporteret
Analyse af ekkokardiografiske parametre og NT-proBNP forventes hos patienter uden hypertension med LVH > 12 mmBehandling af TTR-kardiomyopati med TTR-specifikt antisense oligonukleotid Fase II, åben, ikke-randomiseret 20
ATTRm med hjerteinvolvering og ATTRwtISISIS-TTRRX 300mg SC hver 12 h/wk Ekokardiografiske parametre og hjerte-MRI vs. historiske kontroller Ingen forværring i belastning og nedsat LV-masse på ca. 5%
6 patienter gennemførte 12 mdr; 15 patienter 6 mo; 1 patient TxCNCT02627820 Phase II, åben, ikke-randomiseret 50
ATTRwtISIS-TTRRX 300 mg SC hver 12. time i 1 uge, derefter 1 wk i 18 wk Ændringer i belastning målt ved speckle tracking Afbrudt uden at påbegynde patientrekruttering Fase III-undersøgelse med ISIS-TTRRX til behandling af TTR-amyloidkardiopati Fase III, randomiseret, dobbeltblind, placebokontrolleret, multicenter 490
ATTRwt og ATTRm med hjerteinvolveringISISIS-TTRRX 300 mg SC hver 12. time i 1 uge, derefter ugentligt i 16 uger med placebo, derefter ugentligt i 24 mdr. Død, TxC eller indlæggelse af kardiovaskulære årsager I vente Stabilisering af TTR Tafamidis NCT01994889 Phase III, randomiseret, dobbeltblindet, placebokontrolleret, multicenter 441
ATTRwt og ATTRm med hjerteinvolveringTafamidis 20mg eller 80mg oralt hver 24 timer i 30 måneder vs. placebo Alle-årsagsmortalitet og kardiovaskulær hospitalsindlæggelse Ender februar 2018 NCT02791230 Extension Fase III NCT01994889 330
ATTRwt og ATTRm med hjerteinvolveringTafamidis 20 mg eller 80 mg oralt hver 24 h i 60 mo All-årsagsmortalitet og forekomst af bivirkninger Forventet december 2021 NCT00935012 Phase II, åbent, effekt- og sikkerhedsforsøg 31
ATTRwt eller ATTRm p.Val122Ile med kardiel involveringTafamidis 20mg oralt Sikkerhed og effektivitet Løbende indtil december 2021 Diflunisal NCT00294671 Fase III, randomiseret, dobbeltblind, placebokontrolleret, multicenter 130
ATTRm med neurologisk fænotype (50% med hjerteinvolvering)Diflunisal 250mg oralt hver 12. time vs placebo over 24 mdr NIS+7 på 24 mdr NIS+7 diflunisal vs placebo 16.3 (P Ingen reduktion af ventrikeltykkelse eller belastning hos patienter med hjerteinvolvering vs placebo Eliminering af aflejringer Doxycyclin + TUDCA/UDCA NCT01171859 Phase II, åben, ikke-randomiseret, prospektiv 40
ATTR (25 ATTRm, 13 ATTRwt og 2 domino levertransplantatmodtagere)Doxycyclin 100 mg hver 12. time + TUDCA 250 mg hver 8. time i 12 måneder, derefter 6 mo uden behandling Forbedring 14 patienter trak sig tilbage
Uønskede hudreaktioner, 16 patienter
68 % af de 25 evaluerbare patienter opfyldte det primære endepunkt
Gennemsnitlig forbedring af stamme efter 12 mo og forværring efter 6 mo uden behandlingNCT01855360 Fase II, åben, ikke-randomiseret, prospektiv vs. historiske kontroller 30
Kardiel ATTR-amyloidose (27 ATTRwt og 3 ATTRm). Historiske kontroller, 14 ATTRwt-patienterDoxycyclin 100 mg hver 12. time + TUDCA 250 mg hver 8. time i 18 mo Ændringer i langsgående belastning hver 6. mo 22 patienter afsluttede studiet og var evaluerbare
Større forværring af belastning i kontroller vs. behandlingsgruppe
Øget NT-proBNP i behandlingsgruppe; ikke målt i kontrollerNCT01677286 Fase II, åben, ikke-randomiseret, prospektiv 25
Systemisk amyloidose (6 ATTRwt og 3 ATTRm)Doxycyclin 100 mg hver 12. time i 12 måneder Medicinsikkerhed
Respons af berørte organerForværring af NT-proBNP og nyrefunktion
Ingen forbedring af andre undersøgte parametre
60% af patienterne havde hudkomplikationer, og 30% trak sig tilbage på grund af hud- eller gastrointestinale problemerNCT01171859 Fase II, åben, ikke-randomiseret, prospektiv 45
35 med hjerteinvolvering; 25 ATTRm; 5 ATTRm med TxH; 13 ATTRwt; og 2 domino levertransplantationsmodtagereDoxycyclin 100 mg hver 12. time + TUDCA 250 mg hver 8. time i 12 mdr. i 12 mdr.
Følgende opfølgningsfase uden behandling i 6 mdr.Medicinrespons defineret som et Kardialt respons vurderet hos 25 patienter
68% havde kardialt respons
Forhøjet NT-proBNP og forværring af stammen under opfølgning uden behandling
Højt antal tilbagetrækninger på grund af bivirkninger
14 trak sig tilbage i behandlingsfasen og 5 afbrød i fase uden behandlingEffekt af doxycyclin + UDCA på ATTR Fase II, åben, ikke-randomiseret, prospektiv 28
ATTR med kardiel involvering (27 ATTRm og 1 ATTRwt)Doxycyclin 200 mg/d i 4 uger, derefter suspenderet 2 uger, derefter UDCA 750 mg/d i 12 mdr
Sucessorisk opfølgningsfase uden behandling i 6 mdrÆndringer i NT-proBNP og Kumamoto-score Kun 14% gennemførte undersøgelsen og 36% gennemførte 12 mdr
Ingen ændringer i NT-proBNP efter 6 mdr. og forværring efter 12 mdr.
Stabil LVH
Forværring af Kumamoto-score efter 12 mdr.EGCG NCT01171859 Phase II, åben, ikke-randomiseret, prospektiv 25
ATTRwt600 mg, EGCG i 12 mdr. Ændringer i ECHO og hjerte-MRI (n = 14) Faldet LV-masse 6% ved hjerte-MRI (P = 0.03)
LVEF, myokardietykkelse og MAPSE ved ECHO uændretAntiSAP + CPHPC NCT03044353 Phase II, åben-label, randomiseret 40
Kohorte 1: kardiel ATTR-amyloidose
Kohorte 2: Kardiel ATTR-amyloidose
Kohorte 2: primær amyloidose efter 6 mdr. kemoterapiAnti-SAP + CPHPC månedligt i 6 mdr. Reduceret amyloidbyrde ved hjertem MRT og ECHO Start i 2017 AntiSAP + CPHPC, antiserum amyloid P-komponent + (R)-1–6-oxo-hexanoyl]pyrrolidin-2-carboxylsyre; ATTRm, mutant transthyretin-amyloidose; ATTRwt, wild-type transthyretin-amyloidose; BNP, brain natriuretic peptide; ECHO, echokardiogram; EGCG, epigallocatechin-3 gallat; IV, intravenøs; LV, venstre ventrikel; LVEF, venstre ventrikulær ejektionsfraktion; LVH, venstre ventrikulær hypertrofi; MAPSE, mitral annular plane systolic excursion; mNIS, Modified Neuropathy Impairment Score; MRI, magnetisk resonansbilleddannelse; NIS, Neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, amino-terminalt pro-brain natriuretisk peptid; SC, subkutan; TTR, transthyretin; TUDCA, tauroursodeoxycholsyre; TxC, hjertetransplantation; TxH, levertransplantation; UDCA, ursodeoxycholsyre.
AO’erne er korte strenge af oligonukleotider, der specifikt binder sig til RNA og forhindrer translation og målproteinsyntese.4 ISIS-TTRRX er en subkutan AO med påvist dosisafhængige reduktioner af TTR-værdierne på 75 % til 90 % hos raske frivillige.4 Fase III-forsøget hos patienter med ATTRm og neurologisk fænotype sluttede i marts 2017, og resultaterne forventes at foreligge ved udgangen af 2017. Den amerikanske lægemiddelstyrelse udsatte imidlertid påbegyndelsen af et fase III-forsøg hos patienter med ATTRwt og ATTRm med hjertesygdom på grund af tilfælde af alvorlig trombocytopeni i den neurologiske undersøgelse (tabel 2). Da 50 % af deltagerne i den neurologiske undersøgelse havde hjertesygdom, vil resultaterne af denne kardiologiske delundersøgelse være afgørende for, om fase III-undersøgelsen genoptages. På den anden side foreligger der foreløbige data fra et åbent fase II-forsøg. I denne undersøgelse fik 22 patienter med ATTRwt og ATTRm med hjertesygdom en ugentlig injektion af ISIS-TTRRX. Ifølge rapporten er lægemidlets sikkerhedsprofil meget gunstig, og de mellemliggende data om progression af hjertesygdom ved CMR, NT-proBNP og 6-minutetest er positive.41
Stabilisering af transthyretin
Dissociation af TTR-tetrameren i underenheder er et afgørende skridt i ATTR-fibrildannelsen. Diflunisal og tafamidis er 2 TTR-stabilisatorer med påvist effekt ved ATTRm-polyneuropati.
- –
Tafamidis er et oralt administreret lille molekyle, der binder sig til TTR på T4-bindingssteder ved at stabilisere proteinet og forhindre dets dissociation. Efter offentliggørelsen af resultaterne af et randomiseret dobbeltblindet forsøg med 125 patienter med ATTRm og Val30Met-mutationen i de indledende stadier af neurologisk sygdom42 godkendte Det Europæiske Lægemiddelagentur i 2011 dets anvendelse som et lægemiddel til sjældne sygdomme til at forsinke den neurologiske progression. Nylige data viser, at lægemidlet er effektivt til at opnå neurologisk stabilitet hos mindst 60 % af deltagerne efter mere end 4 års opfølgning. Hidtil har det begrænset anvendelse i forbindelse med ATTR og kardiologiske sygdomme. En fase II-undersøgelse hos 21 patienter med ATTRm og forskellige mutationer viste, at NT-proBNP og ekkokardiografiske parametre forblev stabile efter 12 måneder.43 Data fra en 5-årig kohorteundersøgelse bekræftede, at lægemidlet blev godt tolereret ved en dosis på 20 mg, selv om kun få patienter med ATTRwt forblev stabile efter 3,5 år.44 ATTR-ACT-forsøget er et 30-måneders fase III-forsøg, der vurderer effekten, sikkerheden og tolerabiliteten af doser på 20 mg og 80 mg tafamidis i forhold til placebo hos 440 patienter med ATTRm, ATTRwt og HF. Det primære endepunkt omfatter hospitalsdødelighed og indlæggelse. Dens resultater forventes i 2018.3,27
- –
Diflunisal er et ikke-steroidalt antiinflammatorisk middel, der stabiliserer TTR-molekyler in vitro. Det er ikke tilgængeligt i Spanien, men kan søges medicinsk fra udlandet i forbindelse med compassionate use. En fase III-undersøgelse af ATTRm hos patienter med overvejende neurologisk involvering, hvoraf mere end halvdelen havde hjertesygdom, fandt ingen signifikante forskelle i ekkokardiografiske parametre i løbet af undersøgelsesperioden (tabel 2).45 Dets potentiale for gastrointestinale bivirkninger, nyresvigt, vandretention og hypertension gør det uegnet til patienter med hjertesygdom. Evidensen om diflunisal hos patienter med ATTR er meget begrænset. Der findes én undersøgelse, men den var begrænset af, at den havde et ikke-randomiseret enkeltcenterdesign med ringe opfølgning og få patienter (n = 13). Der var ingen indlæggelser for dekompenseret HF, men der var en betydelig forværring af nyrefunktionen.46
- –
For nylig har en spansk gruppe påvist, at tolcapon (en oral catechol-O-methyltransferasehæmmer, der anvendes til behandling af Parkinsons sygdom) har evnen til at binde in vitro til TTR hos patienter med ATTRwt og Val122Ile med højere affinitet end andre stabilisatorer.47
Eliminering af amyloidaflejringer
Amyloidaflejringer er meget stabile, og det ser ud til, at den menneskelige organisme kun har ringe evne til at eliminere dem. Behandlinger, der forhindrer ny amyloidproduktion, som f.eks. kemoterapi i AL, kan imidlertid gradvist fjerne aflejringer med forskellige organspecifikke hastigheder. Cardiac clearance er særlig lav, og indtil videre er der kun få beviser for regression. Flere molekyler er i øjeblikket ved at blive undersøgt for at fremskynde amyloid-cardiac clearance i ATTR:
- –
Doxycyclin (et almindeligt anvendt antibiotikum) forstyrrer dannelsen af amyloide fibriller. Den synergistiske virkning af kombineret doxycyclin og tauroursodeoxycholisk galdesyre (TUDCA), som anvendes til behandling af leversygdomme, er blevet demonstreret til at fjerne TTR-aflejringer i dyremodeller. En fase II-undersøgelse med 20 patienter viste ingen kardiel eller neurologisk progression efter 1 års behandling med doxycyclin/TUDCA med en acceptabel sikkerheds- og tolerabilitetsprofil.4 Andre fase II-undersøgelser har forsøgt at bekræfte disse resultater ved hjælp af kombineret doxycyclin/TUDCA, doxycyclin/ursodeoxycholsyre eller doxycyclin alene.48-50 De foreløbige resultater af en af disse undersøgelser tyder på en beskyttende effekt med mindre forværring af hjertefunktionen som følge af belastning i behandlingsgruppen. En anden af disse undersøgelser opnåede lignende resultater hos 40 patienter med ATTR: parametre som NT-proBNP, funktionel klasse, LVEF og myokardietykkelse forblev bl.a. stabile efter 12 måneder (tabel 2). Ikke desto mindre havde alle disse undersøgelser en høj frafaldsprocent (35-44 %), hovedsagelig på grund af bivirkninger, især soloverfølsomhed og gastrointestinale klager (op til 30 %).48-50
- –
EGCG (epigallocatechin-3-gallat) er den hyppigst forekommende catechin i grøn te og har in vitro og i en murinmodel vist sig at hæmme amyloiddannelse og fjerne eksisterende aflejringer.4 CMRI viste, at daglig indgivelse af 600 mg EGCG var forbundet med stabilisering af venstre ventrikelmasse i en gruppe på 25 patienter (tabel 2).51
- –
PRX004 er et monoklonalt antistof, der virker ved at binde til monomerspecifikke epitoper og misfoldet TTR. Det fremkalder således eliminering af aflejringer ved at aktivere fagocytose.52 Grundlaget for dets virkningsmekanisme ligner den for et antistof, der anvendes i AL. Fase II-undersøgelser af dette antistof viser lovende resultater. Et fase I-II-forsøg med dette nye antistof skal påbegyndes i 2017.
- –
Uanset hvilken type amyloidprækursorprotein der er tale om, indeholder alle aflejringer serumamyloidkomponent P (SAP). Ved at bruge dette molekyle som mål har anti-SAP-antistoffer vist sig at fremkalde en makrofag-medieret og komplementafhængig reaktion, der forårsagede en større eliminering af viscerale amyloidaflejringer i en murinmodel. Bis-D-prolinforbindelsen CPHPC kan neutralisere plasma-SAP, og samtidig administration sammen med anti-SAP IgG gør det muligt for antistoffet at nå SAP-holdige aflejringer i væv.53 En fase I-undersøgelse offentliggjort i 2015 viste eliminering af leveraflejringer hos 15 patienter med systemisk amyloidose uden hjerteinvolvering med få bivirkninger.53 En fase II-undersøgelse af patienter med ATTR-kardiel amyloidose og AL skal påbegyndes i 2017 (tabel 2).
KONKLUSIONER
Transthyretin kardiel amyloidose diagnosticeres med stigende hyppighed. 99mTc-DPD-scintigrafi og CMRI er eksempler på teknikker, der kan anvendes til enkel og tidlig identifikation af patienter med ATTR.
Flere ATTR-specifikke lægemidler er i øjeblikket i de sidste faser af forskningen. Derfor mener vi, at ATTR-kardiel amyloidose snart vil blive betragtet som en behandlelig enhed snarere end en dødelig sygdom.
FUNDING
Dette arbejde blev udført med delvis støtte fra Carlos III Health Institute og det spanske selskab for kardiologi (forskningsbevilling 2016 til E. González-López). Bistand fra Carlos III Health Institute er finansieret af den europæiske fond for regionaludvikling “Another Way to Make Europe”.
Interessekonflikter
E. González-López har deltaget som taler i aktiviteter arrangeret af Pfizer. P. Garcia-Pavia har modtaget betalinger som taler i forbindelse med aktiviteter arrangeret af Pfizer og som konsulent for Alnylam, Prothena og Pfizer. E. González-López, A. López-Sainz og P. Garcia-Pavia erklærer, at Pfizer har finansieret forskningsprojekter fra deres institution.