Dette er noter fra forelæsning 4 i Harvard Extension’s kursus i cellebiologi.
Den sekretoriske vej refererer til det endoplasmatiske retikulum, Golgi-apparatet og de vesikler, der bevæger sig imellem dem, samt cellemembranen og lysosomer. Den kaldes “sekretorisk”, fordi den er den vej, ad hvilken cellen udskiller proteiner til det ekstracellulære miljø. Men som sædvanlig fortæller etymologien kun en brøkdel af historien. Denne vej behandler også proteiner, der bliver membranbundne (enten i cellemembranen eller i selve ER- eller Golgimembranen), samt lysosomale enzymer og også alle proteiner, der kommer til at leve deres liv i selve den sekretoriske vej. Den gør også nogle andre ting end at behandle proteiner.
Cytosolen og “lumenet” (den væske, der fylder sekretorvejen) er forskellige kemiske miljøer, og de blandes normalt aldrig. Cytosolen er reduktiv (når du er i cytosolen, bliver du ved med at møde molekyler, der vil tilbyde dig elektroner), og ER, Golgi og det ekstracellulære miljø er oxidativt (molekyler bliver ved med at komme op til dig og bede om elektroner). Se redox, hvis du stadig er forvirret. Dette giver forskellige betingelser for proteinfoldning: f.eks. dannes disulfidbindinger normalt kun under oxidative forhold. Desuden kan forskellige proteiner kun leve i den sekretoriske vej eller kun i cytosolen. Sekretionsvejen giver cellen mulighed for at håndtere ting, som det måske ikke er godt at have i cytoplasmaet, og/eller som er mest nyttige, når de holdes koncentreret i et specialiseret rum med deres ønskede interaktionspartnere. Hepatocytter (i leveren) oplagrer lægemidler og toksiner i det glatte ER og nedbryder dem til udskillelse fra kroppen der. Sekretionsvejen er ikke sammenhængende, men enhver bevægelse mellem dens komponenter foregår i små boblende mikrokosmos af sin egen kemiske verden, kaldet vesikler.
Mange proteiner, der går gennem sekretionsvejen, berører aldrig cytosolen – bortset fra de dele af membranproteiner, der stikker ud på den cytosoliske side. Mange af dem har brug for chaperoner til at hjælpe med foldningen og/eller en hel række posttranslationelle modifikationer for at være klar til deres oprindelige funktion, og den sekretoriske vej har specialiseret sig i at give dem alt dette.
Der vil i dagens foredrag blive fokuseret på, hvordan proteiner bliver oversat til ER, og hvordan de rejser (i vesikler) mellem ER, Golgi og andre destinationer. Dette er smukt skildret i videoen Life of the Cell:
Det endoplasmatiske retikulum er det første trin i sekretionsvejen. Dets membran er sammenhængende med den ydre kernemembran, selv om det ikke er klart, hvorfor det har betydning, da det ikke er sådan, at proteiner begynder deres liv i kernen. Snarere driver mRNA’er rundt i cytoplasmaet, indtil de bliver opsamlet af et ribosom, der er interesseret i at oversætte dem. Ved “posttranslationel translokation” flyttes det nye protein ind i ER’et, efter at det er blevet oversat. I det mere interessante fænomen, der kaldes “cotranslational translokation”, starter ribosomet oversættelsen ligesom ethvert andet protein, men et eller andet sted i de første 16-30 aminosyrer rammer det et signalpeptid (også kaldet signalsekvens). Dette signalmotiv består ofte af 1 positivt ladet aminosyre efterfulgt af 6-12 hydrofobiske aminosyrer. Dette motiv bliver genkendt af en signalgenkendelsespartikel (SRP, et “ribonukleoprotein” eller et hybrid RNA/proteinmolekyle), som binder sig til det og forhindrer ribosomet i at fortsætte oversættelsen. Oversættelsen standses, indtil ribosom/SRP-komplekset møder en SRP-receptor på ER-membranen. Når de mødes, binder SRP og dets receptor hver et GTP-molekyle i ER-membranen, hvilket tilsyneladende forstærker deres interaktion. Heldigvis sker alt dette ved siden af en Sec61-translocon – et proteinkompleks, der danner en kanal, som krydser ER-membranen. Transloconet er faktisk et kompleks af tre forskellige proteiner (gener: SEC61A1 eller SEC61A2, SEC61B, SEC61G), hvoraf Sec61a-underenheden har 10 membranoverskridende a-helixer, som danner kanalen. Når ribosomet er docket ved membranen, fortsætter det oversættelsen og skubber signalpeptidet og til sidst hele proteinet gennem kanalen ind i ER-lumenet. Når translationen stopper, hydroliserer både SRP og SRP-receptoren deres GTP for at frigøre hinanden og ribosomets last (dette må kræve energien fra GTP, da den oprindelige binding var nedadgående), en signalpeptidase kløver signalpeptidet af det spirende protein, og proteinet er frit til at begynde at folde sig i ER.
Et par andre aktører er involveret for nogle ER-proteiner. Oligosaccharidtransferase, som tilføjer glykosylgrupper til asparaginer i det nascent protein, er en del af transloconkomplekset, og den udfører faktisk glykosylering, mens det nye protein stadig er under oversættelse. Så selv om vi kalder glykosylering for en “posttranslationel modifikation”, foretages den i dette tilfælde faktisk under translationen. For at opnå den rette struktur skal nogle proteiner også være fuldt oversat, før de kan begynde at folde sig. Hvis den N-terminale del fik lov til at begynde at folde sig, så snart den kom ind i lumenet, ville det ende med den forkerte overordnede struktur. For at forhindre dette binder chaperonen BiP nogle gange proteinet for at holde det ufoldet i et stykke tid. Forestil dig BiP som en anden Pac-Man, der bider sig fast i proteinet for at holde det lineært, ligesom Hsc70 i mitokondriernes målretningsproces (se sidste uge).
Her er en video af det:
De første par minutter viser det grundlæggende scenarie, der er beskrevet ovenfor. Derefter går den over til et mere komplekst scenarie, som jeg vil præsentere om et øjeblik. FYI, videoen viser to “kontroversielle” ting, der ikke er medtaget i ovenstående beskrivelse: (1) signalpeptidet, der nedbrydes i membranen, og (2) et “plug-protein”, der stopper kanalen før/efter translation. Ikke alle forskere er enige om disse to ting endnu.
Alle de proteiner, som vi ved går gennem den sekretoriske vej, blev udpeget der af folk, der laver lokaliseringsforsøg for at se, hvor i cellen et protein ligger. En underlig kendsgerning om ER er, at man kan putte cellen i en blender, og bagefter vil ER bare begynde at genforbinde sig selv og danne små ‘mikrosomer’, der ikke er knyttet til kernen, men danner sammenhængende bobler af ER. Derefter kan man begynde at lege med proteaser – som nedbryder proteiner – og detergenter – som opløser ER-membranen. Hvis du antager, at dit protein af interesse er oversat, kan du kontrollere, om det (1) overlever proteasebehandling, men (2) ikke overlever protease + detergentbehandling, så er det et protein fra sekretoriske veje. Logikken er, at i tilfælde (1) var det beskyttet inde i ER’et, men i tilfælde (2) opløste du ER’et, så det blev spist af proteasen. Alt dette forudsætter, at man har et antistof eller en anden måde at påvise, om det interessante protein er der efter disse behandlinger.
Man har også brugt sådanne teknikker til at finde ud af, at kun 70 aminosyrer af et nyt protein kan oversættes, før det bliver for sent for dette protein at ende i ER’et. Husk, at signalpeptidet befinder sig i de første 16-30 aminosyrer, og translokationen til ER afhænger af, at SRP er til stede. Ribosomer oversætter med en forudsigelig hastighed, så man satte ribosomer i gang med at oversætte noget mRNA og ventede derefter i bestemte tidsrum med at tilsætte SRP for at se, hvor meget oversættelse der kunne ske, før SRP ikke længere kunne gøre sit arbejde.
SRP-receptoren og Sec61-proteinerne er ER-membranproteiner – og der er også mange andre ER-membran-, Golgimembran- og lysosomembranproteiner. Faktisk bliver selv membranproteinerne (se klasse 02) i cellemembranen behandlet i sekretionsvejen. Mange af disse har flere eller snesevis af transmembrandomæner (20-25 hydrofobiske aminosyrer hver), som skal indsættes i den rigtige rækkefølge og orientering (f.eks. vil man virkelig gerne have sine ionkanaler og transportører rettet i den rigtige retning, ind mod ud af cellen). Der findes derfor en masse smarte biologiske mekanismer til at få disse proteiner indsat korrekt i membranen. Det er det, som den sidste halvdel af ovenstående video viser.
Så her er en tautologi: Nogle proteiner har en topogen sekvens, som bestemmer deres orientering i membranen. Denne sekvens består af to typer signalsekvenser:
- En stop-transfersekvens (af en eller anden grund forkortet STA) er en 22-25 hydrofob aminosyresekvens et sted i midten af proteinet, der danner en alfa-helix. Når den bliver mødt, bliver den skubbet ind i membranen, og derefter fortsætter translationen af resten af proteinet i cytosolen. Dette “fortryder” altså på en måde den translokation til ER, som blev startet af signalpeptidet i begyndelsen (N-terminus) af proteinet.
- En signalankersekvens (forkortet SA) er også en 22-25aa hydrofob alfahelix, men med en række ~3 positivt ladede aminosyrer på venstre eller højre side. Ligesom signalpeptidet genkendes dette af SRP, som bringer ribosomet til ER. Men i modsætning til signalpeptidet vil denne alfa-helix-sekvens blive indsat i ER-membranen. Orienteringen af indsættelsen bestemmes af de 3 positivt ladede aminosyrer. De positive ladninger skal altid ende på den cytosoliske side, så hvis de kommer efter (dvs. C-terminal af) den hydrofobiske sekvens, ender proteinet med sin C-terminale ende pegende ind i cytosolen, men hvis de kommer før (dvs. N-terminal af) den hydrofobiske sekvens, ender proteinet med sin N-terminus pegende ind i cytosolen.
Med disse to signaler som byggesten kan man forestille sig et protein med en række stopoverførsels- og signalankersekvenser for at skabe en hel række frem- og tilbageløbende transmembrandomæner, der er syet ind i membranen som af en symaskine. Man har inddelt membranproteinerne i fem kategorier:
- Type I har kun et signalpeptid og derefter en stopoverførsel i midten. Derfor ender den med sin (hydrofile) N-terminus i lumen, sin (hydrofobiske) midte i membranen og sin (hydrofile) C-terminus i cytosolen.
- Type II starter ikke med et signalpeptid. Det starter som ethvert andet protein, men i midten har det en signalankersekvens, hvor +++ aminosyrerne kommer først og den hydrofobiske serie kommer bagefter. Dette gør, at proteinet bliver translokeret midtvejs i translationen, hvor den allerede oversatte N-terminale del stikker ud i cytosolen (da +++ skal forblive cytosoliske) og den nu begyndende C-terminale del bliver oversat direkte ind i ER’et. Så den ender som transmembran med sin C-terminus i ER og N-terminus i cytosolen – modsat type I.
- Type III er som type II – intet signalpeptid, blot et signalanker i midten, men i dette tilfælde kommer +++ efter den hydrofobiske sekvens, hvilket vender orienteringen om. Så dette ender med at have sin N-terminus i ER og sin C-terminus i cytosolen. Modsat type II og i sidste ende det samme som type I, selv om den er kommet dertil på en anden måde – den har ikke et signalpeptid, der bliver spaltet af i ER.
- Type IV eller “multipass”-proteiner har en vekslende serie af signalsekvenser og stopoverførselssekvenser. Disse er klart mere end én ‘type’, men er alligevel ikke nær så forskellige, som din kombinatoriske fantasi måske tillader. Orienteringen af den første signalsekvens bestemmer, om N-terminus ender i cytosolen eller ER, og det samlede antal stopoverførsels- + signalankersekvenser bestemmer, hvor C-terminus ender: et lige antal = samme side som N-terminus, ulige antal = modsat side som N-terminus. STA- og SA-sekvenserne skal veksle strengt, med den undtagelse, at man kan starte med to signalankersekvenser, hvis den første er orienteret med N-terminus ind i cytosolen. Bare for at gøre grin med dette kategoriseringsskema har folk defineret nogle ufuldstændigt definerede undertyper af type IV, hvor type IVa er N-terminal i cytosol (det starter altså som et type II-protein) og type IVb er N-terminal i lumen (det starter som et type III-protein, men har derefter en anden SA-sekvens, der sætter det tilbage i ER). GLUT1 fra klasse 02 er en Type IVa.
- GPI-forankrede proteiner, som er den femte type, men ikke kaldes Type V, starter med et signalpeptid og slutter med en hydrofob C-terminus, som forbliver indlejret i membranen. Den hydrofobiske ende spaltes af og erstattes med GPI, som også forbliver indlejret i membranen. PrP er en af disse – mere om det senere.
Hvor vi nu har diskuteret, hvordan proteiner kan ende i ER-lumenet eller spænde over ER-membranen. De fleste proteiner forlader ER inden for få minutter, transporteres i vesikler, der er bundet til Golgi og senere til udskillelse, lysosomer eller cellemembranen. Denne fremadgående retning kaldes anterograd; at gå baglæns fra Golgi til ER er retrograd transport.
Både typer af transport finder sted i membranbundne vesikler. Disse udløses af membranen på det sted, de kommer fra, og smelter senere sammen med membranen på det sted, de er på vej hen – smukt afbildet ved ~2:25 i Life of the Cell-videoen ovenfor. Det organ, hvorfra vesiklerne dannes, er “donorrummet”, og det sted, de senere smelter sammen til, er “acceptorkompartmentet”.
Den spirende proces kræver, at G-proteiner i membranen rekrutterer Coat-proteiner. Specifikt for anterograd transport rekrutterer G-protein Sar1 (gen: SAR1A) COPII (“cop two”); for retrograd transport rekrutterer et ARF G-protein COPI (udtales “cop one”). Disse G-proteiner aktiveres til at udføre dette arbejde, når GEF lader dem med GTP og udskifter GDP.
Så trinene i anterograd transport er f.eks. som følger:
- Sec12-GEF (Sec står for sekretorisk) lader Sar1 med GTP. Når Sar1 er bundet til GDP, flyder den bare rundt i donorkammeret, men når den er bundet til GTP, undergår den en konformationsændring, der får dens ellers begravede N-terminale hydrofobiske hale til at stikke ud, hvilket får den til at stikke ind i membranen, hvor COPII-proteiner så begynder at ophobes, fordi de virkelig godt kan lide den hale.
- COPII’erne begynder at polymerisere og har på grund af sin konformation en iboende præference for krumning, så deres ophobning begynder at få knopdannelse til at ske. Samtidig bliver membranbundne proteiner, der skal transporteres – identificeret ved en DXE (dvs. aspartat-anything-glutamat) aminosyresekvens, der danner et bindingssted i deres cytosoliske del – rekrutteret til den nyligt dannede vesikel. Membranbundne proteiner fungerer som receptorer, der rekrutterer lumenale proteiner, der er bundet til Golgi, til at hænge ud i det konkave rum, hvor de vil ende i vesiklen, når den dannes.
- Når der er kommet nok COPII’er til, knopper vesiklen af, hvorefter Sar1 hydrolyserer sin GTP, hvilket giver den energi til at suge sin hydrofobiske hale ind i sig selv igen og skære COPII’erne løs. Vesiklen er nu løsrevet fra donorrummet.
- Nu, af dårligt forklarede (eller dårligt forståede?) grunde, skilles COPII’ernes kappe bare ad og blotlægger receptorer under kappen, som styrer vesikelens målretning. Når vesiklen ankommer til sin destination, interagerer Rab-GTP, der er indlejret i vesikelmembranen, med en Rab-effektor, der er indlejret i acceptørkompartmentets membran. Der udveksles et sideløbende blik, og interessen er vakt. Snart vil vesiklen smelte sammen med membranen.
- SNARE-proteiner, der er til stede på både vesiklen og målmembranen (henholdsvis V-SNARE og T-SNARE), interagerer for at bringe membranerne endnu tættere på hinanden. I dette eksempel betragter vi VAMP (VAMP_-generne) som V-SNARE og Syntaxin (STX__-generne) og SNAP25 (SNAP25-genet) som T-SNARE’er. Syntaxin og SNAP25 er begge membranproteiner; Syntaxin har 1 alfa-helix og SNAP25 har 2, alle på den cytosoliske side. Alfa-helicerne styrer interaktionen med VAMP. De modsatte siders alfa-helixer har en ekstremt stærk affinitet for hinanden, hvilket bringer membranerne tæt nok på hinanden til at smelte sammen. Når dette er sket, kræver det to proteiner at skille V-SNARE’erne og T-SNARE’erne fra hinanden igen: NSF (gen: NSF; står for NEM sensitive factor) og alpha-SNAP (gen: NAPA), et opløseligt NSF-fastgørelsesprotein. NSF er en ATPase og forbrænder ATP for at drive den energimæssigt opadgående adskillelse af komplekset.
Nu til retrograd transport. Hvorfor er der overhovedet retrograd transport? Her er en ikke-udtømmende liste over nogle årsager:
- Nogle membranproteiner starter deres liv i ER, skal modificeres i Golgi, men skal derefter tilbage til ER. Det gør de med en KKXX-aminosyresekvens.
- Der er også en KDEL-aminosyresekvens ved C-terminus af nogle lumenale proteiner, som formodes at holde dem i ER, men det er ikke perfekt – nogle gange ender de i Golgi, og i så fald bliver de målrettet tilbage til ER via retrograd transport, der er afhængig af denne KDEL-sekvens til genkendelse. Mekanismen er ret fin – de proteiner, der genkender og binder til KDEL, gør det kun ved lav pH, og pH i Golgi er lavere end i ER, så de binder KDEL i Golgi og frigiver det, når de er tilbage i ER’s mere neutrale pH.
- Tænk også på, at alle de proteiner, der deltager i anterograd transport – V-SNARES, Rab osv. – skal tilbage til ER, så de kan gøre det hele igen, ligesom bussen skal tilbage til busdepotet sidst på dagen.
- Som vi vil se om lidt, kommer Golgi i flere faser, som er afhængige af tilsætning af enzymer længere nede ad vejen.
Processen for retrograd transport er ikke så forskellig fra den anterograde. Den anvender ARF i stedet for Sar1, COPI i stedet for COPII, men den fungerer på samme måde: ARF ladet med GTP lader sin hydrofobiske hale stikke ind i membranen og tiltrækker COPIs opmærksomhed. COPI har to komponenter, COPIalpha og COPIbeta, som begge interagerer med denne KKXXX-sekvens for at rekruttere membranbundne proteiner bestemt til retrograd transport. Nogle proteiner har også en RR-sekvens (hvor som helst i proteinet), som kan markere dem til retrograd transport.
Golgi-apparatet er ikke sammenhængende. Det er et stablet sæt af separate underkompartmenter kaldet sække eller cisterner. De forskellige kompartmenter har forskellige egenskaber, og proteiner besøger dem i en bestemt rækkefølge. I rækkefølge fra ER til cellemembranen kaldes Golgi-kompartmenterne cis-, medial-, trans- og trans-Golgi-netværket. Hvert rum har forskellige enzymer, der modificerer proteiner, og modifikationerne skal ske i en bestemt rækkefølge, og derfor er der behov for et stablet sæt af rum.
Men når proteiner modnes i Golgi, er det ikke sådan, at de springer ud i vesikler fra et rum og bevæger sig til det næste. Det er snarere sådan, at det rum, de allerede befinder sig i, bevæger sig udad og “modnes”, efterhånden som nye enzymer tilføjes til det (fra længere nede i Golgikæden) via retrograd transport. Mærkeligt, ikke sandt? Det er lidt ligesom, hvis du i stedet for at flytte fra en folkeskole til en mellemskole til en gymnasieskole bare blev i samme skolebygning i hele din barndom og ungdomsårgang, og de bare bragte nye lærebøger og lærere ind hvert år for at holde det passende til den klasse, som du og dine klassekammerater nu havde nået. Sådan ser Golgierne ud, når de bevæger sig og udvikler sig:
Så der er (lidt eller) ingen anterograd transport i Golgierne, men masser af retrograd transport for at bringe hver ny runde af enzymer ind. Når proteinerne endelig har gennemført hele K-12 pensum i Golgi-netværket, gennemgår de transport for at bevæge sig videre til deres endelige bestemmelsessted. De udgår i en vesikel, som vil gå et af tre steder hen:
- Exocytose – fusion med cellemembranen. Således vil lumenproteinerne blive udskilt ekstracellulært, og membranproteinerne vil blive til cellemembranproteiner.
- Sekretoriske vesikler – disse bliver bare hængende som vesikler i cellen, indtil der er brug for dem – hvor “brug for” betyder, at de til sidst gennemgår eksocytose. I neuroner er det her, at neurotransmittere opbevares, indtil et aktionspotentiale kræver deres udskillelse i synapsen. I maven opbevarer de celler, der producerer maveenzymer, disse enzymer i sekretoriske vesikler, indtil fødeindtagelse udløser deres frigivelse i maven.
- Lysosomer – hvor fejlfoldede proteiner går hen for at blive nedbrudt.
Transporten fra trans-Golgi-netværket videre til disse destinationer er anderledes end den øvrige transport, der er omtalt ovenfor, og involverer ofte clathrin (CLT__-gener). Vesikler, der knopper af, har en to-lags kappe, med adapterproteinkomplekser (AP) som det indre lag og clathrin som det ydre lag. Adapterproteinerne har et målsignal med et YXXh-motiv (h = Φ = en hvilken som helst hydrofob aminosyre). Clathrin danner den såkaldte ‘clathrin-triskelion’-formation, der er vist her:

(Billede takket være Wikimedia Commons-brugeren Phoebus87)
Clathrin er også ansvarlig for endocytose – afknopning af vesikler med ekstracellulære ting (og cellemembranproteiner), der kommer ind i cellen. Dette kaldes clathrin-medieret endocytose. Receptorer i cellemembranen endocyttes meget hyppigt: hele populationen af hormonreceptorer vendes omkring hver time, især når der modtages hormoner. Optagelse af receptoren i en vesikel er en måde, hvorpå cellen kan afskære det indkommende signal, indtil det kan behandles.
I plasmamembrannoterne diskuteres cystisk fibrose kort: CFTR er en ABC-transportør, der er ansvarlig for at pumpe Cl- ud af cellen (den lukker også Na+ ind). Loss-of-function-mutanter pumper ikke Cl-, hvilket fjerner drivkraften for osmose, hvilket gør slimmet tykkere og forårsager vejrtrækningsproblemer. Der findes mindst 127 forskellige CFTR-mutanter med tab af funktion (det er i hvert fald så mange, som Natera tester for), som (hvis begge alleler er inaktive) forårsager cystisk fibrose. Den mest almindelige mutation er ΔF508, som udgør ~3 % af alle europæiske CFTR-alleler og ca. 70 % af de muterede alleler. Tabet af denne ene phenylalanin ændrer CFTR’s konformation, så den di-syre exit-kode (aminosyrerne D565 og D567), der målretter CFTR til exocytotiske vesikler, ikke længere er korrekt eksponeret, og proteinet når aldrig frem til cellemembranen .
diskussionsafsnit
I afsnittet læste vi Hu 2009, som viste, at atlastinproteiner er involveret i at skabe det tubulære ER-netværk. Beviset kom næsten udelukkende fra protein-protein-interaktioner. Jeg var overrasket over, at dette papir var en stor sag, for der har været en million papirer, der viser protein-protein-interaktioner for huntingtin, og ingen tror virkelig på dem alle, og det har ikke nødvendigvis bragt os tættere på at vide, hvad huntingtin gør, eller hvad der går galt i Huntingtons sygdom. Men tilsyneladende har Hu været i stand til at argumentere ret klart for, at atlastinernes interaktioner med reticuloner indebærer en rolle i ER-dannelsen. Det hjælper, at Hu var i stand til at påvise en “genetisk interaktion” ud over en fysisk (bindings)interaktion. En ‘genetisk interaktion’ (jeg var nødt til at slå det op) betyder, når “Nogle gange giver mutationer i to gener en fænotype, som er overraskende i lyset af hver enkelt mutations individuelle virkninger. Dette fænomen, som definerer genetisk interaktion, kan afsløre funktionelle relationer mellem gener og veje.” .
PrP
Dette er et årti gammelt, så nogle ting er måske forældede, men jeg fandt Harris 2003 (ft)’s gennemgang af PrP-cellebiologi ekstremt klar og nyttig. Kim & Hegde 2002 var også nyttig. PrP er et sekretorisk vejprotein. Dets første 22 aminosyrer (MANLGCWCWMLVLFVATWSDLGLC) er et signalpeptid, der forårsager cotranslational translokation til ER. Normalt bliver PrP blot GPI-linked ved sin C-terminus og forankres på den exoplasmatiske side af membranen. Men aminosyrerne 111-134 (HMAGAAAAGAGAVVVGGLGGGGYMLGSAM) er en slags svag signalankersekvens (type II, hvor +++ aminosyrerne kommer før signalankeret), der nogle gange, men ikke altid, bliver et transmembrandomæne, hvorved C-terminus inverteres ind i lumenet. Endnu mere forvirrende er det, at denne sekvens nogle gange bare kan ende som et transmembrandomæne uden inversionen, således at N-terminus er i lumenet. Der er altså tre membrantopologier af PrP: almindelig gammel GPI-forankret og to transmembranorienteringer, som afbildet i Harris 2003 Fig 3:
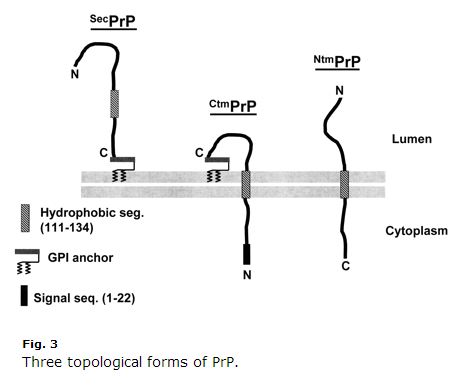
Bemærk, hvor underlig CtmPrP er. Den er transmembran men også GPI-forankret, og det N-terminale signalpeptid bliver aldrig spaltet af. Normalt udgør transmembranformerne < 10 % af det samlede PrP. Under visse laboratorieforhold er procentdelen højere, og to af de GSS-fremkaldende mutationer (A117V og P105L) øger også andelen af CtmPrP til 20-30 % af al PrP. Af disse tre former er der en god mængde beviser for, at CtmPrP er giftigt, og at det kan spille en rolle i priondannelsen, selv om de fleste genetiske prionsygdomsmutationer (herunder FFI D178N) ikke synes at påvirke PrP’s membrantopologi eller fraktionen af CtmPrP.
Når PrP går gennem Golgi, er det målrettet mod cellemembranen. Men ifølge Harris sidder det ikke bare der – det gennemgår ofte clathrin-medieret endocytose og cykler gennem cellen hvert ~60 minut, hvor nogle molekyler spaltes ved hver cyklus. Kobber stimulerer denne endocytose af PrP. De fleste genetiske prionsygdomsmutationer ændrer lokaliseringen af PrP – normalt når der er tale om en mutation, findes mindre PrP på celleoverfladen, mens mere ophobes i ER.