Som vi har set, indeholder vores kost mange kulhydrater, og du spekulerer måske på, om der er en måde at analysere en prøve på for at se, om det er saccharose eller et af de syntetiske sødestoffer som sorbitol eller majssirup med højt fructoseindhold, eller endda en forbindelse som C-vitamin, der syntetiseres fra sukkerstoffer og ligesom disse kun indeholder C, H og O. Der findes en sådan måde, og det er en af de mest fundamentalt vigtige former for analyse, der kaldes elementaranalyse. Det er en af de første metoder, som forskerne bruger til at identificere en ny forbindelse.
Hertil har vi fået alle stoiometriske forhold ud fra koefficienterne i afbalancerede kemiske ligninger. Kemiske formler angiver imidlertid også relative stofmængder, og stoichiometriske forhold kan også udledes af dem. F.eks. fortæller formlen CO2 os, at uanset hvor stor en prøve af kuldioxid vi har, vil der altid være 2 mol iltatomer for hvert mol kulstofatomer. Det vil sige, at vi ud fra formlen CO2 har det støkiometriske forhold
\
Vi kan også bestemme, at for CO2
\
\
(De reciprokke af disse støkiometriske forhold er også gyldige for CO2.)
Støkiometriske forhold, der er afledt af formler i stedet for ligninger, indgår i den mest almindelige procedure til bestemmelse af de empiriske formler for forbindelser, der kun indeholder C, H og O. En afvejet mængde af det stof, der skal analyseres, anbringes i et forbrændingsrør og opvarmes i en strøm af tørt O2. Alt H i forbindelsen omdannes til H2O(g), som selektivt opfanges i et forud afvejet absorptionsrør. Alt C omdannes til CO2(g), som optages selektivt i et andet rør. Masseforøgelsen i hvert rør fortæller, hvor meget H2O og CO2 der blev produceret ved forbrænding af prøven
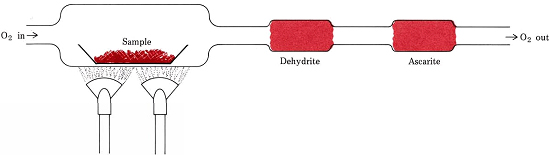
Figur \(\PageIndex{1}\) Et forbrændingstog. H2O og CO2, der er dannet ved kombination af O2 med H og C i prøven, absorberes selektivt af rør, der indeholder dehydrit og ascarit (NaOH på asbest).
Eksempel \(\PageIndex{1}\): Empirisk formel for ascorbinsyre
En prøve på 6,49 mg ascorbinsyre (C-vitamin) blev forbrændt i et forbrændingstog. Der blev dannet 9,74 mg CO2 og 2,64 mg H2O. Bestem den empiriske formel for ascorbinsyre.
Løsning Vi skal kende mængden af C, mængden af H og mængden af O i prøven. Forholdet mellem disse giver subscripterne i formlen. De to første kan fås ud fra masserne af CO2 og H2O ved hjælp af molarmasserne og de støkiometriske forhold
Dermed
Forbindelsen kan også have indeholdt ilt. For at se, om den har det, beregnes masserne af C og H og trækkes fra prøvens samlede masse
Dermed har vi
og
Mængdeforholdet mellem grundstofferne i ascorbinsyre er derfor
Da nC:nH:nO er 3 mol C:4 mol H:3 mol O, er den empiriske formel C3H4O3.
Der er vist en tegning af et molekyle af ascorbinsyre. Du kan bestemme ved at tælle atomerne, at molekylformlen er C6H8O6 – nøjagtig det dobbelte af den empiriske formel. Det er også indlysende, at der er mere at vide om et molekyle end blot hvor mange atomer af hver slags der er til stede. I ascorbinsyre, som i andre molekyler, er den måde, hvorpå atomerne er forbundet med hinanden, og deres placering i det tredimensionelle rum ret vigtig. Et billede, der viser, hvilke atomer der er forbundet med hvilke, kaldes en strukturformel. Empiriske formler kan fås fra eksperimenter med procentvis sammensætning eller forbrændingsspor, og hvis molekylvægten er kendt, kan molekylformler bestemmes ud fra de samme data. Der kræves mere komplicerede eksperimenter for at finde strukturformler. I eksempel 2 fik vi O’s masse ved at trække C’s og H’s masse fra prøvens samlede masse. Dette forudsatte, at der kun var C, H og O til stede. Undertiden kan en sådan antagelse være ukorrekt. Da penicillin først blev isoleret og analyseret, blev det ikke opdaget, at det indeholdt svovl. Denne fejl blev først opdaget efter nogen tid, fordi svovl har en atomvægt, der er næsten nøjagtig dobbelt så stor som oxygen. To oxygenatomer blev substitueret i stedet for et svovlatom i formlen.
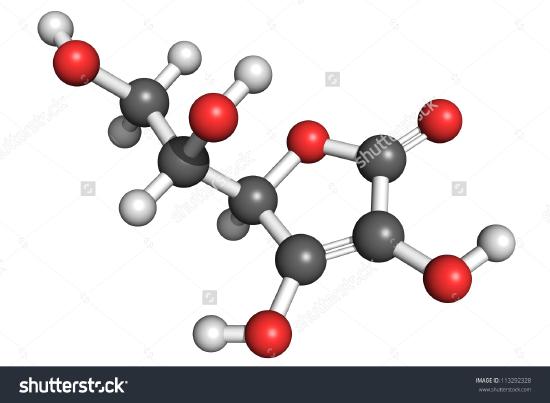
Figur \(\PageIndex{2}\) En 3D-repræsentation af L-Ascorbinsyre 1
Fra ChemPRIME: 3.4: Analyse af forbindelser