Det mest generelle princip om syrestyrke kan siges således: stærke syrer har relativt stabile konjugerede baser. Generelt gælder, at jo mere stabil den konjugerede base er, jo stærkere er syren. En vigtig ting at huske er, at stabilitet og reaktivitet er omvendt. Jo mere stabilt et stof er, jo mindre reaktivt er det, og omvendt. En anden måde at formulere ovenstående regel på er derfor at sige, at stærke syrer har svage konjugerede baser. HCl og H3O+ er stærke syrer. Følgelig er de tilsvarende konjugerede baser, Cl- og H2O, svage (meget stabile). Kloridionen er stabil, fordi den negative ladning befinder sig på et meget elektronegativt atom. Vandmolekylet er et af de mest stabile stoffer, man kender.
Hvordan ved man, hvilken proton der er den mest syreholdige i et molekyle (f.eks. eddikesyre), som indeholder mere end én type proton? Husk, at jo højere grad af positiv karakter på protonen, jo mere sur er den. Undersøgelse af en pKa-tabel afslører nogle tendenser for sure protoner. Følgende retningslinjer kan bruges til at forudsige surhedsgraden.
1. Hydrogener, der er direkte knyttet til meget elektronegative atomer som f.eks. oxygen, svovl og halogenerne, bærer en betydelig grad af surhed.
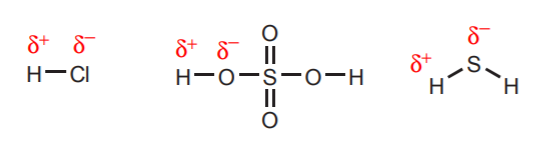
2. Hydrogener, der er knyttet til et positivt ladet nitrogen, oxygen eller svovl, er sure. Disse atomers høje elektronegativitet gør dem ubehagelige med den positive ladning. De søger at sprede ladningen blandt naboatomerne ved at trække elektrontætheden tilbage fra dem. Dette kan vises ved at tegne resonansstrukturer som vist.
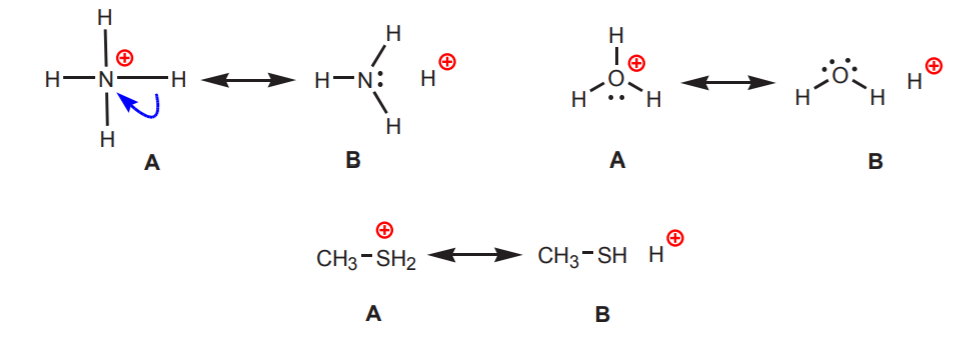
I alle tilfælde afslører struktur B hydrogenets positive karakter og dermed dets sure natur.
3. Som det fremgår af pKa-værdierne for alkaner og alkener, er hydrogener knyttet til kulstof af meget lav surhedsgrad. Sådanne stoffer betragtes normalt slet ikke som syrer. Nogle kulbrinter kan imidlertid være svagt sure, hvis deres konjugerede baser er stabile ioner. Dette kan ske i følgende tilfælde:
a) Der er et eller flere elektronegative atomer i nærheden af den pågældende proton. Den induktive virkning af disse elektronegative atomer efterlader hydrogenerne i nærheden uden elektrontæthed og derfor med delvis positiv karakter.
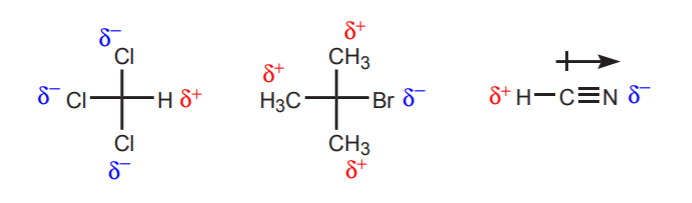
b) Et hydrogenatom bundet til et kulstof, som igen er bundet til et andet kulstof, der bærer en delvis eller helt positiv ladning, er syrisk.
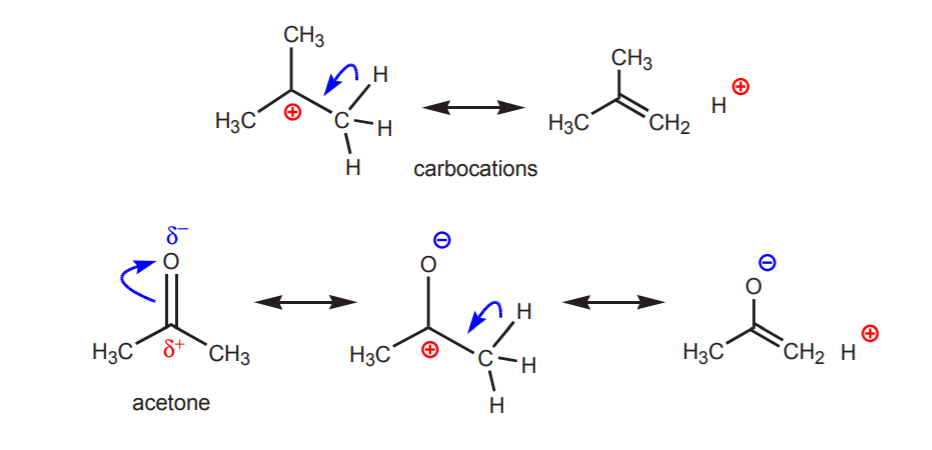
De viste protoners surhed bliver tydelig i eliminationsreaktioner (kapitel 6) og i kemien af enoler (kapitel 22), når tilstedeværelsen af en base fører til dannelse af alkener eller enolat-ioner gennem et trin, der involverer en protonoverførsel.
c) Den konjugerede base er resonansstabiliseret. Denne effekt er vigtigst, når der er en anden faktor, der øger surhedsgraden, såsom tilstedeværelsen af en dipol eller et elektronegativt atom (som i den funktionelle nitrilgruppe, -CN). Ellers er resonansstabilisering alene ikke nok til dramatisk at øge surhedsgraden af et hydrogen, der er knyttet til kulstof (som i toluen, hvor pKa kun er 40).
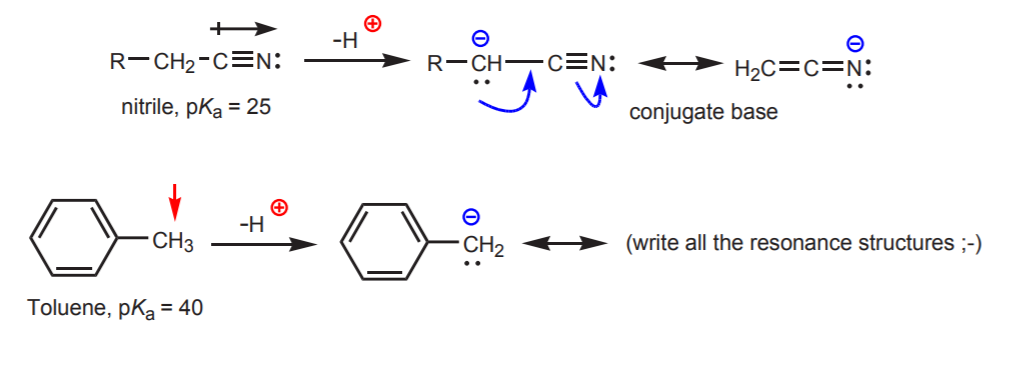
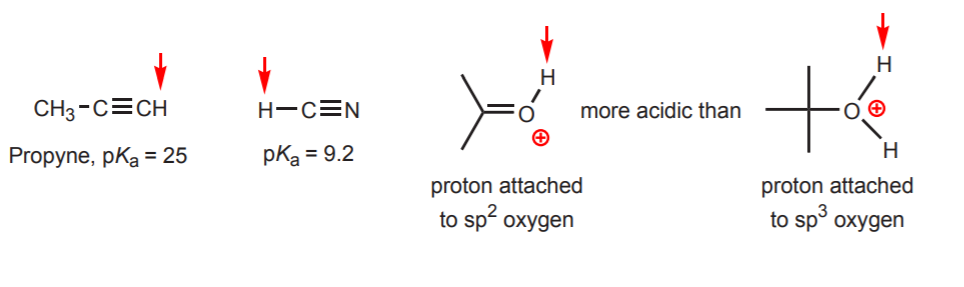
d) Hydrogenet er knyttet til et sp-hybridiseret kulstof. Hybridiseringseffekter på surhedsgraden behandles i kapitel 9. Tendenserne i hybridisering kan udvides til at omfatte ilt og kvælstof ud over kulstof, som i eksemplet til højre.