Cyklopentan Chemické vlastnosti,použití,výroba
Fyzikální a chemické vlastnosti
Cyklopentan, známý také jako „pentametylen“, je druh cykloalkanu se vzorcem C5H10. Jeho molekulová hmotnost je 70,13. Existuje jako druh hořlavé kapaliny. Má bod tání 94,4 °C, bod varu 49,3 °C, relativní hustotu 0,7460 a index lomu 1,4068. Je rozpustný v alkoholu, éteru a uhlovodících a není rozpustný ve vodě. Cyklopentan není planární kruh a má dvě konformace: obálkovou konformaci a polochair konformaci. Úhel vazby uhlík-uhlík je blízký 109° 28´, přičemž molekulové napětí není velké a kruh je relativně stabilní. Má podobné chemické vlastnosti jako alkany. Smrtelná koncentrace ve vzduchu pro krysy byla 3,8 × 10-2. Při reakci s dýmající kyselinou sírovou vykazuje červenožlutou barvu, přičemž reakcí s kyselinou dusičnou vzniká nitrocyklopentan a kyselina glutarová. Metoda: lze ji získat z destilátu petroletheru vysokotlakým krakováním cyklohexanu za přítomnosti hliníku nebo katalytickou hydrogenací cyklopentenu a cyklopentadienu. Účel: používá se hlavně jako rozpouštědlo.
Obrázek 1 struktura cyklopentanu.
Cykloalkan
Cykloalkany jsou nasycené uhlovodíky, ve kterých jsou atomy uhlíku v molekule uspořádány do kruhu a je v nich sdružen dostatečný počet atomů vodíku. Cykloalkany zastoupené v ropě jsou především cyklopentan a cyklohexan.
Cykloalkany mají vyšší bod tání, bod varu a relativní hustotu než odpovídající alkany s přímým řetězcem. Naftenickou aromatickou ropu můžeme použít k výrobě vysokooktanového řadového benzínu, jehož protiexplozivnost je lepší než u běžného parafínu. Naftenická ropa s nízkým obsahem síry se nejen snadno zpracovává, ale je také vynikající surovinou pro výrobu moderních maziv. Ropa obsahující relativně mnoho polycyklických naftenických sloučenin s dlouhým postranním řetězcem je ideálním materiálem pro vysoce kvalitní maziva.
Při pokojové teplotě a atmosférickém tlaku jsou cykloalkany obsahující čtyři nebo méně atomů uhlíku v plynné formě, přičemž ty, které obsahují více než čtyři uhlíky, existují v kapalné formě. Cyklopropan a cyklobutan se jeví jako plyn, cyklopentan až cykloundekan se jeví jako kapalina; cyklodekan a vyšší se jeví jako pevná látka.
Chemická povaha cykloalkanu souvisí s počtem atomů uhlíku tvořících kruh. Označuje se tříčlenný kruh a čtyřčlenný kruh, jako malý kruh; pěti až sedmičlenný kruh jako normální kruh; osmi až jedenáctičlenný kruh jako normální kruh; dvanáctičlenný kruh a vyšší jako velký kruh. Linie jader uhlíkových jader v malých kruzích nejsou v souladu s osou vazebného orbitalu. U cyklopropanu je kruh tvořený liniemi jader atomů uhlíku rovnostranný trojúhelník, přičemž každý úhel je 60°, zatímco úhel osy hybridního orbitalu sp3 jednoduché vazby uhlík-uhlík tvořené každým uhlíkem je 104° (viz obrázek 2 níže). Proto se nepodařilo dosáhnout co největšího stupně překrytí orbity, což způsobuje velké úhlové napětí. Cyklobutan má také úhlové napětí, ale je menší. To vede k nízké stabilitě malého kruhu, což způsobuje jeho podobnou chemickou vlastnost jako u olefinů, u nichž může docházet k adiční reakci s otevřením kruhu s mnoha činidly. Ostatní kruhy mají menší nebo žádné úhlové napětí. Cykloalkany a alkany mají podobné chemické vlastnosti, jsou méně náchylné k reakci otevírání kruhu, například k reakci s vodíkem. Cyklohexan a vyšší cykloalkany obtížněji podléhají hydrogenaci.
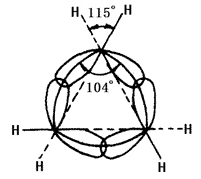
Obrázek 2 je schematické znázornění překryvu sp3 hybridizačních orbitalů v cyklopropanu.
Cyklopropan (při pokojové teplotě) a cyklobutan (za podmínek zahřívání) mohou mít adiční reakci s halogenem a halogenovodíkem.
Otevřený kruh vzniká mezi dvěma atomy spojujícími největší a nejmenší počet vodíků. Adice splňuje Markovovo pravidlo. Zatímco u normálního kruhu může při stimulaci světlem nebo teplem docházet k substituční reakci s halogenem.
Cykloalkan nelze za pokojové teploty oxidovat manganistanem draselným.
Cyklopentan, cyklohexan a jeho alkyl substituované produkty jsou přítomny v některých ropných olejích. Cykloalkany lze také syntetizovat vhodnými metodami, například cyklizací dihaloalkanů a hydrogenací aromatických uhlovodíků.
Tuto informaci upravil Xiaonan z Chemicalbook (2015-08-17).
Nebezpečné situace
Požití a vdechnutí je středně toxické. (2) Jako hořlavý s větším rizikem hoření. Přípustná koncentrace ve vzduchu je ve Spojených státech 600 ppm (1720 mg/m3).
Škodlivé účinky a příznaky otravy
Vdechování vysokých koncentrací cyklopentanu může způsobit útlum centrální nervové soustavy, i když jeho akutní toxicita je nízká. Mezi příznaky akutní expozice patří nejprve vzrušení, následované vznikem poruch rovnováhy, a dokonce stupor, kóma. Ojediněle se vyskytují případy úmrtí v důsledku respiračního selhání. Bylo zjištěno, že zvířata krmená tímto zbožím mohou dostat těžký průjem, který vede ke kolapsu srdce, plic a jaterních cév a degeneraci mozku.
Ochranná opatření
Lze jej použít ke zlepšení výrobního zařízení. K ochraně pokožky používejte ochranné krémy nebo rukavice.
Lékařská péče
Při pravidelném lékařském vyšetření věnujte pozornost možnému dráždivému účinku na kůži a dýchací cesty a případným komplikacím ledvin a jater.
Požadavky na přepravu
Hořlavá kapalina I. třídy. Předpis o nebezpečnosti: 61013. Nádoba musí být při přepravě označena značkou „hořlavá kapalina“.
Hasicí látka
Viz „cyklohexan“.
Doporučené způsoby odstraňování odpadu
Spalování;
Chemické vlastnosti
Jeví se jako bezbarvá kapalina s bodem tání-93,9 °C, bodem varu 49,26 °C, relativní hustotou 0,7460 (20/4 °C), indexem lomu 1,4068 a bodem vzplanutí-37 °C. Je mísitelný s alkoholem, éterem a jinými organickými rozpouštědly, ve vodě se snadno nerozpouští.
Použití
(1) Lze jej použít jako rozpouštědlo pro roztokovou polymeraci polyisoprenového kaučuku a etheru celulózy. Lze jej použít jako náhradu freonu jako izolační materiál v chladničkách a mrazničkách a také jako pěnidlo pro jiné tvrdé PU pěny a jako standard chromatografické analýzy.
(2) Používá se jako standardní látka pro chromatografickou analýzu, rozpouštědla, motorová paliva, azeotropní destilační činidla.
Způsob výroby
Cyklopentan je složkou ropného éteru v rozmezí teplot varu 30-60 °C s obsahem obvykle 5-10 %. Použijte atmosférickou destilaci; při refluxním poměru 60 : 1 a provádějte na věži o výšce 8 m; nejprve vydestilujte isopentan a n-pentan; pokračujte ve frakcionaci, abyste získali cyklopentan o čistotě vyšší než 98 %. Cyklopentan lze také získat redukcí cyklopentanonu nebo katalytickou hydrogenací cyklopentadienu.
Nebezpečí &Bezpečnostní informace
Kategorie Hořlavé kapaliny
Třída toxicity: Nízká toxicita
Akutní toxicita: LD50 orálně-potkan: 11400 mg/kg; LD50 orálně-myš: 12800 mg/kg
Nebezpečné vlastnosti výbušnin: jsou výbušné po smísení se vzduchem
Hořlavost a nebezpečné situace: jsou hořlavé v případě požáru, vysoké teploty a oxidanty s hořením uvolňující dráždivý kouř
Skladovací vlastnosti: Skladování: větrané, při nízké teplotě a v suchu; s oxidačním činidlem se skladuje odděleně
Hasicí prostředek: Hasivo: suchý prášek, oxid uhličitý, pěna, hasivo 1211
Pracovní norma: TWA 1720 mg/m3; STEL 2150 mg/kg
Chemické vlastnosti
bezbarvá kapalina se zápachem podobným benzínu
Chemické vlastnosti
Cyklopentan je bezbarvá kapalina.
Fyzikální vlastnosti
Bezbarvá, pohyblivá, hořlavá kapalina se zápachem připomínajícím cyklohexan.
Použití
Cyklopentan je ropný produkt. Vzniká vysokoteplotním katalytickým krakováním cyklohexanu nebo redukcícyklopentadienu. Vyskytuje se ve frakcích ropného éteru a v mnoha komerčních rozpouštědlech. používá se jako rozpouštědlo pro barvy, při extrakci vosku a tuku a v obuvnickém průmyslu.
Použití
Jako laboratorní činidlo; při výrobě léčiv; vyskytuje se v rozpouštědlecha v ropném éteru; hnací tlakové činidlo.
Způsoby výroby
Cyklopentan se vyskytuje ve frakcích ropného éteru a připravuje se krakováním cyklohexanu za přítomnosti oxidu hlinitého při vysoké teplotě a tlaku nebo redukcí cyklopentadienu.
Definice
ChEBI: Cykloalkan, který se skládá z pěti uhlíků, z nichž každý je vázán dvěma vodíky nad a pod rovinou. Rodič třídy cyklopentanů.
Obecný popis
Čirá bezbarvá kapalina se zápachem podobným petroleji. Bod vzplanutí -35 °C. Méně hustá než voda a nerozpustná ve vodě. Páry jsou těžší než vzduch.
Vzduch &Reakce s vodou
Vysoce hořlavý. Nerozpustný ve vodě.
Profil reaktivity
CYKLOPENTAN je neslučitelný se silnými oxidačními činidly, jako je chlor, brom, fluor .
Zdravotní nebezpečnost
Vdechování způsobuje závratě, nevolnost a zvracení; koncentrované páry mohou způsobit bezvědomí a kolaps. Páry způsobují mírné mžitky před očima. Styk s kapalinou způsobuje podráždění očí a může podráždit kůži, pokud zůstane na místě. Požití způsobuje podráždění žaludku. Aspirace způsobuje silné podráždění plic a rychle se rozvíjející plicní edém; vzrušení centrálního nervového systému s následnou depresí.
Nebezpečnost pro zdraví
Cyklopentan je látka s nízkou akutní toxicitou. Jeho expozice ve vysokých koncentracích může vyvolat depresi centrálního nervového systému s příznaky excitace, ztráty rovnováhy, stuporu a kómatu. U potkanů může dojít k respiračnímu selhání po 30-60 minutách expozice 100 000-120 000 ppm ve vzduchu. Je dráždivý pro horní cesty dýchací, kůži a oči. O chronických účincích dlouhodobé expozice cyklopentanu nejsou v literatuře k dispozici žádné informace.
Nebezpečnost při požáru
Chování při požáru: Nádoby mohou explodovat.
Chemická reaktivita
Reaktivita s vodou Bez reakce; Reaktivita s běžnými materiály: Žádná reakce; Stabilita během přepravy: Stabilní; Neutralizační činidla pro kyseliny a žíraviny: Není relevantní; Polymerace: Není relevantní; Inhibitor polymerace: Není relevantní.
Bezpečnostní profil
Mírně toxický při požití a vdechnutí. Vysoké koncentrace působí narkoticky. Velmi nebezpečné nebezpečí požáru při vystavení teplu nebo plameni; může reagovat s oxidanty. K hašení požáru použijte pěnu, CO2, suché chemické látky. Při zahřátí na rozklad uvolňuje štiplavý kouř a výpary.
Potenciální expozice
Cyklopentan se používá jako rozpouštědlo.
Zdroj
Složka vysokooktanového benzínu (citováno, Verschueren, 1983). Harley et al. (2000)analyzovali výpary v prostoru nad hlavou tří druhů bezolovnatého benzinu, do kterého byl přidán ethanol jako náhrada methylterc-butyléteru. Cyklopentan byl zjištěn ve stejné koncentraci 1,4 % hmot. v parách v hlavovém prostoru u běžných, středních a prémiových tříd.
Schauer et al. (1999) zaznamenali cyklopentan ve výfukových plynech středně těžkého nákladního automobilu s dieselovým motorem v emisní míře 410 μg/km.
Kalifornský reformulovaný benzín fáze II obsahoval cyklopentan v koncentraci 4,11 g/kg. Míra emisí z výfuku v plynné fázi u automobilů poháněných benzinem s katalyzátory a bez katalyzátorů byla 0,78 a 85,4 mg/km (Schauer a kol., 2002).
Ovliv na životní prostředí
Biologické. Cyklopentan může být oxidován mikroby na cyklopentanol, který může oxidovat na cyklopentanon (Dugan, 1972).
Fotolytický. Pro reakci oktanu a OHradikálů v atmosféře byly zaznamenány následující rychlostní konstanty: (Hendry a Kenley, 1979); 5,40 x 10-12 cm3/molekula?s (Atkinson, 1979); 4,83 x 10-12 cm3/molekula?s při teplotě 298 K (DeMore aBayes, 1999); 6,20 x 10-12, 5,24 x 10-12 a 4.43 x 10-12 cm3/mol-sec při 298, 299 a 300 K (Atkinson, 1985), 5,16 x 10-12 cm3/mol-sec při 298 K (Atkinson, 1990) a 5,02 x 10-12 cm3/mol-sec při 295 K (Droege a Tilly, 1987).
Chemical/Physical. Cyklopentan nehydrolyzuje, protože nemá hydrolyzovatelnou funkční skupinu. Při úplném spalování na vzduchu vzniká oxid uhličitý a voda.
Při zvýšených teplotách dochází k roztržení kruhu za vzniku ethylenu a pravděpodobně i alenu a vodíku (Rice a Murphy, 1942).
Přeprava
UN1146 Cyklopentan, třída nebezpečnosti: 3; označení: 3 – hořlavá kapalina.
Metody čištění
Zbavte jej cyklopentenu dvěma průchody kolonou pečlivě vysušeného a odplyněného aktivovaného silikagelu. Vyskytuje se v ropě a je VYSOCE HOŘLAVÝ.
Kompatibility
Může tvořit výbušnou směs se vzduchem. může akumulovat statické elektrické náboje a může způsobit vznícení svých par. Styk se silnými oxidanty můžezpůsobit požár a výbuch.
Odstranění odpadu
Materiál rozpusťte nebo smíchejte s hořlavým rozpouštědlem a spalte v chemickém spalovacím zařízení vybaveném přídavným spalováním a skruberem. Je třeba dodržovat všechny federální, státní a místní předpisy týkající se životního prostředí.