Tyto poznámky jsou ze 4. přednášky kurzu buněčné biologie Harvard Extension.
Sekreční dráha se týká endoplazmatického retikula, Golgiho aparátu a vezikul, které se pohybují mezi nimi, a také buněčné membrány a lysozomů. Je nazývána „sekreční“ proto, že je cestou, kterou buňka vylučuje bílkoviny do extracelulárního prostředí. Jako obvykle však etymologie vypovídá jen o zlomku příběhu. Tato dráha zpracovává také proteiny, které budou vázány na membránu (ať už v buněčné membráně nebo v samotných membránách ER či Golgiho), stejně jako lysozomální enzymy a také všechny proteiny, které budou žít svůj život v samotné sekreční dráze. Dělá také některé jiné věci než zpracovává proteiny.
Cytosol a „lumen“ (tekutina, která vyplňuje sekreční dráhu) jsou různá chemická prostředí a obvykle se nikdy nemíchají. Cytosol je reduktivní (když jste v cytosolu, neustále potkáváte molekuly, které vám chtějí nabídnout elektrony) a ER, Golgiho a extracelulární prostředí jsou oxidační (molekuly k vám neustále přicházejí a žádají o elektrony). Pokud jste stále zmatení, podívejte se na redox. To vytváří různé podmínky pro skládání proteinů: například disulfidové vazby se obvykle tvoří pouze v oxidačních podmínkách. Kromě toho mohou různé proteiny žít pouze v sekreční dráze nebo pouze v cytosolu. Sekreční dráha poskytuje buňce cestu, jak nakládat s věcmi, které by nemuselo být dobré mít v cytoplazmě a/nebo jsou nejužitečnější, když jsou uchovávány ve specializovaném prostoru se svými požadovanými interakčními partnery. Hepatocyty (v játrech) uchovávají léky a toxiny v hladkém ER a tam je rozkládají k vyloučení z těla. Sekreční dráha není spojitá, ale každý pohyb mezi jejími složkami probíhá v malých bublinkových mikrokosmech vlastního chemického světa, kterým se říká vezikuly.
Mnoho proteinů, které procházejí sekreční dráhou, se nikdy nedotkne cytosolu – kromě částí membránových proteinů, které vyčnívají na cytosolové straně. Mnohé z nich potřebují chaperony, které jim pomohou se skládáním, a/nebo celou řadu posttranslačních modifikací, aby byly připraveny pro svou nativní funkci, a sekreční dráha se specializuje na to, že jim toto vše poskytuje.
Dnešní přednáška se zaměří na to, jak se proteiny překládají do ER a jak cestují (ve vezikulách) mezi ER, Golgiho a dalšími místy určení. To je krásně znázorněno na videu Život buňky:
Endoplazmatické retikulum je prvním stupněm sekreční dráhy. Jeho membrána je spojitá s vnější jadernou membránou, i když není jasné, proč je to důležité, protože proteiny nezačínají svůj život v jádře. Spíše se mRNA pohybují v cytoplazmě, dokud je nevyzvedne ribozom, který má zájem je přeložit. Při „posttranslační translokaci“ se nový protein po překladu přesune do ER. Při zajímavějším jevu zvaném „kotranslační translokace“ začíná ribozom translaci stejně jako u jakéhokoli jiného proteinu, ale někde v prvních 16 až 30 aminokyselinách narazí na signální peptid (neboli signální sekvenci). Motivem tohoto signálu je často 1 kladně nabitá aminokyselina následovaná 6-12 hydrofobními aminokyselinami. Tento motiv rozpozná signální rozpoznávací částice (SRP, „ribonukleoprotein“ neboli hybridní molekula RNA/proteinu), která se na něj naváže a zabrání ribozomu v pokračování translace. Translace se zastaví, dokud komplex ribosom/SRP nenarazí na receptor SRP na membráně ER. Když se setkají, SRP a jeho receptor naváží každý jednu molekulu GTP v membráně ER, což zřejmě posílí jejich interakci. Naštěstí se to vše odehrává v sousedství translokonu Sec61 – bílkovinného komplexu, který tvoří kanál procházející membránou ER. Translocon je vlastně komplex tří různých proteinů (geny: SEC61A1 nebo SEC61A2, SEC61B, SEC61G), z nichž podjednotka Sec61a má 10 membránou se šířících a-šroubovic, které tvoří kanál. Jakmile je ribozom připojen k membráně, pokračuje v translaci a protlačuje signální peptid a nakonec celý protein kanálem do lumen ER. Když se translace zastaví, SRP i SRP receptor hydrolují své GTP, aby se navzájem uvolnily a uvolnily náklad ribozomu (to musí vyžadovat energii GTP, protože původní vazba byla směrem dolů), signální peptidáza odštěpí signální peptid od vznikajícího proteinu a protein se může začít skládat v ER.
U některých proteinů ER je zapojeno několik dalších hráčů. Oligosacharid transferáza, která přidává glykosylové skupiny k asparaginům v nascentním proteinu, je součástí komplexu translokonu a glykosylaci vlastně provádí ještě během překladu nového proteinu. Ačkoli tedy glykosylaci nazýváme „posttranslační modifikací“, ve skutečnosti se v tomto případě provádí během translace. Také některé proteiny, aby dosáhly správné struktury, musí být plně přeloženy, než se mohou začít skládat – kdyby se N-koncová část mohla začít skládat hned po vstupu do lumen, skončila by s nesprávnou celkovou strukturou. Aby se tomu zabránilo, váže někdy chaperon BiP bílkovinu, aby ji po určitou dobu udržel nesloženou. Představte si BiP jako dalšího Pac-Mana, který se zakousne do proteinu, aby ho udržel lineární, podobně jako Hsc70 v procesu mitochondriálního cílení (viz minulý týden).
Tady je video:
Prvních pár minut ukazuje základní scénář popsaný výše. Pak přechází ke složitějšímu scénáři, který představím za chvíli. Pro tvou informaci, video zobrazuje dvě „kontroverzní“ věci, které nejsou zahrnuty ve výše uvedeném popisu: (1) rozklad signálního peptidu v membráně a (2) „zátkový protein“, který ucpává kanál před/po translaci. Na těchto dvou věcech se zatím všichni vědci neshodnou.
Všechny proteiny, o kterých víme, že procházejí sekreční cestou, tam byly určeny lidmi, kteří prováděli lokalizační experimenty, aby zjistili, kde v buňce se protein nachází. Zvláštní skutečností o ER je, že můžete dát buňku do mixéru a poté se ER prostě začne znovu spojovat sama se sebou a vytvářet malé „mikrosomy“, které nejsou připojeny k jádru, ale tvoří přilehlé bubliny ER. Pak si můžete začít hrát s proteázami – které rozkládají proteiny – a detergenty – které rozpouštějí membránu ER. Za předpokladu, že je váš protein, který vás zajímá, translatován, můžete zkontrolovat, zda (1) přežije ošetření proteázami, ale (2) nepřežije ošetření proteázami + detergenty, pak se jedná o protein sekreční dráhy. Logika je taková, že v případě (1) byl chráněn uvnitř ER, ale v případě (2) jste ER rozpustili, takže ho proteáza sežrala. To vše za předpokladu, že máte protilátku nebo nějaký jiný způsob, jak zjistit, zda se tam protein, který vás zajímá, po těchto úpravách nachází.
Lidé také používali tyto techniky, aby zjistili, že pouze 70 aminokyselin nového proteinu může být přeloženo, než bude příliš pozdě na to, aby tento protein skončil v ER. Nezapomeňte, že signální peptid se nachází v prvních 16-30 aminokyselinách a translokace do ER závisí na přítomnosti SRP. Ribosomy překládají předvídatelnou rychlostí, takže lidé nechali ribosomy začít překládat nějakou mRNA a pak čekali stanovenou dobu, než přidali SRP, aby zjistili, kolik translace může proběhnout, než SRP přestane plnit svou úlohu.
Registr SRP a proteiny Sec61 jsou membránové proteiny ER – a existuje také mnoho dalších membránových proteinů ER, Golgiho membrány a lysosomu. Ve skutečnosti se i membránové proteiny (viz třída 02) buněčné membrány zpracovávají v sekreční dráze. Mnohé z nich mají několik nebo desítky transmembránových domén (každá 20-25 hydrofobních aminokyselin), které musí být vloženy ve správném pořadí a orientaci (například opravdu chcete, aby vaše iontové kanály a transportéry směřovaly správným směrem, do vs. z buňky). V souladu s tím existuje řada vymyšlených biologických mechanismů, jak tyto proteiny správně vložit do membrány. To zobrazuje druhá polovina výše uvedeného videa.
Takže tady je tautologie: některé proteiny mají topogenní sekvenci, která určuje jejich orientaci v membráně. Tato sekvence se skládá ze dvou typů signálních sekvencí:
- stop-transfer sekvence (z nějakého důvodu zkráceně STA) je sekvence 22-25 hydrofobních aminokyselin někde uprostřed proteinu, která tvoří alfa šroubovici. Když se s ní setkáme, je zatlačena do membrány a translace zbytku proteinu pak pokračuje v cytosolu. Takže se tím jaksi „zruší“ translokace do ER, která byla zahájena signálním peptidem na začátku (N-konci) proteinu.
- Signální kotevní sekvence (zkráceně SA) je také 22-25aa hydrofobní alfa šroubovice, ale s řadou ~3 kladně nabitých aminokyselin vlevo nebo vpravo od ní. Stejně jako signální peptid je rozpoznávána SRP, který přivádí ribozom do ER. Na rozdíl od signálního peptidu se však tato sekvence alfa šroubovice vloží do membrány ER. Orientaci vložení určují 3 kladně nabité aminokyseliny. Kladné náboje musí vždy končit na cytosolové straně, takže pokud přicházejí za hydrofobní sekvencí (tj. na jejím C-konci), protein skončí s C-koncem směřujícím do cytosolu, ale pokud přicházejí před hydrofobní sekvencí (tj. na jejím N-konci), protein skončí s N-koncem směřujícím do cytosolu.
S těmito dvěma signály jako stavebními kameny si můžete představit protein s řadou stop přenosových a signálních kotevních sekvencí, které vytvoří celou řadu transmembránových domén tam a zpět sešitých do membrány jako na šicím stroji. Lidé rozdělili membránové proteiny do pěti kategorií:
- Typ I má pouze signální peptid a pak jeden stop přenos uprostřed. Proto končí svým (hydrofilním) N koncem v lumen, svým (hydrofobním) středem v membráně a svým (hydrofilním) C koncem v cytosolu.
- Typ II nezačíná signálním peptidem. Začíná jako každý jiný protein, ale uprostřed má signální kotevní sekvenci, přičemž nejprve přicházejí +++ aminokyseliny a po nich hydrofobní řada. Díky tomu se protein v polovině translace přemístí, přičemž již přeložená N-koncová část vyčnívá do cytosolu (protože +++ musí zůstat v cytosolu) a nyní začínající C-koncová část se překládá přímo do ER. Končí tedy transmembránově s C-koncem v ER a N-koncem v cytosolu – opak typu I.
- Typ III je jako typ II – bez signálního peptidu, jen se signální kotvou uprostřed, ale v tomto případě +++ přicházejí za hydrofobní sekvencí, což obrací orientaci. Končí tedy svým N-koncem v ER a C-koncem v cytosolu. Opak typu II a nakonec stejný jako typ I, i když se tam dostal jiným způsobem – nemá signální peptid, který se odštěpí v ER.
- Bílkoviny typu IV neboli „víceprůchodové“ mají střídavou řadu signálních sekvencí a stop přenosových sekvencí. Těchto proteinů je zjevně více než jeden „typ“, přesto nejsou zdaleka tak rozmanité, jak by si vaše kombinatorická představivost mohla dovolit. Orientace první signální sekvence určuje, zda N terminus skončí v cytosolu nebo ER, a celkový počet stop přenosových + signálních kotevních sekvencí určuje, kde skončí C terminus: sudý počet = stejná strana jako N terminus, lichý počet = opačná strana než N terminus. Sekvence STA a SA se musí striktně střídat, s výjimkou toho, že můžete začít dvěma sekvencemi signální kotvy, pokud je první z nich orientována N terminem do cytosolu. Jen pro zesměšnění tohoto kategorizačního schématu lidé definovali několik neúplně definovaných podtypů typu IV, kde typ IVa je s N-koncem v cytosolu (začíná tedy jako protein typu II) a typ IVb je s N-koncem v lumen (začíná jako protein typu III, ale pak má další SA sekvenci, která ho vrací do ER). GLUT1 ze třídy 02 je typ IVa.
- GPI-ukotvené proteiny, které jsou pátým typem, ale nenazývají se typem V, začínají signálním peptidem a končí hydrofobním C-koncem, který zůstává zapuštěn v membráně. Tento hydrofobní konec se odštěpí a nahradí se GPI, který rovněž zůstává usazen v membráně. PrP je jedním z nich – více o tom později.
Již jsme probrali, jak mohou proteiny skončit v lumen ER nebo překlenout membránu ER. Většina proteinů opustí ER během několika minut, transportována ve vezikulách vázaných na Golgiho a později na vylučování, lysozomy nebo buněčnou membránu. Tento směr cesty vpřed se nazývá anterográdní; cesta zpět z Golgiho do ER je retrográdní transport.
Oba typy transportu probíhají ve vezikulech vázaných na membránu. Ty se oddělí od membrány místa, odkud přicházejí, a později se spojí s membránou místa, kam směřují – krásně znázorněno v čase ~2:25 ve výše uvedeném videu Life of the Cell. Těleso, z něhož vezikuly vznikají, je „dárcovský kompartment“ a místo určení, do něhož později splynou, je „akceptorový kompartment“.
Proces pučení vyžaduje, aby G proteiny v membráně rekrutovaly kabátové proteiny. Konkrétně pro anterográdní transport rekrutuje G protein Sar1 (gen: SAR1A) COPII („cop two“); pro retrográdní transport rekrutuje G protein ARF COPI (vyslovuje se „cop one“). Tyto G proteiny jsou k této práci aktivovány, když je GEF zatíží GTP a vymění GDP.
Takže například kroky při anterográdním transportu jsou následující:
- Sec12-GEF (Sec znamená sekreční) zatíží Sar1 GTP. Když je navázán na GDP, Sar1 se jen tak vznáší po donorovém kompartmentu, ale když je navázán na GTP, projde konformační změnou, která způsobí, že jeho jinak pohřbený N-koncový hydrofobní ocásek vyčnívá, takže se zapíchne do membrány, kde se pak začnou hromadit proteiny COPII, protože se jim tento ocásek velmi líbí.
- COPII začnou polymerizovat a díky své konformaci mají vnitřní preferenci zakřivení, takže jejich hromadění začne způsobovat poupě. Současně se do nově vznikajícího vezikulu rekrutují membránově vázané proteiny, které je třeba transportovat – identifikované podle sekvence aminokyselin DXE (tj. aspartát-cokoliv-glutamát), která tvoří vazebné místo v jejich cytosolické části. Proteiny vázané na membránu fungují jako receptory a rekrutují lumenální proteiny, které jsou vázány na Golgiho, aby se zdržovaly v konkávním prostoru, kde skončí ve vezikule, jakmile se vytvoří.
- Jakmile dorazí dostatečný počet COPII, vezikula se oddělí a v tu chvíli Sar1 hydrolyzuje své GTP, čímž získá energii pro vtažení svého hydrofobního ocasu zpět do sebe a odříznutí COPII. Vezikula je nyní odpojena od donorového kompartmentu.
- Ze špatně vysvětlených (nebo špatně pochopených?) důvodů se nyní plášť COPII prostě rozloží a odhalí receptory pod pláštěm, které řídí zacílení vezikuly. Jakmile vezikula dorazí na místo určení, Rab-GTP zabudovaný v membráně vezikuly interaguje s efektorem Rab zabudovaným v membráně akceptorového kompartmentu. Dochází k výměně postranních pohledů, zájem je zažehnut. Brzy se vezikula spojí s membránou.
- Proteiny SNARE přítomné na membráně vezikuly i cílové membráně (V-SNARE, resp. T-SNARE) interagují, aby se membrány ještě více přiblížily. V tomto příkladu budeme považovat VAMP (geny VAMP_) za V-SNARE a Syntaxin (geny STX__) a SNAP25 (gen SNAP25) za T-SNARE. Syntaxin a SNAP25 jsou oba membránové proteiny; Syntaxin má 1 alfa šroubovici a SNAP25 má 2, všechny na cytosolické straně. Šroubovice alfa řídí interakci s VAMP. Alfa šroubovice protilehlých stran mají k sobě extrémně silnou afinitu, což membrány přibližuje natolik, že se spojí. Jakmile k tomu dojde, je k oddělování V-SNARE a T-SNARE opět zapotřebí dvou proteinů: NSF (gen: NSF; zkratka pro NEM sensitive factor) a alfa-SNAP (gen: NAPA), rozpustný připojovací protein NSF. NSF je ATPáza a spaluje ATP, aby poháněl energeticky vzestupnou demontáž komplexu.
Nyní pro retrográdní transport. Proč vůbec existuje retrográdní transport? Zde je neúplný výčet některých důvodů:
- Některé membránové proteiny začínají svůj život v ER, potřebují se upravit v Golgi, ale pak se musí dostat zpět do ER. K tomu jim slouží aminokyselinová sekvence KKXX.
- Na C-konci některých lumenálních proteinů je také aminokyselinová sekvence KDEL, která je má udržet v ER, ale není to dokonalé – někdy skončí v Golgi, a v takovém případě jsou retrográdním transportem zaměřeny zpět do ER v závislosti na rozpoznání této sekvence KDEL. Mechanismus je docela elegantní – proteiny, které rozpoznávají a vážou se na KDEL, tak činí pouze při nízkém pH a pH Golgi je nižší než ER, takže vážou KDEL v Golgi a pak ho uvolňují, když jsou zpět v neutrálnějším pH ER.
- Přemýšlejte také o tom, že všechny proteiny, které se účastní anterográdního transportu – V-SNARES, Rab atd. – se musí dostat zpět do ER, aby to mohly dělat znovu, podobně jako se autobus musí na konci dne dostat zpět do autobusového depa.
- Jak brzy uvidíme, do Golgiho přicházejí v několika fázích, které závisí na přidání enzymů z dalšího toku.
Proces retrográdního transportu se od anterográdního zas tak neliší. Používá ARF místo Sar1, COPI místo COPII, ale funguje stejně: ARF naložený GTP nechá svůj hydrofobní ocásek zapíchnout do membrány, čímž přitáhne pozornost COPI. COPI má dvě složky, COPIalfa a COPIbeta, které interagují s touto sekvencí KKXXX a rekrutují membránově vázané proteiny určené k retrográdnímu transportu. Některé proteiny mají také sekvenci RR (kdekoli v proteinu), která je může označit pro retrográdní transport.
Golgiho aparát není spojitý. Je to na sebe poskládaný soubor oddělených dílčích oddílů nazývaných váčky nebo cisterny. Jednotlivé oddíly mají různé vlastnosti a proteiny je navštěvují v určitém pořadí. V pořadí od ER k buněčné membráně se Golgiho oddíly nazývají cis, mediální, trans a trans-Golgiho síť. Každý kompartment má jiné enzymy, které modifikují proteiny, a modifikace musí probíhat v určitém pořadí, proto je potřeba skládat kompartmenty na sebe.
Ale když proteiny dozrávají v Golgiho síti, není to tak, že by z jednoho kompartmentu vyrazily ve vezikulách a přesunuly se do dalšího. Spíše se přihrádka, ve které se již nacházejí, přesouvá ven a „dozrává“, protože se do ní retrográdním transportem přidávají nové enzymy (z dalších částí Golgiho řetězce). Divné, že? Je to něco podobného, jako kdybyste místo přechodu ze základní školy na střední školu zůstali po celé dětství a dospívání v jedné školní budově a každý rok přinesli nové učebnice a učitele, aby to odpovídalo stupni, kterého jste vy a vaši spolužáci právě dosáhli. Takto vypadají Golgiho komory, když se pohybují a vyvíjejí:
Takže v Golgiho komorách probíhá (malý nebo) žádný anterográdní transport, ale spousta retrográdního transportu, který přivádí každé nové kolo enzymů. Když proteiny konečně absolvují celý program K-12 v Golgiho síti, podstoupí transport, aby se přesunuly na místo svého konečného určení. Vycházejí ve vezikulech, které se dostanou na jedno ze tří míst:
- Exocytóza – splynutí s buněčnou membránou. Lumenální proteiny tak budou vylučovány extracelulárně a z membránových proteinů se stanou proteiny buněčné membrány.
- Sekreční vezikuly – ty prostě zůstanou jako vezikuly v buňce, dokud je nebude potřeba – přičemž „potřeba“ znamená, že nakonec projdou exocytózou. V neuronech jsou zde uloženy neurotransmitery, dokud si akční potenciál nevyžádá jejich vylučování do synapse. V žaludku buňky, které produkují žaludeční enzymy, uchovávají tyto enzymy v sekrečních vezikulách, dokud příjem potravy nevyvolá jejich uvolnění do žaludku.
- Lysozomy – kam putují špatně složené proteiny, aby byly rozloženy.
Transport z trans-Golgiho sítě na tato místa určení se liší od ostatních transportů popsaných výše a často zahrnuje klathrin (geny CLT__). Vezikuly, které se odštěpují, mají dvouvrstvý plášť, přičemž vnitřní vrstvu tvoří komplexy adaptorových proteinů (AP) a vnější vrstvu klathrin. Adaptorové proteiny mají cílový signál s motivem YXXh (h = Φ = libovolná hydrofobní aminokyselina). Klathrin vytváří takzvaný útvar „klathrin-triskelion“, který je zobrazen zde:

(Obrázek díky uživateli Wikimedia Commons Phoebus87)
Klathrin je také zodpovědný za endocytózu – odštěpování vezikul extracelulárních látek (a proteinů buněčné membrány), které se dostávají do buňky. Tomu se říká klathrinem zprostředkovaná endocytóza. Receptory v buněčné membráně se endocytují velmi často: celá populace hormonálních receptorů se obměňuje přibližně každou hodinu, zejména při příjmu hormonů. Uchopení receptoru do vezikuly je pro buňku jedním ze způsobů, jak přerušit příchozí signál, dokud nebude zpracován.
V poznámkách k plazmatické membráně je stručně pojednáno o cystické fibróze: CFTR je ABC transportér zodpovědný za odčerpávání Cl- z buňky (propouští také Na+). Mutanti se ztrátou funkce nepřečerpávají Cl-, což odstraňuje hnací sílu pro osmózu, zahušťuje hlen a způsobuje problémy s dýcháním. Existuje nejméně 127 různých mutant se ztrátou funkce CFTR (alespoň tolik jich testuje společnost Natera), které (pokud jsou obě alely postižené) způsobují cystickou fibrózu. Nejčastější mutací je ΔF508, která tvoří ~3 % všech evropských alel CFTR a asi 70 % mutovaných. Ztráta tohoto jednoho fenylalaninu změní konformaci CFTR tak, že di-kyselinový výstupní kód (aminokyseliny D565 a D567), který zaměřuje CFTR na exocytotické vezikuly, již není správně exponován a protein se nikdy nedostane k buněčné membráně .
sekce diskuse
V sekci jsme četli Hu 2009, který ukázal, že proteiny atlastin se podílejí na vytváření tubulární sítě ER. Důkazy pocházely téměř výhradně z interakcí protein-protein. Překvapilo mě, že tento článek byl velkou událostí, protože existuje milion prací ukazujících interakce protein-protein pro huntingtin a nikdo jim všem nevěří a nutně nás to nepřiblížilo k poznání toho, co huntingtin dělá nebo co se děje špatně při Huntingtonově chorobě. Ale Hu zřejmě dokázal docela jasně prokázat, že interakce atlastinů s retikulony naznačují roli při tvorbě ER. Pomáhá, že Hu dokázal kromě fyzické (vazebné) interakce prokázat i „genetickou interakci“. „Genetická interakce“ (musel jsem si to vyhledat) znamená, když „Někdy mutace ve dvou genech vytvářejí fenotyp, který je překvapivý ve světle individuálních účinků každé mutace. Tento jev, který definuje genetickou interakci, může odhalit funkční vztahy mezi geny a cestami.“ .
PrP
Je to deset let staré, takže některé věci mohou být zastaralé, ale Harrisův přehled buněčné biologie PrP z roku 2003 (ft) mi přišel nesmírně přehledný a užitečný. Nápomocný byl také Kim & Hegde 2002. PrP je protein sekreční dráhy. Jeho prvních 22 aminokyselin (MANLGCWMLVLFVATWSDLGLC) je signální peptid, který způsobuje kotranslační translokaci do ER. Za normálních okolností se PrP pouze naváže na GPI na svém C-konci a je ukotven na exoplazmatické straně membrány. Ale aminokyseliny 111-134 (HMAGAAAAGAVVGGLGGYMLGSAM) jsou jakousi slabou signální kotevní sekvencí (typ II, s +++ aminokyselinami přicházejícími před signální kotvou), která se někdy, ale ne vždy, stává transmembránovou doménou a obrací C terminus do lumen. Ještě matoucí je, že tato sekvence může někdy skončit jako transmembránová doména bez inverze, takže N terminus je v lumen. Existují tedy tři membránové topologie PrP: běžná stará GPI-ukotvená a dvě transmembránové orientace, jak je znázorněno na Harris 2003 Obr. 3:
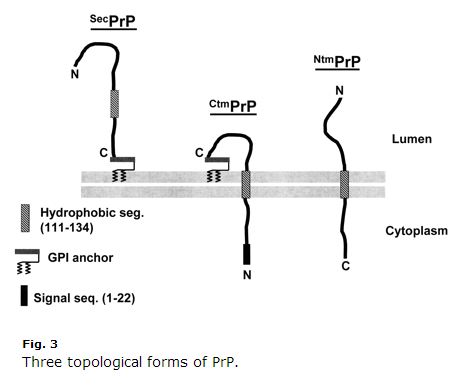
Všimněte si, jak podivný je CtmPrP. Je transmembránový, ale zároveň ukotvený v GPI, a N-koncový signální peptid není nikdy odštěpen. Normálně tvoří transmembránové formy <10 % celkového PrP. V některých laboratorních podmínkách je toto procento vyšší a dvě z mutací způsobujících GSS (A117V a P105L) také zvyšují podíl CtmPrP na 20-30 % veškerého PrP. Z těchto tří forem existuje značné množství důkazů, že CtmPrP je toxický a že by mohl hrát roli při tvorbě prionů, ačkoli se zdá, že většina genetických mutací prionových chorob (včetně FFI D178N) neovlivňuje membránovou topologii PrP ani podíl CtmPrP.
Po průchodu PrP Golgiho membránou je jeho cílem buněčná membrána. Podle Harrise tam však jen tak nesedí – často prochází klathrinem zprostředkovanou endocytózou a cyklicky prochází buňkou každých ~60 minut, přičemž některé molekuly jsou při každém cyklu odštěpeny. Měď tuto endocytózu PrP stimuluje. Většina genetických mutací prionových onemocnění mění lokalizaci PrP – obvykle se při mutaci nachází méně PrP na povrchu buňky a více se ho hromadí v ER
.