Jak jsme viděli, naše strava obsahuje mnoho sacharidů a možná vás zajímá, zda existuje způsob, jak analyzovat vzorek a zjistit, zda se jedná o sacharózu, nebo o jedno ze syntetických sladidel, jako je sorbitol nebo kukuřičný sirup s vysokým obsahem fruktózy, nebo dokonce o sloučeninu, jako je vitamin C, který je syntetizován z cukrů a stejně jako ony obsahuje pouze C, H a O. Takový způsob existuje a je to jedna z nejzásadnějších forem analýzy, která se nazývá elementární analýza. Je to jedna z prvních metod, kterou vědci používají k identifikaci nové sloučeniny.
Do této chvíle jsme všechny stechiometrické poměry získali z koeficientů vyvážených chemických rovnic. Chemické vzorce však také udávají relativní množství látky a stechiometrické poměry lze odvodit i z nich. Například vzorec CO2 nám říká, že bez ohledu na to, jak velký vzorek oxidu uhličitého máme, na každý mol atomů uhlíku budou vždy připadat 2 moly atomů kyslíku. To znamená, že ze vzorce CO2 máme stechiometrický poměr
\
Mohli bychom také určit, že pro CO2
\
\
(Reciproční hodnoty těchto stechiometrických poměrů platí i pro CO2.)
Stochiometrické poměry odvozené ze vzorců namísto rovnic se používají při nejběžnějším postupu určování empirických vzorců sloučenin, které obsahují pouze C, H a O. Odvážené množství analyzované látky se umístí do spalovací soustavy a zahřívá se v proudu suchého O2. Veškerý H ve sloučenině se přemění na H2O(g), který se selektivně zachytí v předem zvážené absorpční trubici. Veškerý C se přemění na CO2(g), který se selektivně zachytí v druhé trubici. Přírůstek hmotnosti každé trubice udává, kolik H2O a CO2 vzniklo spalováním vzorku
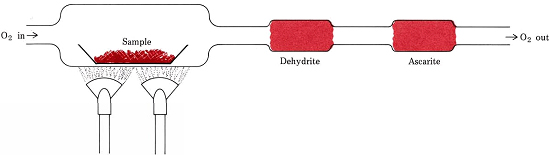
Obrázek \(\PageIndex{1}\) Spalovací soustava. H2O a CO2, které vznikly kombinací O2 s H a C ve vzorku, jsou selektivně absorbovány trubicemi obsahujícími dehydrit a askarit (NaOH na azbestu)
Příklad \(\PageIndex{1}\): Empirický vzorec kyseliny askorbové
Ve spalovacím vlaku byl spálen vzorek kyseliny askorbové (vitamín C) o hmotnosti 6,49 mg. Vzniklo 9,74 mg CO2 a 2,64 mg H2O. Určete empirický vzorec kyseliny askorbové.
Řešení Potřebujeme znát množství C, množství H a množství O ve vzorku. Jejich poměr udává indexy ve vzorci. První dvě lze získat z hmotností CO2 a H2O pomocí molárních hmotností a stechiometrických poměrů
\
\
\
Tedy
\
Sloučenina mohla obsahovat také kyslík. Abychom zjistili, zda ano, vypočítáme hmotnosti C a H a od celkové hmotnosti vzorku odečteme
\
Tak máme
\
a
\
Poměry množství prvků v kyselině askorbové jsou tedy
\
\
Protože nC:nH:nO je 3 mol C:4 mol H:3 mol O, empirický vzorec je C3H4O3.
Na obrázku je nakreslena molekula kyseliny askorbové. Podle počtu atomů můžete určit, že molekulový vzorec je C6H8O6 – přesně dvojnásobek empirického vzorce. Je také zřejmé, že o molekule je třeba vědět více než jen to, kolik atomů jednotlivých druhů je přítomno. U kyseliny askorbové, stejně jako u jiných molekul, je poměrně důležitý způsob, jakým jsou atomy navzájem spojeny, a jejich uspořádání v trojrozměrném prostoru. Obrázek, který ukazuje, které atomy jsou s kterými spojeny, se nazývá strukturní vzorec. Empirické vzorce lze získat z procentního složení nebo z pokusů se spalovacím traktem, a pokud je známa molekulová hmotnost, lze ze stejných údajů určit molekulové vzorce. Pro zjištění strukturních vzorců jsou nutné složitější experimenty. V příkladu 2 jsme získali hmotnost O odečtením hmotností C a H od celkové hmotnosti vzorku. To předpokládalo, že jsou přítomny pouze C, H a O. Někdy může být takový předpoklad nesprávný. Když byl penicilin poprvé izolován a analyzován, skutečnost, že obsahuje síru, byla přehlédnuta. Na tuto chybu se přišlo až po nějaké době, protože atomová hmotnost síry je téměř přesně dvakrát větší než atomová hmotnost kyslíku. Místo jednoho atomu síry byly ve vzorci nahrazeny dva atomy kyslíku.
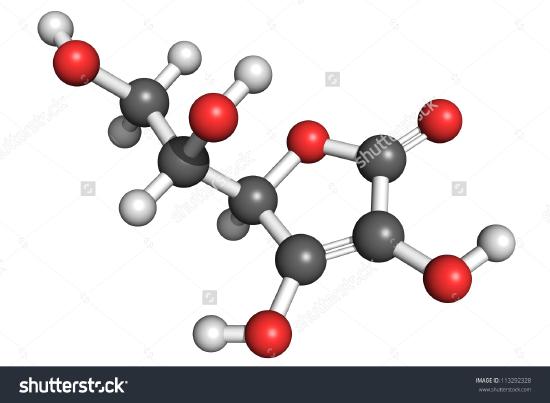
Obrázek \(\PageIndex{2}\) 3D znázornění kyseliny L-askorbové 1
Z ChemPRIME: 3.4: Analýza sloučenin