Úvod
Snad první zmínka v dějinách lidstva o vstřebávání železa a alkoholu pochází z roku 1200 př. n. l., legenda z Thesálie vypráví, jak Apolodorovi z Ifyku, který stál na poli a pozoroval svého otce při kastraci jehňat, hrozil stejný trest; když dospěl, byl Apolodorus impotentní. Čaroděj jménem Melampus, inspirovaný supem, vyléčil Apolodora tím, že mu dal vypít ve sklenici vína rez z nože, kterým jeho otec kastroval jehňata a kterým mu hrozil.
Početná je populace pacientů trpících alkoholem, které vidíme v naší nemocnici, stejně jako těch, kteří vyžadují hospitalizaci, s přihlédnutím ke všem morbidním entitám, které ji doprovázejí.
Naším cílem je prostřednictvím tohoto sdělení připomenout jednu z hematologických patologií přítomných u alkoholismu, která může často retrogredovat při samotné abstinenci: sideroblastickou anémii a hemosiderózu.
Bjorkman v roce 1956 popsal čtyři pacienty s chronickou refrakterní anémií a sideroblastickými prstenci s barvením buněk kostní dřeně pruskou modří.
První důkaz, že tyto sideroblastické prstence souvisejí s alkoholem, navrhli Mac Gibbon a Mollin v roce 1965, od té doby se alkoholismus stal nejčastější příčinou této patologie.
V roce 1969 popsal Hines (nahradil i jedničkou) u chronického alkoholismu výskyt reverzibilní sideroblastické anémie v důsledku abstinence.
Působení alkoholu
Mnohočetné patologické účinky alkoholu(nahradit 2) na krvetvornou tkáň lze rozdělit na:
Ty, které jsou důsledkem přímého působení alkoholu
Ty, které vznikají v důsledku účinků sekundárních nedostatků ve výživě
Ty, které jsou způsobeny onemocněním jater
Anémie je častou příčinou u alkoholiků.(nahradit 3) Nejčastějšími z nich jsou megaloblastická anémie a sideroblastická anémie.
Posledně jmenovaná skutečnost by mohla souviset s nutričními faktory a poruchami metabolismu vitaminu B6.
Snížení schopnosti pyridoxinu přeměnit se na pyridoxalfosfát, aktivní formu vitaminu B6, bylo prokázáno v důsledku inhibice aktivity pyridoxalfosfokinázy v erytrocytech.
Také se předpokládá, že etanol může působit jako stimulant membránové alkalické fosfatázy tím, že urychluje degradaci buněčného pyridoxalfosfátu (nahradit 4). Tuto změnu v metabolismu pyridoxinu potvrzuje snížení vylučování kyseliny pyridoxové, což je metabolit pyridoxinu, močí a snížení pyridoxalfosfátu v séru.
Pyridoxalfosfát působí také jako pomocný faktor při syntéze kyseliny delta-aminolevulové, která je jedním z prekurzorů hemoglobinové frakce obsahující železo, tj. hemu.
Další studie ukázaly, že etanol působí nejen přímo, ale také prostřednictvím svého metabolitu acetaldehydu. Acetaldehydu se také připisuje zvýšená degradace pyridoxalfosfátu, což vede ke snížení pyridoxalfosfátu v séru a zhoršení tvorby pyridoxalfosfátu v lidských červených krvinkách in vitro urychlením degradace fosforylovaných sloučenin vitaminu B6.
Při použití metod barvení železem (pruská modř a barvení Pearls) mají granule kovu neobsahující hemové železo, pravděpodobně ve formě hemosiderinu nebo feritinu, tendenci tvořit prstenec kolem jádra erytroblastů. Ty se nazývají sideroblastové prstence nebo prstencové sideroblasty.
Elektronová mikroskopie ukázala, že tyto sideroblasty mají ložiska železa na úrovni mitochondrií nebo cytoplazmatických tělísek.
Tyto morfologické abnormality jsou spojeny se všemi znaky neefektivní erytropoézy: hyperplazií erytroidů, zvýšeným vychytáváním železa erytroidními prekurzory kostní dřeně, subnormální inkorporací železa do cirkulujícího hemoglobinu se zpětným tokem železa do cirkulace, což způsobuje hyperferémii, nitrodřeňovou destrukci normoblastů, anémii a retikulocytopenii.
Frekvence sideroblastického prstence v erytroidní dřeni je častější u chronicky nemocných pacientů a u podvyživených alkoholiků.
Klinické a experimentální důkazy naznačují, že v patogenezi sideroblastické anémie u alkoholiků je důležitý nutriční faktor.
Experimentální chronické podávání alkoholu lidským dobrovolníkům vedlo k sideroblastickým změnám v kostní dřeni.
Při podávání alkoholu s nízkým obsahem pyridoxinu a folátů ve stravě se po několika týdnech u většiny sledovaných osob vyvinuly prstence
sideroblastů.
V roce 1970 se Hines a Cowan zmiňují o změně fosforylace pyridoxinu na pyridoxalfosfát, čímž potvrzují poruchu metabolismu pyridoxinu třemi směry vyšetřování:
Snížení pyridoxalfosfátu a sideroblastické kruhy se objevily u 2 ze 3 subjektů, které byly udržovány na dietě s nízkým obsahem folátů s přídavkem alkoholu. U nich se pak po podání pyridoxalfosfátu projevila hematologická odpověď, nikoli však při léčbě kyselinou listovou nebo pyridoxinem.
Po podání pyridoxinu u chronicky nemocných alkoholiků dochází k nedostatku tvorby pyridoxalfosfátu ve srovnání s kontrolami.
Popisují snížení přeměny pyridoxinu na pyridoxalfosfát enzymem v erytrocytech u alkoholiků in vitro. To vede k postulátu přímého potlačení pyridoxinfosforylázy v erytrocytech alkoholem. Alternativní vysvětlení poklesu pyridoxalfosfátu však předpokládá, že acetaldehyd, hlavní metabolit alkoholu, stimuluje aktivitu membránové fosfatázy a také snižuje množství pyridoxalfosfátu přenášeného z červené krvinky do plazmy.
Bez ohledu na mechanismus je však výsledek stejný, všechny vedou ke zvýšení množství Fe obsaženého v erytroblastech (sideroblastech)
Sideroblastóza zahrnuje špatnou inkorporaci železa do červené krvinky, což vede k hypochromii, neúčinné erytropoéze a zvýšené siderémii.
Hemosideróza u alkoholiků(nahradit 5) Na přetížení železem u alkoholiků se podílí celá řada příčin samostatně nebo společně, včetně výrazného zvýšení obsahu železa v některých alkoholických nápojích (zejména ve víně), zvýšená žaludeční sekrece kyseliny chlorovodíkové vyvolaná etanolem, hemolýza, krevní ztráty v gastrointestinálním traktu, nedostatek kyseliny listové, zvýšená střevní absorpce v důsledku poškození jater a poškození pankreatu, což dále zvyšuje siderémii a vede k hemosideróze.
Několik studií dokládá zvýšenou hladinu feritinu v séru u pacientů s alkoholem, což odráží zvýšené zásoby železa.
Po podání chelátorů železa, jako je desferroxamin, a následném měření siderurie lze semikvantitativně vyhodnotit zásoby železa. U alkoholiků je vylučování železa po těchto chelátorech také zvýšené ve srovnání s kontrolami.
Jiné studie však ukazují, že u hospitalizovaných pacientů s alkoholem jsou obě sérové koncentrace železa a/nebo feritinu v mezích normy nebo méně často zvýšené. Tyto rozdíly mohou být způsobeny výběrem pacientů zařazených do studie; pokud pacienti krvácejí z trávicího traktu v důsledku jícnových varixů, mohou mít vyčerpané zásoby železa, i když před krvácením byly vyšší než normálně.
Nakonec stojí za zmínku, že ve většině studií provedených za účelem měření sérového železa bylo u alkoholiků vždy zjištěno jeho zvýšené množství, přičemž korelace mezi usazeninami železa a množstvím zkonzumovaného alkoholu naznačuje, že tento prvek je příčinou siderózy.
Vstřebávání železa
Přibližně 5 až 15 mg železa požitého denně se vstřebá pouze 10 %.
Faktory ovlivňující vstřebávání železa mohou působit na třech úrovních: intraluminální, slizniční a celkové.
Je známo, že vstřebávání železa na intraluminální úrovni závisí na interakci různých potravin, takže některé, například aminokyseliny, vstřebávání usnadňují a jiné ho mohou snižovat. Absence trávicích sekretů může být faktorem, který modifikuje vstřebávání.
Při snaze vysvětlit hemosiderózu se nejprve předpokládalo, že strava pacientů s alkoholem je na tento prvek velmi bohatá. Toto pozorování bylo založeno na tzv. bantusové hemosideróze nebo bantusové hemosideróze. Studie provedené Jihoafričany na těchto kmenech zjistily, že jimi připravovaný nápoj zvaný kefír, druh piva, se vařil v železných nádobách a obsah železa v něm dosahoval 30 až 100 mg na litr. Obsah alkoholu v nápoji byl velmi nízký a konzumovali ho velké množství, až 1000 mg železa denně. Výroba kefíru se již neprovádí, což má za následek vymizení hemosiderózy v tomto kmeni.
Množství železa obsaženého v různých alkoholických nápojích je velmi variabilní a v některých případech dosahuje až 350 mg na litr (Rumunsko), i když obecně lze mít za to, že víno (bílé, klaret nebo červené) je na tento kov bohaté.
Je však také mnoho alkoholiků, jejichž hlavním nápojem není víno, ale whisky, pivo nebo jiné nápoje, které obsahují zanedbatelné množství železa.
Na druhou stranu, navzdory studii o bantusu, není nadbytek železa ve stravě dostatečným důvodem ke vzniku hemosiderózy. V Etiopii je tak základem stravy teff, semeno, které obsahuje velké množství železa, s denním příjmem 300 až 500 mg tohoto kovu. Navzdory tomuto příjmu nejsou ložiska zvýšena a výskyt anémie z nedostatku železa se neliší od běžné populace.
Je tedy zřejmé, že množství železa v potravinách nemá žádný význam.
Dosud se zdá, že alkohol nehraje na intraluminální úrovni při vstřebávání železa žádnou roli.
Na obecné úrovni je známo, že stav zásob železa podmiňuje jeho vstřebávání; jsou-li sníženy, vstřebávání se zvyšuje a naopak. Na této úrovni se podílí také erytropoéza, která při zvýšení absorpce zvyšuje její vstřebávání. Zdá se, že alkohol neurychluje přeměnu plazmatického železa, což by mohlo vysvětlovat zvýšení jeho absorpce.
Na slizniční úrovni může množství železa obsaženého ve sliznici, stejně jako úroveň syntézy bílkovin, ovlivnit absorpci železa. Bylo prokázáno, že nedostatek kyseliny listové po požití alkoholu může být zodpovědný za zvýšenou absorpci železa a následnou siderózu, která zhoršuje škodlivé účinky alkoholu na parenchym a zejména na játra.
Ve studiích na zvířatech bylo prokázáno, že chronické podávání alkoholu může být doprovázeno zvýšenou střevní absorpcí železa, jejíž mechanismus není znám.
V posledním desetiletí byly prokázány nejméně tři mechanismy, které se podílejí na translokaci železa přes duodenální sliznici:
Transportérem zprostředkovaný(regulovaný)
Pasivní mechanismus zprostředkovaný neesterifikovanými mastnými kyselinami
(neregulovaný) paracelulární vstup
Studie in vivo a in vitro prokázaly zvýšenou střevní propustnost u chronických alkoholiků, což nabízí možný mechanismus střevní absorpce železa.
Další studie naznačují, že může dojít ke zvýšení vnitřní schopnosti střevní sliznice pacientů s alkoholem přijímat železo.
Bylo zjištěno, že u osob se zvýšeným sérovým železem došlo během prvního týdne hospitalizace k poklesu naměřených hodnot železa s rozvojem retikulocytů. Bylo také zjištěno, že sideroblastické změny jsou ve shodě s jinými autory reverzibilní. Charakteristické kroužky z kostní dřeně zmizely během prvního týdne hospitalizace, i když některé přetrvávaly ještě dvanáct dní.
Nedávno(nahradit 6) byly u pacientů s chronickým alkoholismem zjištěny zvýšené sérové hladiny asialotransferinu; to ukazuje na zvýšenou schopnost uvolňovat železo do tkání, zejména do hepatocytů, ve srovnání s normálními variantami transferinu.
Bylo poukázáno na to, že může existovat také silný vztah mezi sideroblastickými změnami a nedostatkem folátu. Předpokládá se, že tento nedostatek může být nezbytným předpokladem pro projev sideroblastických změn u alkoholiků, ačkoli jiní autoři s tím nesouhlasí, protože navzdory výrazné anémii neměli žádné megaloblastické změny v kostní dřeni a žádnou makrocytózu ani neutrofilní hypersegmentaci v periferní krvi a koncentrace folátu v séru a erytrocytech byly normální.
Je důležité si uvědomit, že u pacientů s alkoholem je anémie chronických onemocnění v důsledku tuberkulózy, maligních onemocnění nebo selhání ledvin často spojena se sideroblastickou anémií, která je v této populaci velmi častá.
Shrnem lze říci, že příjem alkoholu spolu s nevhodnou stravou pravděpodobně vede ke vzniku sideroblastické anémie a hemosiderózy, jejichž patogeneze není dosud stanovena a mezi pravděpodobné faktory patří:
Toxický účinek alkoholu na jeden nebo více kroků syntézy hemu.
Souvislost se špatným stavem výživy vedoucím k depleci pyridoxalfosfátu a zrychlenému katabolismu způsobenému acetaldehydem, onemocněním jater nebo obojím
Zhoršený nedostatek folátu a kde hraje hlavní roli vysazení a náhrada výživy.
Klinický případ:
55letý pacient přijatý s otokem dolních končetin (1/6 suprapatelární, 2/6 infrapatelární) a křížové kosti měkké konzistence, distenzí břicha, bledostí sliznic, astenií a progresivní adynamií trvající tři měsíce.
Anamnéza:
Chronický alkoholismus (2 až 3 litry vína a/nebo piva denně) a kouření (40 cigaret denně), obojí za posledních 30 let.
Výsledky vyšetření provedených na oddělení:
RTG hrudníku: výpotek pravé kostodiafragmatické dutiny. Kardiotorakální index mírně zvýšený.
Paracentéza: exsudativní rysy.
Transfuze: Z důvodu HTO. indikována transfuze 2 jednotek deplasmatizovaných erytrocytů.
Předpokládaná diagnóza:
Etiologická: Chronický etylismus. Kouření.
Patofyziologické: Asciticko-edematózní syndrom. Asciticko-edematózní syndrom. Asciticko-edematózní maz. Anémie. Pleurální výpotek. Selhání jater.
Anatomopatologické: Hepatomegalie. Kardiomegalie.
Výsledky vyšetření provedených během hospitalizace:
FEDA: Chronická gastritida.
Dvojitý kontrastní klyzma tlustého střeva: Střevní tranzit zachován.
Echokardiogram: Středně těžký perikardiální výpotek.
Echopleurální: pravostranný pleurální výpotek.
Echoabdominální: játra kompatibilní s tukovými játry.
Serologické vyšetření: negativní na VDRL, Chagasovu chorobu, hepatitidu B a C.
PAMO a BMO: Kostní dřeň s těžkou dyspoézou červené řady.
Perls: jsou pozorována zvýšená intra- a extracelulární granula železa.
PBH: získaný materiál byl málo reprezentativní pro diagnostický závěr.
Laboratorní
Hematokrit (%): kolísal od 11.8 až 19
Červené krvinky (x10E12/l): vykazovaly odchylku od 1,1 do 1,94
Bílé krvinky (x10E9/l):vykazovaly odchylku od 7,7 do 9.2
Hemoglobin (g/dl): v rozmezí od 4,4 do 6.8
Trombocyty (x10E9/l): v rozmezí od102 do 346
Ferémie (mg/dl): v rozmezí od248 do 75
Ferritin (ng/dl): 594
TIBC (celková vazebná kapacita pro železo) (mg/dl): 360
Procento nasycení transferinem: kolísalo od 95 do 24
Bilirubin celkem (mg/dl): kolísal od 1.6 až 0,51
Přímý bilirubin (mg/dl): vykazoval odchylky od 1,92 do 0,18
Přímý bilirubin (mg/dl): vykazoval odchylky od 2,99 do 0,33
Medicínská léčba:
Hyposodium a dieta s nízkým obsahem bílkovin.
PHP střídavě po 21 kapkách za minutu. Albumin jedna lahvička paralelně každých 8 hodin, následovaná jednou ampulí furosemidu. Spironolakton jedna tableta každých 12 hodin. Fytomenadion (Konakion) jedna ampule každých 12 hodin.
Laktulóza (Lactulon) jedna polévková lžíce každých 6 hodin. Vitamin B komplex jedna tableta každých 12 hodin.
Vzhledem k dobré odpovědi pacienta se pokračuje v perorální léčbě diuretiky a vitaminem B komplex. Laktulóza a fytomenadion byly vysazeny.
Pacient měl příznivý klinický vývoj asciticko-edematózního stavu, proto byl propuštěn, byl medikován vitaminem B a bylo mu doporučeno nepít alkohol.
Pokračuje jeho lékařská kontrola ambulancemi lékařské kliniky naší nemocnice a hematologickou službou nemocnice Álvarez..
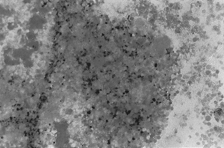
PAMO X 100
– Perlsovo barvení. Vyniká medulární bulka s intenzivním extracelulárním ukládáním železa.
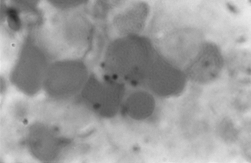
PAMO X 1000
– Perlsovo barvení. Je pozorováno intraerytroblastické ukládání železa.
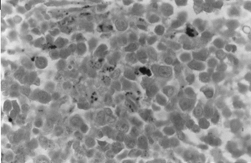
BMOX100
– Perlsovo barvení. Tam, kde jsou pozorovány husté intra- a extraerytroblastické akumulace železa.
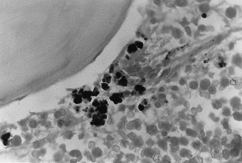
BMO X 1000
– barvení Peris. Tam, kde jsou pozorovány husté intra- a extraitroblastické akumulace železa.
Pacient měl dobrý postinternační vývoj. Po šedesáti dnech mu byl proveden krevní test s následujícími výsledky: HTO 43 %, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/di, Plaq.354 X10E9/L, pouze s dodržováním léčby.
Po sto dvaceti dnech byl opět sledován se stejnými výsledky krevního testu.
Po sto dvaceti dnech byl opět sledován se stejnými výsledky krevního testu.
Po sto dvaceti dnech byl opět sledován se stejnými výsledky krevního testu.