Nejobecnější princip určující sílu kyseliny lze vyjádřit takto: silné kyseliny mají relativně stabilní konjugované báze. Obecně platí, že čím stabilnější je konjugovaná báze, tím silnější je kyselina. Důležité je si uvědomit, že stabilita a reaktivita jsou inverzní. Čím je látka stabilnější, tím je méně reaktivní, a naopak. Proto lze výše uvedené pravidlo vyjádřit i jinak: silné kyseliny mají slabé konjugované báze. HCl a H3O+ jsou silné kyseliny. V souladu s tím jsou odpovídající konjugované zásady, Cl- a H2O, slabé (velmi stabilní). Chloridový ion je stabilní, protože záporný náboj se nachází na velmi elektronegativním atomu. Molekula vody je jednou z nejstabilnějších známých látek.
Jak poznáme, který proton je nejkyselejší v molekule (např. kyseliny octové), která obsahuje více než jeden typ protonu? Pamatujte si, že čím vyšší je stupeň kladného charakteru na protonu, tím je kyselejší. Zkoumání tabulky pKa ukazuje některé trendy pro kyselé protony. K předpovědi kyselosti lze použít následující pokyny.
1. Hydrogeny přímo vázané na velmi elektronegativní atomy, jako je kyslík, síra a halogeny, nesou značný stupeň kyselosti.
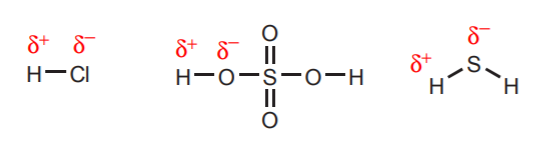
2. Hydrogeny vázané na kladně nabitý dusík, kyslík nebo síru jsou kyselé. Vysoká elektronegativita těchto atomů způsobuje, že jim kladný náboj vadí. Snaží se náboj rozptýlit mezi sousední atomy tím, že jim odebírají elektronovou hustotu. To lze ukázat nakreslením rezonančních struktur podle obrázku.
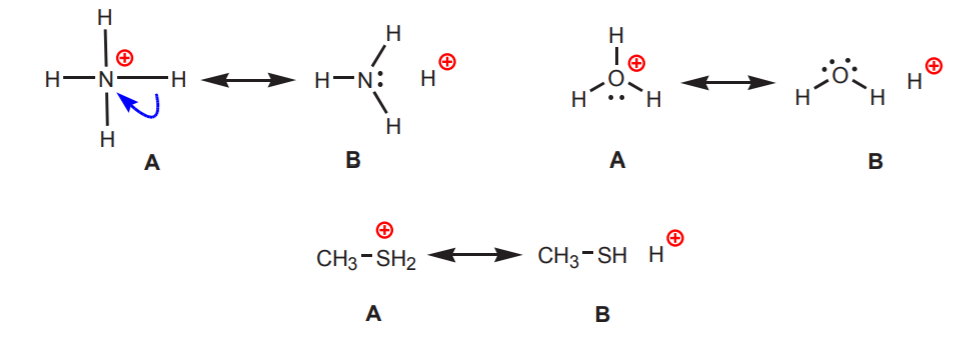
Ve všech případech struktura B odhaluje kladný charakter vodíku, a tedy jeho kyselou povahu.
3. Jak dokládají hodnoty pKa alkanů a alkenů, vodíky připojené k uhlíku mají velmi nízkou kyselost. Takové látky se obvykle vůbec nepovažují za kyseliny. Některé uhlovodíky však mohou být slabě kyselé, pokud jsou jejich konjugované báze stabilními ionty. K tomu může dojít v následujících případech:
a) V blízkosti uvažovaného protonu se nachází jeden nebo více elektronegativních atomů. Indukční účinek těchto elektronegativních atomů ponechává vodíky v okolí zbavené elektronové hustoty, a proto mají částečně kladný charakter.
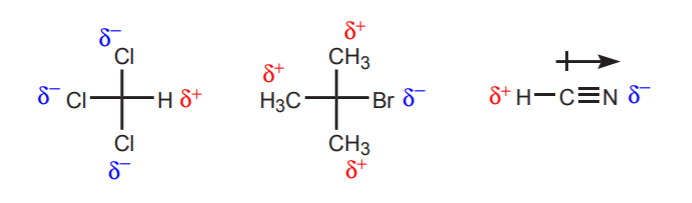
b) Atom vodíku vázaný na uhlík, který je zase vázán na jiný uhlík, který nese částečný nebo úplný kladný náboj, je kyselý.
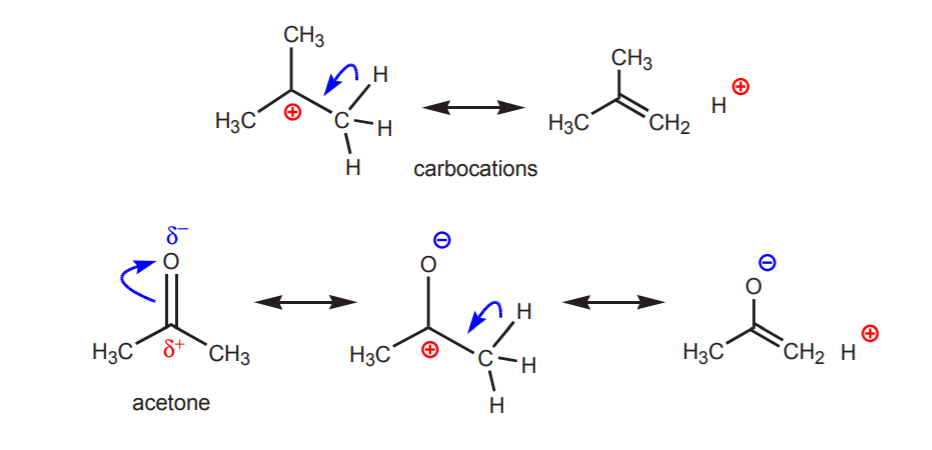
Kyselost zobrazených protonů se projeví v eliminačních reakcích (kapitola 6) a v chemii enolů (kapitola 22), kdy přítomnost báze vede ke vzniku alkenů nebo enolátových iontů krokem zahrnujícím přenos protonu.
c) Konjugovaná báze je rezonančně stabilizovaná. Tento efekt je nejdůležitější, pokud je přítomen další faktor zvyšující kyselost, například přítomnost dipólu nebo elektronegativního atomu (jako u nitrilové funkční skupiny, -CN). Jinak samotná rezonanční stabilizace nestačí k dramatickému zvýšení kyselosti vodíku navázaného na uhlík (jako v toluenu, kde je pKa pouze 40).
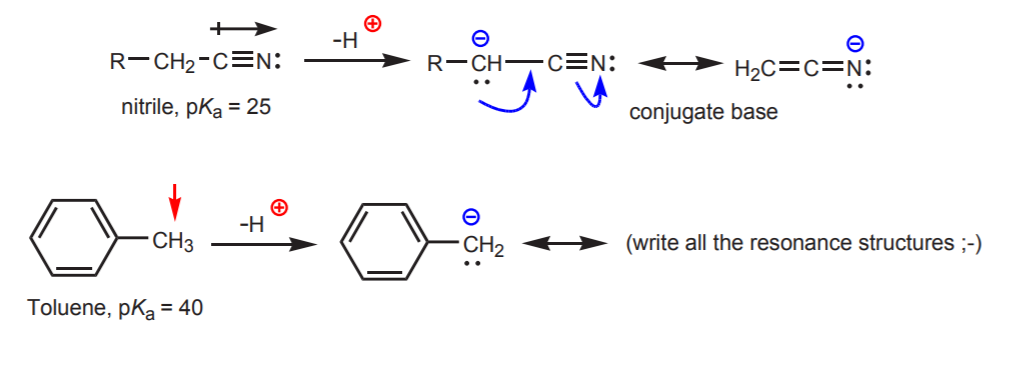
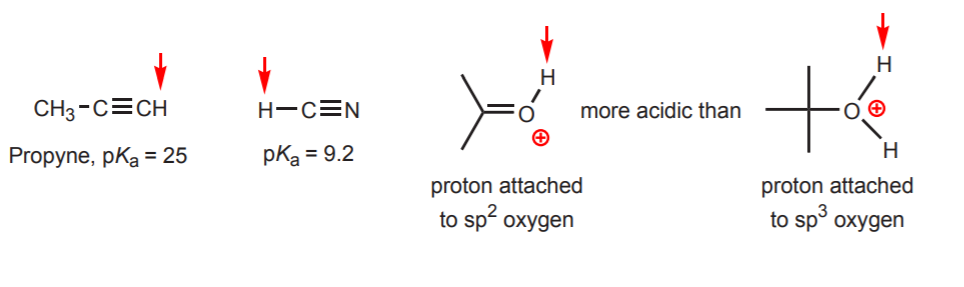
d) Vodík je navázán na sp-hybridizovaný uhlík. Vlivem hybridizace na kyselost se zabývá kapitola 9. Hybridizační trendy lze kromě uhlíku rozšířit i na kyslík a dusík, jako v příkladu vpravo.
.