Structura, dinamica și funcția aquaporinelor
 Câștigătorul ediției 2004 a concursului Visualization Challenge in Science and Engineering,
Câștigătorul ediției 2004 a concursului Visualization Challenge in Science and Engineering, Organizat de National Science Foundation și Science Magazine. (A se vedea articolul Science aferent.)
Filmul nostru despre permeabilitatea apei și premiul Nobel pentru chimie 2003
Arta transportului apei în Aquaporine
Aquaporinele sunt canale de apă membranare care joacă roluri critice în controlul conținutului de apă din celule. Aceste canale sunt larg răspândite în toate regnurile vieții, inclusiv în bacterii, plante și mamifere. Mai mult de zece aquaporine diferite au fost găsite în corpul uman, iar mai multe boli, cum ar fi cataracta congenitală și diabetul insipidnefrogenic, sunt legate de funcționarea deficitară a acestor canale. Acestea formează tetrameri în membrana celulară și facilitează transportul apei și, în unele cazuri, al altor soluturi mici prin membrană. Cu toate acestea, porii de apă sunt complet impermeabili la speciile încărcate, cum ar fi protonii, o proprietate remarcabilă care este esențială pentru conservarea potențialului electrochimic al membranei, dar paradoxală în același timp, deoarece protonii pot fi de obicei transferați cu ușurință prin moleculele de apă. Rezultatele simulărilor noastre au oferit acum o nouă perspectivă asupra mecanismului care stă la baza acestei proprietăți fascinante. Moleculele de apă care trec prin canal sunt forțate, de forțele electrostatice ale proteinei, să se întoarcă în centrul canalului (vezi animația), rupând astfel aranjamentul alternativ donator-acceptor care este necesar pentru translocarea protonilor (citiți povestea completă în articolul nostru din Science).

Implicația funcțională a unei arhitecturi proteice deosebite
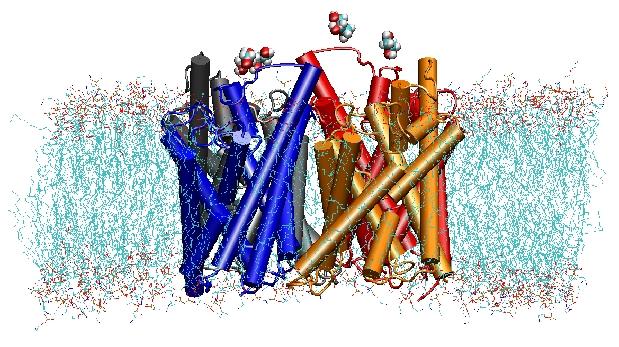
În anul 2000, laboratorul lui Stroud de la UCSF a reușit să rezolve prima structură de înaltă rezoluție a unei aquaporine prin cristalografie cu raze X. Structura studiată a fost cea a facilitatorului de absorbție a glicerolului din E. coliglycerol (GlpF), care este o aquagliceroporină,adică canalul este permeabil și la moleculele mici de zahăr liniar,cum ar fi glicerolul. Simulările MD la nanosecunde ale GlpF tetrameric în bistratul lipidic POPE ahidrat au caracterizat calea completă de conducere a substratului în canal. Analiza legăturilor de hidrogeninteracțiuni ale substratului cu interiorul canalului a explicat, de asemenea, pentru prima dată, de ce aceste canale încorporează în arhitectura lor două bucle caracteristice, incluzând elemente de structură secundară nefavorabile din punct de vedere energetic, care sunt conservate în întreaga familie de aquaporifamilie (Jensenet al., Structure, 2001).
Energetica permeabilității zahărului
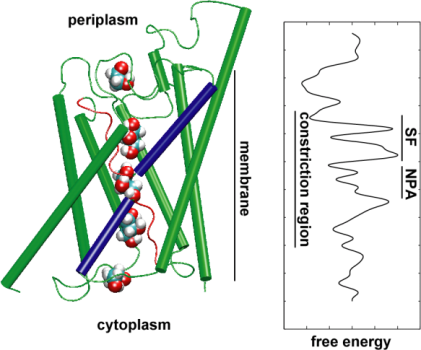
Apoi, am explorat energetica transportului pentru a înțelege ce bariere trebuie să depășească un substrat în timpul trecerii sale prin canal. Pentru a descrie profilul de energie liberă, am calculat potențialul de forță medie pentru evenimentul de conducție completă din traiectoriile în care mișcarea glicerolului prin canal a fost accelerată prin aplicarea de forțe externe. Această tehnică, cunoscută sub numele de dinamică moleculară dirijată (SMD), permite observarea evenimentelor lente în cadrul scalei de timp accesibile a simulărilor MD. Cu toate acestea, din cauza naturii de neechilibru a traiectoriilor, în analiza rezultatelor se pune problema muncii ireversibile care trebuie luată în considerare. Utilizând identitatea lui Jarzinsky, egalitatea dintre energia liberă și lucrul în sistemele de non-echilibru, am putut descrie complet energetica transportului glicerolului prin canal. Potențialul calculat al forței medii surprinde principalele situsuri de legare și bariere din canal, în strânsă concordanță cu rezultatele simulărilor MD de echilibru și cu structura cristalină. În plus, acesta prezintă o asimetrie pronunțată în forma sa, sugerând că structura asimetrică a proteinei poate fi importantă din punct de vedere funcțional pentru o absorbție eficientă a moleculelor nutritive din mediul înconjurător. (Jensen, etal., PNAS, 2002).
What Makes an Aquaporin a Glycerol Channel
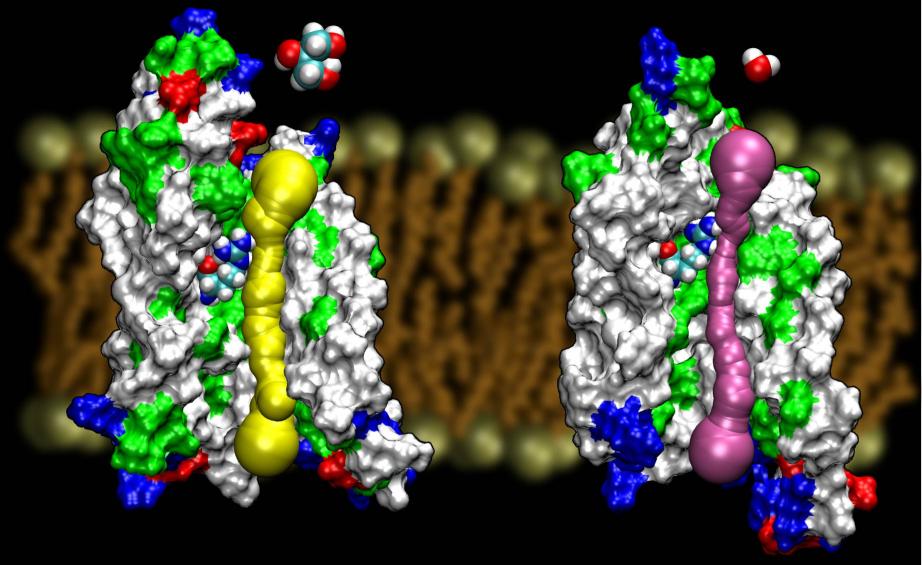
Aquaporinele sunt o familie foarte norocoasă de proteine de membrană,care sunt în mod notoriu rezistente la determinarea structurii. Noi avem în prezent structuri de înaltă rezoluție ale mai multor AQP-uri: GlpF, AQP1, AQP1, AQP0, șiAqpZ. Se așteaptă ca mai multe structuri să apară în curând. Disponibilitatea structurii a două AQP de la E. coli, unul care este un canal de apă pură (AqpZ) și celălalt un canal de glicerol (GlpF), ne-a oferit o oportunitate unică de a înțelege principiile de selectivitate folosite de natură în utilizarea a două canale foarte asemănătoare din punct de vedere genetic și structural pentru traficul membranar al diferitelor materiale.Compararea barierelor calculate pentru conducerea glicerolului în aceste două canale a arătat că AqpZ profită de barierele sterice pentru a face dificilă trecerea glicerolului. De fapt, porul este în general mai îngust decât GlpF (a se vedea figura de mai jos). Se pare că natura a recurs la un mecanism foarte elementar, și anume reglarea dimensiunii porului canalului, pentru a face ca două proteine din aceeași familie să prezinte proprietăți de conducere diferite. Citiți întreaga poveste în Wang, etal., STRUCTURE, 2005.
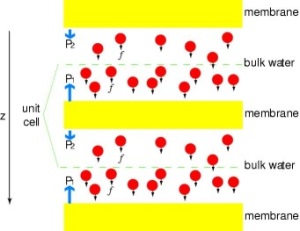
Punerea sub presiune a canalelor
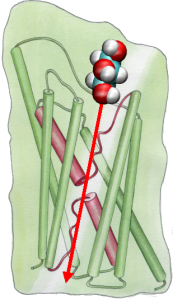
Pentru a compara direct rezultatele simulărilor MD cu măsurătorile biochimice ale conductivității canalelor de apă din membrană, în care gradienții de presiune osmotică sunt folosiți pentru a induce curgerea apei prin membrană, am dezvoltat o nouă metodologie pentru simulările MD. Prin aplicarea unor forțe mici asupra moleculelor de apă în zona de masă (a se vedea figura), se generează un gradient de presiune hidrostatică de-a lungul membranei. Gradientul de presiune induce viteze de conducție care pot fi studiate cu ajutorul simulărilor MD, care sunt de obicei limitate la câteva nanosecunde. Metoda a fost aplicată în simularea permeabilității apei prin GlpF și a avut ca rezultat o corelație liniară între presiunea aplicată și flux (Zhu et al., Biophys. J., 2002).
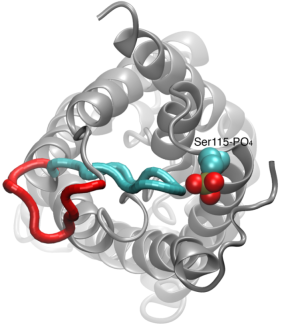
Gating of Water Channels
Permeabilizarea apei prin aquaporine este un proces pasiv care urmează direcția presiunii osmotice de-a lungul membranei. Deși multe aquaporine funcționează ca niște canale mereu deschise, un subgrup de aquaporine, în special la plante, au evoluat un mecanism molecular sofisticat prin care canalul poate fi închis ca răspuns la condițiile dure ale mediului, în care schimbul de apă poate fi dăunător pentru organism. Exemple de astfel de condiții sunt stresul de secetă și inundațiile, care declanșează anumite semnale celulare (defosforilarea și modificarea pH-ului) care au ca rezultat închiderea canalului. O structură recent rezolvată a unei aquaporine din spanac a fost simulată în diferite condiții pentru a investiga mecanismul molecular al pornirii în aceste canale membranare. S-a constatat că o buclă citoplasmatică alungită în aquaporinele cu capacitate de închidere a porului de apă în canalul închis și blochează accesul moleculelor de apă la por. Deplasarea acestei bucle ca răspuns la fosforilare, așa cum s-a observat în simulări, îndepărtează bucla de la intrarea citoplasmatică a porului. În plus, un aminoacid hidrofob care este strâns cuplat conformațional cu această buclă va fi tras înapoi din canal ca urmare a deplasării buclei. Împreună, aceste evenimente moleculare au ca rezultat un canal deschis care este permeabil pentru moleculele de apă. Studiul a apărut în Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
AQPs sunt în general cunoscute pentru permeabilitatea lor ridicată la apă. Cu toate acestea, a fost sugerată implicarea lor în alte funcții celulare, inclusiv permeabilitatea moleculelor mici, altele decât apa, precum și comunicarea celulă-celulă. Tetramerizarea este o caracteristică structurală comună a AQP-urilor. Faptul că cei patru monomeri formează fiecare un por de apă independent din punct de vedere funcțional, dar au nevoie de o organizare tetramerică pentru a funcționa, sugerează un beneficiu sinergic al oligomerizării și, astfel, obligă la o analiză suplimentară a rolului potențial al porului central în AQP. O propunere interesantă este posibila implicare a porului central în conducerea ionică la activarea cGMP. Folosind simulări MD ale modelelor de AQP1 încorporate în membrană, am investigat această proprietate a AQP1, pentru a determina cum și în ce condiții de conformație și hidratare porul central ar putea conduce și cum este reglată conductivitatea. Una dintre buclele citoplasmatice, și anume bucla D bogată în arginină, a fost sugerată de simulările noastre ca jucând un rol cheie în activarea porului central mediată de cGMP. Rolul sugerat al buclei D a fost verificatexperimental printr-un mutant proiectat al buclei D care prezintă o pierdere completă a conductivității ionice ( Yu et al.,Structure, 2006 ) .
Moleculele de gaz fac naveta în celulă
În fiecare dimineață, mulți oameni merg cu mașina la serviciu, în timp ce alții pot merge cu bicicleta, cu autobuzul sau cu metroul. în mod similar, diverse biomolecule din corpul uman ajung, de asemenea, la destinațiile lor în moduri diferite. De exemplu, pentru a traversa membrana celulară, moleculele mici de gaz hidrofobice difuzează prin stratul lipidic, în timp ce moleculele de apă trec prin aquaporine (AQP).În mod interesant, la fel cum cineva poate ajunge la serviciu atât cu autobuzul, cât și cu mașina, s-a descoperit recent că unele molecule de gaz pot avea mai multe moduri de a traversa membrana, și anume, Pe lângă difuzia prin lipide, oxigenul și dioxidul de carbon pot, de asemenea, să treacă prin AQP.Cu toate acestea, căile pe care le parcurg aceste molecule de gaz au rămas evazive.Folosind dinamica moleculară realizată cu NAMD, am investigat permeabilitatea la gaze a AQP1 cu ajutorul a două metode complementare (simularea explicită a difuziei gazelor și eșantionarea implicită a liganzilor). Rezultatele simulării sugerează că, în timp ce porii patrumonomerici ai AQP1 funcționează ca canale de apă, porul central al AQP1 poate servi ca o cale pentru ca moleculele de gaz să traverseze membrana (Wang et al., Journal of Structural Biology, 2007 ).
Cursă cu obstacole moleculare
Celulele biologice își protejează interiorul prin membranele lor celulare, dar se bazează pe importul de nutrienți. Ele au evoluat pentru acest import canale de conducere rapide care includ puncte de control fiabile care disting compușii dezirabili de cei indezirabili. Un punct de control constituie o adevărată cursă cu obstacole pe care numai compușii potriviți o pot trece rapid. Înțelegerea designului canalului este dificilă din cauza lipsei de date experimentale detaliate privind dinamica nutrienților. În prezent, cele mai detaliate informații provin din vizualizarea dinamicii canalelor pe cale computațională, pornind de la structuri cristalografice statice. Un studiu recent a investigat modul în care glicerolii, mici molecule nutritive de care au nevoie unele bacterii, trec prin punctele de control realizate prin canalul de glicerol GlpF. GlpF furnizează patru canale paralele care au fost monitorizate computațional folosind NAMD și un algoritm nou care explorează energetica canalului suficient de rapid pentru a fi fezabil din punct de vedere metodologic pe calculatoarele actuale. Rezultatele arată cum sunt sondate de-a lungul canalului caracteristicile fizice ale glicerolului, capacitatea lor de a forma așa-numitele legături de hidrogen, momentele lor de dipol electric, mobilitatea lor difuză și flexibilitatea lor intrinsecă (Henin et al., Biophysical Journal, în curs de publicare ).
Our Aquaporin Research in the News
|
Echipa Aquaporin
|
Publicații
-//W3C//DTD XHTML 1.0 Transitional//EN” „http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Baza de date Difuzarea glicerolului prin Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, and Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Explorarea permeabilității la gaze a membranelor celulare și a canalelor membranare cu ajutorul dinamicii moleculare.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten și Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, and P. Kjellbom. Nature, 439:688-694, 2006. Ce face ca o aquaporină să fie un canal de glicerol: A comparative study of AqpZ and GlpF.Yi Wang, Klaus Schulten, and Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetic theory and simulation of single-channel water transport.Emad Tajkhorshid, Fangqiang Zhu, and Klaus Schulten. În S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Țările de Jos, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor și Klaus Schulten. În Boris Martinac și Andrzej Kubalski, editori, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Model de difuzie colectivă pentru permeabilitatea apei prin canale microscopice.Fangqiang Zhu, Emad Tajkhorshid și Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 pagini). Computational studies of membrane channels.Benoit Roux și Klaus Schulten. Structure, 12:1343-1351, 2004.