14.1 Introducere în neuropeptide și oxidul nitric
Neurotransmițătorii clasici (de exemplu, glutamatul și ACh) acționează prin transferul direcțional de informații între locurile de eliberare presinaptică și grupurile de receptori postsinaptici. Procesul este, în general, bine organizat din punct de vedere spațial, cu o anumită, dar foarte limitată, „revărsare” a transmițătorului între sinapsele vecine. Situația este destul de diferită în cazul transmisiei mediate de neuropeptide și de oxidul nitric (NO). Aceste molecule ignoră direcționalitatea fluxului de informații și, în schimb, influențează un volum de zonă de la punctul lor de eliberare. Această caracteristică este în mare măsură analogă cu eliberarea hormonilor peptidici în fluxul sanguin, care pot fi transportați în locuri îndepărtate pentru a-și produce efectele. De exemplu, NO poate fi produs într-un neuron postsinaptic și poate fi difuzat înapoi la neuronul presinaptic sau la alți neuroni vecini, afectând eliberarea ulterioară de transmițător. Această proprietate se numește transmisie retrogradă, deoarece semnalul călătorește în direcția opusă (de la post- la pre-) în comparație cu direcționalitatea clasică a neurotransmisiei.
14.2 Neuropeptide
Multe neuropeptide au fost descrise inițial ca hormoni (de exemplu, somatostatina și colecistochinina), deși, odată caracterizate, au fost găsite ulterior și în neuronii din SNC. Neuropeptidele produc de obicei răspunsuri neuronale cu debut lent și durată lungă (figura 14.1), iar fiecare receptor neuropeptidic caracterizat se încadrează în clasa GPCR (receptor cuplat cu proteina G). Pentru comparație, figura 14.1 prezintă răspunsuri tipice produse de acțiunea unui neurotransmițător clasic (glutamat) care acționează la un receptor ionotropic și la o neuropeptidă. Un potențial de acțiune declanșat în neuronul 1 (în verde), un neuron care eliberează glutamat, produce un EPSP rapid (5 msec) tipic pentru transmisia sinaptică mediată de glutamat. În schimb, un potențial de acțiune declanșat în neuronul 2 (violet), care eliberează neuropeptide, produce un EPSP cu debut lent (5 secunde până la vârf) și de lungă durată (10 secunde). Aceste EPSP lente sunt tipice pentru acțiunile neuropeptidelor, deoarece toți receptorii neuropeptidelor sunt cuplați cu proteina G.
Figura 14.1
În plus, multe neuropeptide nu produc o modificare electrofiziologică evidentă în neuronii postsinaptici. De exemplu, un potențial de acțiune în neuron 3 (figura 14.1; roz) nu produce niciun răspuns în neuronul postsinaptic, chiar dacă se poate confirma prin alte mijloace că au fost eliberate neuropeptide. Cu toate acestea, au avut loc modificări în neuronul postsinaptic, așa cum reiese din exemplul prezentat în panourile etichetate „C”. Dacă se măsoară mai întâi răspunsul glutamatului (C1) prin stimularea neuronului 1, se observă un răspuns tipic. Stimularea neuronului 3 nu produce niciun răspuns (C2), ca și înainte. Cu toate acestea, dacă neuronul 1 este stimulat din nou după stimularea neuronului 3, EPSP-ul măsurat în neuronii postsinaptici este îmbunătățit (C3) (EPSP-ul original este linia continuă, iar EPSP-ul în urma stimulării neuronului 3 este linia punctată). Astfel, neuropeptidul eliberat de neuronul 3 a modificat răspunsul neuronului postsinaptic la un alt neurotransmițător. Se spune că aceste neuropeptide sunt neuromodulatoare, deoarece efectele lor sunt de a potența sau de a diminua efectele unui al doilea transmițător. Alte exemple de astfel de plasticitate heterosinaptică sunt descrise în capitolul 7, partea 2.
14.3 Clasificarea peptidelor pe familii
Neuropeptidele pot fi grupate în familii pe baza asemănărilor în secvențele lor de aminoacizi (tabelele I și II).
Tabelul I
Familii de neuropeptide
Tachicinine: substanța P, bombesina, substanța
Insuline: insulina, factori de creștere asemănători insulinei
Somatostatine: somatostatina, polipeptidul pancreatic
Gastrine: gastrină, colecistochinină
Opioide: opiocortine, encefaline, dinorfină
De exemplu, opiaceele sunt grupate ca o familie datorită secvenței identice de aminoacizi Tyr-Gly-Gly-Phe–(tabelul II) care se găsește la extremitatea N-terminală a fiecăreia.
| Tabel II Familia de opiacee – identitatea secvenței în italice |
|
| Nume | Secvența de aminoacizi |
| Leu-enkephalin | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkephalin | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dinorfină | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosinteză și reglare
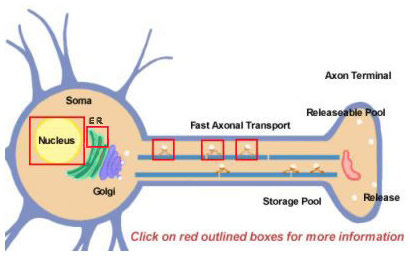
Figura 14.2
Neuropeptidele sunt derivate din precursori mai mari prin procesare proteolitică. Ele sunt toate sintetizate inițial în cadrul soma (figura 14.2). Precursorii sunt formați inițial prin traducere pe poliribosomi atașați la reticulul endoplasmatic din apropierea corpului celular. De acolo, ei progresează prin aparatul Golgi, unde au loc alte modificări, inclusiv glicozilarea. Ei sunt apoi împachetați în granule secretorii care sunt transportate la terminale prin transport axonal rapid. Cu toate acestea, rapid este un termen relativ și se datorează distanțelor relativ mari pe care trebuie să le parcurgă unele neuropeptide. Reaprovizionarea rezervei de neuropeptide eliberabile ar putea necesita multe ore. În timpul transportului către terminalul nervos, proteazele care sunt împachetate în interiorul veziculei încep să scindeze neuropeptidul precursor în forma sa finală matură. Această procesare este esențială pentru activarea neuropeptidelor, deoarece precursorii sunt inactivi din punct de vedere biologic. În interiorul veziculelor au loc cel puțin trei tipuri de procesare (figura 14.2; faceți clic pe casete pentru mai multe detalii). În primul rând, o endopeptidază scindează precursorul pentru a genera două produse noi (Prima casetă din axon). Pentru mulți precursori, această scindare are loc după reziduurile bazice (cum ar fi Lys și Arg) și este realizată de proteaze asemănătoare tripsinei. Apoi, deși nu în cazul tuturor neuropeptidelor, o carboxipeptidază scindează reziduurile bazice de la extremitatea C-terminală a noii peptide (a doua casetă din axon). În cele din urmă, o a treia enzimă convertește gruparea COOH (carboxi) a unui reziduu Gly, care se găsește la extremitatea C-terminală a multor neuropeptide, într-o grupare NH2 (amidă) pentru a produce forma matură, activă a neuropeptidei.
14.5 Mecanisme multiple sunt utilizate pentru a produce diversitatea neuropeptidelor
Majoritatea proteinelor sunt produse din molecule de ARNm care sunt îmbinate din ARN-uri precursoare în formele lor finale în nucleu. Splicarea diferențială este o modalitate pe care un neuron o folosește pentru a diversifica producția de diferite tipuri de neuropeptide. Un exemplu bine cunoscut este ARNm al substanței P care, în mod normal, include și ARNm care codifică substanța K. Porțiunea de substanță K din ARNm poate fi splicată diferențiat, astfel încât ARNm rezultat să producă numai substanța P (faceți clic pe caseta de deasupra nucleului din figura 14.2)
Figura 14.3
Neuropeptidele sunt produse dintr-o proteină precursoare mai lungă prin procesare proteolitică. Un exemplu excelent este familia de peptide opioide (de exemplu, procesarea proopiomelanocorticotropinei, a POMC și a encefalinei; a se vedea figura 14.3). După cum s-a observat, procesarea proteolitică are loc în interiorul veziculelor de transport și cel mai adesea are loc prin scindarea precursorului pe partea N-terminală a reziduurilor bazice (arginină și lizină), deși au fost identificate și alte locuri de scindare. În unele cazuri, cum ar fi cel al proteinei precursoare Enkephalin, sunt prezente mai multe copii ale aceleiași peptide bioactive finale. Singura moleculă precursoare prezentată în partea de sus a figurii 14.3 conține șase copii de Met-enkefalină (ME) și o copie de Leu-enkefalină (LE).
Diversitatea poate fi astfel generată prin modificarea secvenței situsurilor de clivaj prin splicing diferențial, prin producerea și/sau împachetarea de proteaze diferite (care recunosc secvențe diferite pentru clivaj) în veziculele de transport sau prin ascunderea unui situs proteolitic prin modificări post-translaționale. Un exemplu de aceasta din urmă este faptul că un situs de clivaj specific ar putea fi ascuns prin adăugarea unui lanț lateral de carbohidrați care blochează steric accesul proteazei la acel situs. O altă constatare comună este că o singură moleculă precursoare va conține mai multe neuropeptide diferite (a se vedea figura 14.3) și, prin urmare, tipurile de procesare care au loc determină în cele din urmă ce neuropeptidă este eliberată de neuron. Proteina precursoare POMC poate fi scindată pentru a forma ACTH (portocaliu) și β-lipoproteina (albastru deschis) care pot fi scindate fiecare în continuare pentru a genera neuropeptide bioactive suplimentare (figura 14.3). De exemplu, β-lipoproteina (albastru deschis) poate fi scindată ulterior atât în γ-lipoproteină (dungi verzi), cât și în β-endorfină (albastru închis). Din nou, în funcție de procesarea care are loc, aceeași proteină precursoare poate fi modificată pentru a produce neuropeptide cu răspunsuri biologice extrem de diferite.
14.6 Eliberarea
Figura 14.4
Peptidele sunt eliberate prin exocitoză dependentă de calciu, cu unele diferențe importante față de eliberarea neurotransmițătorilor clasici. În mod obișnuit, veziculele care eliberează neuropeptide sunt mult mai mari decât cele care conțin neurotransmițători cu molecule mici (de exemplu, glutamat) și nu necesită o specializare presinaptică pentru eliberare (a se vedea micrografia electronică din figura 14.4). Spre deosebire de veziculele mici care conțin glutamat, veziculele mari nu apar andocate la membrană. Această observație este în concordanță cu ideea că neurotransmițătorii cu molecule mici produc efecte scurte, locale (la nivelul conexiunilor sinaptice), în timp ce neuropeptidele produc efecte lente, de lungă durată, care cuprind adesea o zonă semnificativă din jurul locului de eliberare. De asemenea, reamintim că, din moment ce neuropeptidele sunt sintetizate în soma celulară și nu la nivel local la sinapsă, în cazul în care rezerva lor este epuizată în urma unei eliberări susținute, ar putea dura câteva ore pentru a reface rezervele eliberabile. De exemplu, un neuron motor, cu corpul său celular în măduva spinării și sinapsa în picior, are un axon lung de un metru. Utilizând transportul axonal rapid, ar putea dura mai mult de o zi pentru ca o neuropeptidă nou sintetizată să ajungă de la soma la această sinapsă. De asemenea, ar trebui să fie evident că neuropeptidele endogene care distrug durerea, cum ar fi beta-endorfina, ar putea fi „consumate” în perioadele de stimulare persistentă, ceea ce duce la situații în care durerea nu mai poate fi controlată prin mecanisme endogene.
Un neuron tipic matur va elibera adesea un neurotransmițător cu moleculă mică și una sau mai multe neuropeptide (ca în exemplul prezentat în figura 14.4). Dacă se eliberează mai mult de o neuropeptidă, acestea provin cel mai adesea din aceeași moleculă precursoare unică. Un exemplu este coeliberarea atât a ACh, cât și a peptidei legate de gena calcitoninei din neuronii motori spinali. CGRP activează adenilatciclaza, crescând nivelul de AMPc, și potențează forța de contracție produsă de activarea ACh a receptorului nicotinic ACh. În acest caz, neuropeptidul este modulator, așa cum este descris în figura 14.1. Cu toate acestea, în acest caz, efectul potențează contracția musculară în loc să crească magnitudinea EPSP. În ambele exemple, răspunsul potențat se datorează unei sensibilități crescute a sistemului la o cantitate constantă de neurotransmițător eliberat.
14.6 Încetarea acțiunii
Neuropeptidele sunt eliminate lent din spațiul extracelular; o caracteristică care contribuie, de asemenea, la efectele lor de durată relativ lungă. Inactivarea are loc atât prin difuzie cât și prin descompunere de către proteaze extracelulare. Nu au fost găsite dovezi privind reabsorbția peptidelor ca mijloc de încetare a acțiunii lor.
14.7 Receptorii sunt toți legați de proteina G
Toți receptorii neuropeptidici cunoscuți își produc efectele prin modificarea nivelurilor de mesageri secundari intracelulari. Acești receptori sunt șapte proteine cu deschidere transmembranară care sunt legate prin intermediul proteinelor G (GPCR) pentru a modifica activarea altor enzime celulare. Această proprietate este în concordanță cu faptul că neuropeptidele induc un răspuns mai lent și este foarte potrivită pentru un rol modulator. O distincție importantă între transmițătorii cu molecule mici și cei cu molecule neuropeptidice este aceea că receptorii neuropeptidici au o afinitate mare de legare (nanomolară), spre deosebire de afinitățile micro- sau milimolare măsurate pentru neurotransmițătorii cu molecule mici (cum ar fi glutamatul). Deoarece neuropeptidele nu sunt eliberate în mod direcțional în volumul limitat al unei sinapse, concentrațiile lor nu ating niveluri foarte ridicate, iar receptorii trebuie să aibă apoi afinități ridicate pentru a reacționa la aceste concentrații mici. Această afinitate ridicată încetinește disocierea neuropeptidei de receptorul său și contribuie, de asemenea, la efectele persistente ale acestor molecule.
14.8 Oxidul nitric (NO)
Oxidul nitric a atras atenția pe scară largă ca membru fondator al unei noi clase de molecule gazoase mesager. NO este molecula activă pe care nitroglicerina sublinguală o produce pentru a crește vasodilatația în ameliorarea anginei pectorale. În prezent sunt recunoscute și alte efecte biologice importante ale NO. De exemplu, în sistemul nervos, NO este important în reglarea fluxului sanguin cerebral, în modularea neurotransmisiei și în toxicitatea asociată cu diverse stări patologice.
14.9 Caracteristici ale NO
Rezumatul proprietăților NO
- Gaz care difuzează liber prin membrane
- Cu o durată de viață scurtă, cu un timp de înjumătățire.viață măsurată în secunde
- Radical liber extrem de reactiv
- Toxic la concentrații mari
NO este un gaz cu durată de viață scurtă care nu trebuie confundat cu gazul anestezic relativ stabil, protoxidul de azot (gazul de râs). NO este de fapt un radical liber și, prin urmare, este un compus foarte reactiv. Unele dintre efectele sale toxice se datorează probabil faptului că NO reacționează cu superoxidul pentru a produce radicalul distructiv peroxinitrat. NO este considerat un neurotransmițător neconvențional, deoarece nu este eliberat prin exocitoză și acțiunea sa nu are loc prin intermediul moleculelor receptoare convenționale.
Cum s-a menționat anterior, descrierea tipică a comunicării neuronale consideră că transmiterea este unidirecțională. Se eliberează un neurotransmițător presinaptic care produce modificări la nivelul neuronului postsinaptic. Mai mulți compuși (cum ar fi neuropeptidele și NO) produși în neuronii postsinaptici difuzează în mediul local și afectează celulele din jur. Deoarece NO este un gaz liber difuzabil, acesta are potențialul de a se deplasa rapid în orice direcție de la punctul său de producție. De exemplu, dacă este produs într-o celulă postsinaptică din cauza stimulării receptorilor de glutamat, NO ar putea fi eliberat în mediul local și ar putea trimite un semnal înapoi la neuronul presinaptic (figura 14.5). Acest tip de activitate este denumit semnalizare retrogradă, deoarece semnalul călătorește într-o direcție retrogradă de la neuronul postsinaptic la cel presinaptic.
Figura 14.5
Figura 14.6
Figurile 14.5, 14.6 și 14.7 rezumă principalele aspecte ale sintezei NO. În acest exemplu, glutamatul este eliberat de terminalul presinaptic care se leagă de receptorii NMDA de pe membrana postsinaptică, determinându-i să se deschidă și permițând afluxul de Ca2+. Ca2+ activează calmodulina care se leagă și activează enzima oxid nitric sintetază (NOS). Folosind arginina ca substrat, NOS produce NO și un al doilea produs de reacție, citrulina. NO este apoi liber să se difuzeze în mediul înconjurător și să interacționeze cu terminalul presinaptic care a eliberat inițial glutamatul sau cu orice altă celulă din mediul local. Recunoașteți că orice proces care crește Ca2+ intracelular va activa potențial NOS. Activarea de către glutamat a receptorilor NMDA este doar un exemplu bine documentat.
Figura 14.7
14.10 Sinteza prin sinteza oxidului de azot (NOS) și eliberarea
NO este produs de enzima oxid de azot sinteză (NOS). Această enzimă se găsește într-o subpopulație de neuroni (1-2% din neuronii din cortex) și se găsește în majoritatea celulelor endoteliale. Cel puțin o formă de NOS din aceste celule este dependentă de calciu și de calmodulină pentru activare, așa cum este indicat în figurile 14.5, 14.6 și 14.7. De asemenea, conține cofactori similari cu citocromul P-450. Acești cofactori sunt NADPH (nicotinamidă adenină dinucleotidă fosfat, FAD (flavin adenină mononucleotidă) și FMN (flavin mononucleotidă). Acești cofactori sunt esențiali pentru transferul de electroni care produce produsul instabil și de scurtă durată NO. Substratul în această reacție este aminoacidul comun arginina, iar produsele sunt citrulina și NO (figura 14.5). Din cauza duratei scurte de viață a NO, acesta este extraordinar de dificil de măsurat în mod direct. Cu toate acestea, în preparatele experimentale, există o corelație excelentă între aplicarea de NMDA, care crește Ca2+ intraneuronal și activează NOS, și producerea produsului suplimentar al activității enzimatice a NOS, citrulina (a se vedea figura 14.8). Producția de citrulină este un indicator fiabil al producției de NO. De asemenea, este posibil să se blocheze producția de citrulină (și de NO) prin hrănirea celulelor cu substratul nemetabolizabil pentru NOS denumit metilarginină (figura 14.8).9), iar astfel de compuși au fost utilizați pentru a reduce producția de NO și a pune capăt efectelor sale biologice.
|
Figura 14.8 |
Figura 14.9 |
14.11 „Receptorii” pentru NO
Figura 14.10
Una dintre principalele ținte pentru NO pare a fi enzima guanililciclază. Această descoperire a fost făcută indirect prin monitorizarea acumulării citrulinei, produs al NOS, în timp ce se monitoriza, de asemenea, producția de GMPc, produs al enzimei guanilililciclază (figurile 14.8 și 14.9). În acest experiment, NMDA a fost adăugat la un preparat neuronal pentru a activa NOS. NOS utilizează arginina ca substrat pentru a produce NO și, după cum s-a menționat, dacă în sistem se adaugă un analog nehidroizolabil, cum ar fi metil-arginina, s-a constatat că acumularea de citrulină și cGMP se termină în același mod dependent de doză. Aceste corelații puternice au dus la descoperirea faptului că guanililciclaza este o țintă principală a NO.
Guanylyl-ciclaza este o enzimă neobișnuită deoarece are un inel hem cu o moleculă de fier asociată ca parte a structurii sale. NO activează această enzimă prin legarea la fierul din heme, inițiind producerea de GMP ciclic din GTP (figura 14.10) prin modificări conformaționale în enzimă. cGMP activează apoi o proteină kinază dependentă de cGMP și alte enzime descrise mai jos. Spectrul de efecte produse de activarea proteinei kinazei dependente de cGMP abia acum începe să fie înțeles.
14.12 Efecte biologice ale NO
NO produce o mare varietate de efecte biologice. Din nefericire, suntem deosebit de ignoranți în ceea ce privește rolul NO în modularea proceselor celulare din sistemul nervos. Rolul NO în reglarea vasculaturii este bine documentat și se pare că joacă un rol la fel de important în sistemul nervos.
14.13 Vasodilatator
Figura 14.11
Click aici pentru a vedea o vedere mărită a acestei imagini.
În condiții normale, NO contribuie la controlul fluxului sanguin prin cerebrovasculatură. Un mecanism de feedback rapid există în mod necesar pentru a aproviziona zonele mai active ale creierului cu substanțele nutritive necesare. Acest mecanism este necesar din cauza rezervei slabe de rezerve de energie a creierului. NO este produs în neuronii care conțin NOS și care sunt supuși unei activități susținute. Aceste condiții favorizează activarea receptorilor NMDA, despre care se știe că determină producerea de NO. NO difuzează din aceste zone localizate de activitate neuronală ridicată către microvasculatura înconjurătoare (figura 14.11), provocând vasodilatație și creșterea fluxului sanguin.
Deși mecanismele exacte prin care NO produce vasodilatație nu sunt încă definite, se știe că activarea proteinkinazei dependente de cGMP în celulele musculare netede determină o relaxare a vaselor. Având în vedere că una dintre principalele ținte ale NO este guanililciclaza (care produce cGMP și activează proteina kinaza dependentă de cGMP), se presupune că o cale majoră pentru acțiunile vasodilatatoare ale NO este prin intermediul proteinei kinaza dependentă de cGMP. Activarea acestei kinaze conduce indirect la scăderea nivelurilor de Ca2+ în celulele musculare netede și, ulterior, la defosforilarea aparatului contractil de miozină, care determină relaxarea (figura 14.12). În celulele musculare netede, NO pare, de asemenea, să hiperpolarizeze în mod direct celulele, posibil prin activarea canalelor K+, ceea ce duce la închiderea secundară a canalelor Ca2+ care produce, de asemenea, relaxarea musculară. În concluzie, una dintre principalele funcții ale NO pare a fi integrarea nivelului de activitate neuronală cu modificările locale ale fluxului sanguin cerebral pentru a menține o perfuzie adecvată a țesutului metabolic activ.
Figura 14.12
14.14 Neuromodulator
Se consideră, de asemenea, că NO acționează ca un mesager difuzabil local. El este produs de orice acțiune care ridică Ca2+ în celulele care conțin NOS, cum ar fi stimularea glutamatului de către receptorii NMDA. Prin activarea ulterioară a guanilililciclazei și producerea de cGMP, producția de NO influențează o varietate de procese secundare. Acestea includ modularea directă a canalelor ionice, stimularea proteinei kinazei dependente de cGMP și atât reglarea în sus sau în jos a cAMP-fosfodiesterazei. Efectele în aval sunt apoi numeroase și includ reglarea în sus și în jos a canalelor de Ca2+, creșterea excitabilității (crește rata de ardere neuronală), creșterea sau scăderea eliberării de neurotransmițători și modificări ale morfologiei neuronale.
14.15 Toxicitate
NO în exces este toxic pentru celule. Cu toate acestea, există un paradox pentru toxicitatea NO. Celulele care produc niveluri ridicate de NO sunt rezistente la efectele sale toxice. De exemplu, toxicitatea NO este folosită de către macrofage și neutrofile ca mecanism pentru a distruge celulele tumorale și bacteriile. Cu toate acestea, niciunul dintre tipurile de celule care produc NO nu este susceptibil la efectele sale dăunătoare. Această constatare este valabilă și pentru neuronii din sistemul nervos central. Excesul de glutamat induce neurotoxicitate în creier și se crede că este cauza principală a morții neuronale în boli precum Huntington sau Alzheimer sau după un accident vascular cerebral acut sau o traumă. Se crede că producția excesivă de NO joacă un anumit rol în această pierdere neuronală din cauza toxicității sale atunci când este produsă în exces. Este interesant faptul că celulele care se colorează pozitiv pentru enzima NOS sunt cruțate în zonele degenerate ale creierului afectate de aceste boli. Rezistența acestor celule pare să fie similară cu rezistența celulelor imune descrise mai sus.
Testă-ți cunoștințele
- Întrebare 1
- A
- B
- C
- D
- E
Neuropeptidele sunt prezente în terminalele sinaptice deoarece sunt:
A. Sintetizate în terminal.
B. Transportate prin transport axonal rapid
C. Transportat prin difuzie
D. Transportat prin transport axonal lent
E. Preluate din spațiul extracelular
Neuropeptidele sunt prezente în terminalele sinaptice deoarece sunt:
A. Sintetizate în terminal. Acest răspuns este INCORECT.
Mașina de sinteză necesară pentru sinteza peptidelor și proteinelor nu se găsește în terminalul axonului.B. Transportate prin transport axonal rapid
C. Transportat prin difuzie
D. Transportat prin transport axonal lent
E. Preluate din spațiul extracelular
Neuropeptidele sunt prezente în terminalele sinaptice deoarece sunt:
A. Sintetizate în terminal.
B. Transportate prin transport axonal rapid Acest răspuns este CORECT!
Neuropeptidele sunt sintetizate în corpul celular și sunt procesate în vezicule care sunt transportate la terminalele axonale de-a lungul microtubulilor prin transport axonal rapid.C. Transportate prin difuzie
D. Transportate prin transport axonal lent
E. Preluate din spațiul extracelular
Neuropeptidele sunt prezente în terminalele sinaptice deoarece sunt:
A. Sintetizate în terminal.
B. Transportate prin transport axonal rapid
C. Transportat prin difuzie Acest răspuns este INCORECT.
De asemenea, difuzia este un mecanism excelent pentru deplasarea moleculelor pe distanțe scurte (câțiva microni), dar este ineficient pentru deplasarea moleculelor pe distanțe care separă de obicei soma neuronală de terminalele axonale.D. Transportat prin transport axonal lent
E. Preluate din spațiul extracelular
Neuropeptidele sunt prezente în terminalele sinaptice deoarece sunt:
A. Sintetizate în terminal.
B. Transportate prin transport axonal rapid
C. Transportat prin difuzie
D. Transportate prin transport axonal lent Acest răspuns este INCORECT.
De asemenea, este importantă refacerea cât mai rapidă a rezervei de neuropeptide la terminale. În acest caz, mai repede este mai bine.E. Preluate din spațiul extracelular
Neuropeptidele sunt prezente în terminalele sinaptice deoarece sunt:
A. Sintetizate în terminal.
B. Transportate prin transport axonal rapid
C. Transportat prin difuzie
D. Transportat prin transport axonal lent
E. Preluate din spațiul extracelular Acest răspuns este INCORECT.
Nu se cunoaște niciun mecanism de preluare care să elimine neuropeptidele din spațiul extracelular. Mecanismul lor de acțiune se termină prin difuzie și prin degradare enzimatică de către proteaze extracelulare.
- Întrebare 2
- A
- B
- C
- D
- E
Oxidul nitric:
A. Are o durată de viață lungă
B. Este permeabil la membrană.
C. Este nereactivă
D. Este cunoscut și sub denumirea de gaz de râs.
E. Este netoxic pentru celule.
Oxidul nitric:
A. Are un timp de viață lung Acest răspuns este INCORECT.
NO are un timp de înjumătățire măsurat în secunde și este foarte instabil.B. Este permeabil la membrană.
C. Este nereactiv
D. Este cunoscut și sub numele de gaz de râs.
E. Este netoxic pentru celule.
Oxidul nitric:
A. Are o durată de viață lungă
B. Este permeabil la membrană. Acest răspuns este CORECT!
NO este liber permeabil la membrane și afectează toate celulele pe o anumită rază de la punctul său de producere.C. Este nereactiv
D. Este cunoscut și sub numele de gaz de râs.
E. Este netoxic pentru celule.
Oxidul nitric:
A. Are o durată de viață lungă
B. Este permeabil la membrană.
C. Este non-reactiv Acest răspuns este INCORECT.
NO este un radical liber foarte reactiv. Acesta va reacționa cu proteinele, lipidele și acidul nucleic și are o afinitate deosebit de mare pentru metale reduse (cum ar fi Fe2+ în grupul heme al guanilililciclazei).D. Este cunoscut și sub numele de gaz de râs.
E. Nu este toxic pentru celule.
Oxidul nitric:
A. Are o durată de viață lungă
B. Este permeabil la membrană.
C. Este nereactivă
D. Este cunoscut și sub numele de gaz de râs. Acest răspuns este INCORECT.
Gazul de râs este protoxidul de azot și nu oxidul nitric. Nu este reactiv și nu este toxic, dar afectează proprietățile membranelor.E. Este netoxic pentru celule.
Oxidul nitric:
A. Are o durată de viață lungă
B. Este permeabil la membrană.
C. Este nereactivă
D. Este cunoscut și sub denumirea de gaz de râs.
E. Este netoxic pentru celule. Acest răspuns este INCORECT.
NO este foarte toxic pentru celule atunci când este produs în exces. De fapt, se crede că supraproducția de NO provoacă anumite boli neurodegenerative. NO este, de asemenea, produs de către macrofage ca produs toxic pentru a ucide bacteriile invadatoare.