Elementul chimic hidrogen este clasificat ca nemetal. Acesta poate deveni metalic la presiuni foarte mari. A fost descoperit în 1766 de Henry Cavendish.

Zona de date
| Clasificare | Hidrogenul este un nemetal. El poate deveni metalic la presiuni foarte mari. |
| Culoarea | incolor |
| Greutate atomică | 1.0079 |
| Stare | gazoasă |
| Punct de topire | -259,14 oC, 14,01 K |
| Punct de fierbere | -252,87 oC, 20.28 K |
| Electroni: | 1 |
| Protoni: | 1 |
| Neutroni în izotopul cel mai abundent: | 0 |
| Învelișuri de electroni | 1 |
| Configurația electronilor | 1s1 |
| Densitate la 20oC | 0.0000899 g/cm3 |
Afișați mai multe, inclusiv: Călduri, Energii, Oxidare,
Reacții, Compuși, Radiații, Conductivități
| Volumul atomic | 14.4 cm3/mol | |
| Structură | hcp: hexagonal strâns împachetat (ca solid la temperaturi joase) | |
| Duritate | – | |
| Capacitate termică specifică | 14.304 J g-1 K-1 | |
| Căldura de fuziune | 0,117 kJ mol-1 de H2 | |
| Căldura de atomizare | 218 kJ mol-1 | |
| Căldura de vaporizare | 0.904 kJ mol-1 al H2 | |
| 1-a energie de ionizare | 1312 kJ mol-1 | |
| 2-a energie de ionizare | kJ mol-1 | |
| 3-a energie de ionizare | 11815.0 kJ mol-1 | |
| Afinitatea electronilor | 72.7711 kJ mol-1 | |
| Numărul minim de oxidare | -1 | |
| Numărul minim de oxidare comună | -1 | |
| Numărul maxim de oxidare comună | 1 | |
| Numărul maxim de oxidare comună | 1 | |
| Numărul maxim de oxidare comună. | 1 | |
| Electronegativitate (scara Pauling) | 2,18 | |
| Volum de polarizabilitate | 0.7 Å3 | |
| Reacția cu aerul | viguroasă, ⇒ H2O | |
| Reacție cu HNO3 15 M | niciuna | |
| Reacție cu HCl 6 M | niciuna | |
| Reacția cu 6 M NaOH | niciuna | |
| Oxid(s) | H2O | |
| Hidrură(s) | H2 | |
| Clorură(s) | HCl | |
| Rază atomică | 25 pm | |
| Rază ionică (1+ ion) | – | |
| Rază ionică (ion 2+) | – | |
| Rază ionică (ion 3+) | – | |
| Raza ionică (1- ion) | – | |
| Raza ionică (2- ion) | – | |
| Raza ionică (3- ion) | – | |
| Conductivitatea termică | 0.1805 W m-1 K-1 | |
| Conductivitate electrică | – | |
| Punctul de congelare/topire: | -259,14 oC, 14,01 K |

Imagine NASA: Cantități uriașe de hidrogen în galaxii îndepărtate.

Theophrastus Paracelsus – Prima persoană care a generat hidrogenul: „Aerul se ridică și izbucnește ca un vânt.”
Descoperirea hidrogenului
Un experiment de chimie preferat în școală este adăugarea unui metal, cum ar fi magneziul, la un acid. Metalul reacționează cu acidul, formând o sare și eliberează hidrogen din acid. Hidrogenul gazos bolborosește din lichid și elevii îl colectează în cantități mici pentru experimente ulterioare, cum ar fi „pop-testul.”
Primul caz înregistrat de hidrogen obținut prin acțiunea umană a fost în prima jumătate a anilor 1500, printr-o metodă similară cu cea folosită acum în școli.Theophrastus Paracelsus, un medic, a dizolvat fier în acid sulfuric și a observat eliberarea unui gaz. Se spune că el ar fi spus despre acest experiment: „Aerul se ridică și izbucnește ca un vânt”. Cu toate acestea, el nu a descoperit niciuna dintre proprietățile hidrogenului.(1)
Turquet De Mayerne a repetat experimentul lui Paracelsus în 1650 și a constatat că gazul era inflamabil.(2) Nici Paracelsus, nici De Mayerne nu au propus că hidrogenul ar putea fi un element nou. Într-adevăr, Paracelsus credea că existau doar trei elemente – tria prima – sarea, sulful și mercurul – și că toate celelalte substanțe erau alcătuite din diferite combinații ale acestor trei elemente. (3) (Chimia avea încă un drum lung de parcurs!)
În 1670, omul de știință englez Robert Boyle a adăugat fier în acid sulfuric. El a arătat că gazul (hidrogenul) rezultat ardea numai dacă era prezent aerul și că o fracțiune din aer (pe care acum l-am numi oxigen) era consumată de ardere.(4)
Hidrogenul a fost recunoscut pentru prima dată ca element distinct în 1766 de către omul de știință englez Henry Cavendish, când l-a preparat prin reacția acidului clorhidric cu zinc. El a descris hidrogenul ca fiind „aerul inflamabil provenit din metale” și a stabilit că este același material (prin reacțiile sale și prin densitatea sa), indiferent de metalul și de acidul pe care le-a folosit pentru a-l produce(1).(1) Cavendish a observat, de asemenea, că atunci când substanța era arsă, producea apă.
Savantul francez Antoine Lavoisier a denumit ulterior elementul hidrogen (1783). Numele provine din grecescul „hydro” care înseamnă apă și „genes” care înseamnă formare – hidrogenul este unul dintre cele două elemente care formează apa.
În 1806, cu hidrogenul bine stabilit ca element, chimistul englez Humphry Davy a împins un curent electric puternic prin apă purificată.
El a constatat că se formează hidrogen și oxigen. Experimentul a demonstrat că electricitatea poate separa substanțele în elementele lor constitutive. Davy și-a dat seama că substanțele erau legate între ele printr-un fenomen electric; el descoperise adevărata natură a legăturii chimice.(5)
Vizitați pagina Chemicool’s Cool Hydrogen Facts Page.

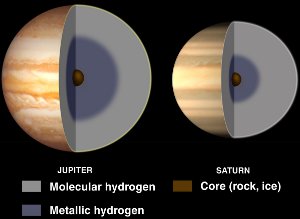
Interioarele lui Jupiter și Saturn, cu hidrogen metalic lichid. Prin amabilitatea NASA/JPL-Caltech.

Nasa: Rezervorul extern de combustibil al navetei spațiale (portocaliu) umplut cu hidrogen lichid și oxigen.

Autoturismele cu hidrogen emit apă în loc de poluanți.

Electroliza apei în laborator. Energia electrică este folosită pentru a diviza apa. Hidrogenul se adună într-o eprubetă, oxigenul în cealaltă.
Aparență și caracteristici
Efecte nocive:
Hidrogenul este foarte inflamabil și are o flacără aproape invizibilă, ceea ce poate duce la arsuri accidentale.
Caracteristici:
Hidrogenul este cel mai simplu element dintre toate și cel mai ușor. Este, de asemenea, de departe cel mai comun element din Univers. Peste 90 la sută din atomii din Univers sunt hidrogen.
În forma sa cea mai comună, atomul de hidrogen este format dintr-un proton, un electron și niciun neutron. Hidrogenul este singurul element care poate exista fără neutroni.
Hidrogenul este un gaz incolor, inodor, care există, la temperatura și presiunea standard, sub formă de molecule diatomice, H2.
Arde și formează amestecuri explozive în aer și reacționează violent cu oxidanții.
Pe Pământ, cea mai mare localizare a hidrogenului este în apă, H2O. Există puțin hidrogen liber pe Pământ, deoarece hidrogenul este atât de ușor încât nu este reținut de gravitația planetei. Orice hidrogen care se formează scapă în cele din urmă din atmosferă în spațiu.
Deși hidrogenul este de obicei un nemetal, el devine un metal lichid atunci când i se aplică presiuni enorme.
Astfel de presiuni se găsesc în interiorul planetelor gigantice gazoase, cum ar fi Jupiter și Saturn. Se crede că marele câmp magnetic al lui Jupiter (de 14 ori mai mare decât cel al Pământului) este cauzat de un efect dinamovist care rezultă din hidrogenul metalic conducător de electricitate care circulă pe măsură ce planeta se rotește.
Utilizări ale hidrogenului
Cantități mari de hidrogen sunt folosite în procesul Haber (producerea amoniacului), hidrogenarea grăsimilor și uleiurilor, producerea de metanol, hidrocracare și hidrodesulfurare. Hidrogenul este, de asemenea, utilizat în rafinarea metalelor.
Hidrogenul lichid este utilizat ca și combustibil pentru rachete, de exemplu pentru a alimenta decolarea și ascensiunea pe orbită a navetei spațiale. Hidrogenul lichid și oxigenul sunt ținute în rezervorul mare și extern de combustibil al navetei. (A se vedea imaginea din stânga.)
Cei doi izotopi mai grei ai hidrogenului (deuteriul și tritiul) sunt utilizați în fuziunea nucleară.
Economia bazată pe hidrogen a fost propusă ca înlocuitor pentru economia noastră actuală bazată pe hidrocarburi (petrol, gaz și cărbune).
La baza economiei bazate pe hidrogen stă faptul că energia este produsă atunci când hidrogenul intră în combustie cu oxigenul, iar singurul produs secundar al reacției este apa.
În prezent, însă, hidrogenul pentru mașinile alimentate cu hidrogen este produs din hidrocarburi. Abia atunci când energia solară sau eoliană, de exemplu, va putea fi folosită în mod comercial pentru a descompune apa în hidrogen și oxigen, va fi posibilă o adevărată economie a hidrogenului.
Abundanță și izotopi
Abundanță scoarța terestră: 1400 părți pe milion în greutate (0,14%), 2,9% în moli
Abundanță sistemul solar: 75% în greutate, 93% în moli
Cost, pur: 12 dolari pe 100g
Cost, vrac: 100 dolari pe 100g
Sursa:
Sursa: Hidrogenul se prepară în comerț prin reacția aburului supraîncălzit cu metan sau carbon. În laborator, hidrogenul poate fi produs prin acțiunea acizilor asupra metalelor, cum ar fi zincul sau magneziul, sau prin electroliza apei (ilustrat în stânga).
Izotopi: Hidrogenul are trei izotopi, 1H (protium), 2H (deuteriu) și 3H (tritium). Cei doi izotopi mai grei ai săi (deuteriu și tritiu) sunt folosiți pentru fuziunea nucleară. Protiul este cel mai abundent izotop, iar tritiul este cel mai puțin abundent. Tritiul este instabil, cu un timp de înjumătățire de aproximativ 12 ani și 4 luni. Hidrogenul natural este un amestec al celor doi izotopi 1H și 2H, cu o abundență naturală de 99,99% și, respectiv, 0,01%.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet., (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen (Chimia și fabricarea hidrogenului), (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s „The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Citează această pagină
Pentru o legătură online, vă rugăm să copiați și să lipiți una dintre următoarele:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
sau
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să folosiți următoarea citare conform MLA:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.
.