Diferența principală – Tensiunea sterică vs tensiunea de torsiune
Tensiunea este repulsia dintre electronii de legătură ai unei molecule. Aranjamentul unei molecule depinde de tensiune, deoarece perechile de electroni de legătură sunt aranjate într-un mod care minimizează tensiunea. Există trei tipuri principale de tensiuni care pot fi găsite într-o moleculă. Acestea sunt tulpina unghiulară, tulpina torsională și tulpina sterică. Tensiunea unghiulară apare atunci când unghiurile de legătură ale moleculelor reale sunt diferite de cele ale moleculelor ideale. Tensiunea de torsiune apare atunci când o moleculă este rotită în jurul unei legături. Tensiunea sterică se formează atunci când două sau mai multe grupuri voluminoase se apropie una de cealaltă. Principala diferență între tulpina sterică și cea de torsiune este că tulpina sterică nu poate fi diminuată prin rotirea moleculei în jurul unei legături, în timp ce tulpina de torsiune poate fi diminuată prin rotirea moleculei în jurul unei legături.
Domenii cheie abordate
1. Ce este deformarea sterică
– Definiție, explicație cu exemple
2. Ce este deformarea torsională
– Definiție, explicație cu exemple
3. Care este diferența dintre deformarea sterică și deformarea torsională
– Comparație a principalelor diferențe
Termeni cheie: Deformație unghiulară, pereche de electroni de legătură, deformație sterică, deformație torsională

Ce este deformația sterică
Deformația sterică este repulsia dintre doi atomi sau grupuri de atomi atunci când distanța dintre ei este micșorată. Aceasta se mai numește și impediment steric. Tensiunea sterică este foarte importantă în determinarea aranjamentului unei molecule, deoarece fiecare moleculă este aranjată în așa fel încât tensiunea sterică să fie minimizată. Atunci când tensiunea sterică este minimizată, energia potențială a moleculei respective este redusă. Deoarece materia este stabilă atunci când are un nivel de energie mai mic, nivelul de energie mai mic al unei molecule o face o moleculă stabilă.
Conceptul de tensiune sterică este foarte important în predicția produselor unei reacții chimice. Acest lucru se datorează faptului că grupurile de atomi sunt atașate de un atom de carbon în așa fel încât obstacolul steric să fie minimizat. Prin urmare, o reacție chimică va da un amestec de molecule în care sunt incluși produși stabili și produși instabili. Dar constituentul majoritar al acestui amestec va fi întotdeauna produsul stabil cu un obstacol steric minimizat.

Figura 1: Tensiunea sterică în compușii organici
După cum se arată în imaginea de mai sus, energia potențială a unei molecule este crescută în funcție de tensiunea sterică pe care o au. Atunci când distanța dintre două grupări metil este micșorată, energia potențială este crescută.
Figura 2: Tensiunea sterică crește atunci când sunt prezente grupări voluminoase
În imaginea de mai sus se observă că tensiunea sterică este crescută atunci când sunt prezente grupări voluminoase. Moleculele mai îngreunate steric au o energie potențială mai mare în comparație cu moleculele mai puțin îngreunate steric. Prin urmare, moleculele mai puțin îngreunate steric sunt mai stabile.
Ce este tensiunea torsională
Tensiunea torsională este repulsia care apare între atomi sau grupuri de atomi atunci când o moleculă este rotită în jurul unei legături sigma. Aceasta este repulsia care poate fi observată atunci când electronii legăturii trec unul pe lângă celălalt. Acest tip de tensiune este important în determinarea conformațiilor stabile ale compușilor organici. Aceste conformații pot fi reprezentate prin proiecții Newman. Proiecția Newman a unei molecule este conformația acelei molecule atunci când este privită prin legătura C-C din direcția față-spate.
Torsiunea de torsiune apare atunci când unghiul diedru al grupărilor voluminoase este mic. Unghiul diedru este unghiul dintre două legături a doi atomi de carbon diferiți într-o proiecție Newman. Dacă unghiul diedru este mare, atunci tensiunea de torsiune este scăzută.
Proiecțiile Newman pot fi întâlnite în două tipuri ca fiind conformație eșalonată și conformație eclipsată. Conformația eclipsată prezintă o deformație torsională mai mare decât cea a conformației eșalonate.
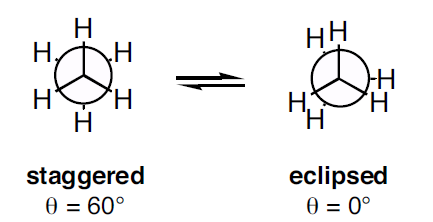
Figura 3: Două tipuri de proiecție Newman
După cum se arată în imaginea de mai sus, conformația eșalonată prezintă un unghi diedru de 60o și conformația eclipsată prezintă un unghi diedru de 0o. Dar atunci când molecula este rotită, conformația se modifică. Tensiunea de torsiune în conformația eșalonată este mai mică decât cea a conformației eclipsate. Atunci când molecula este rotită, conformația eclipsată poate deveni conformația eșalonată; astfel, tensiunea de torsiune este redusă.
Diferența dintre tensiunea sterică și tensiunea de torsiune
Definiție
Contracție sterică: Deformația sterică este repulsia dintre doi atomi sau grupuri de atomi atunci când distanța dintre ei este redusă.
Deformația torsională: Deformația torsională este repulsia care apare între atomi sau grupuri de atomi atunci când o moleculă este rotită în jurul unei legături sigma.
Rotația moleculei
Deformația sterică: Tensiunea sterică nu poate fi diminuată prin rotirea moleculei în jurul unei legături sigma.
Torsiune: Tensiunea torsională poate fi diminuată prin rotirea moleculei în jurul unei legături sigma.
Cauza tensiunii
Tensiunea sterică: Deformația sterică apare atunci când distanța dintre grupele voluminoase ale unei molecule este redusă.
Deformația torsională: Tensiunea torsională apare atunci când electronii de legătură trec unul pe lângă celălalt atunci când molecula se rotește.
Concluzie
Tensiunea unei molecule este repulsia dintre electronii de legătură sau perechile de electroni solitari prezente în molecula respectivă. Această repulsie face ca energia potențială a unei molecule să fie crescută. Apoi, ea face ca molecula să fie instabilă. Tensiunea sterică a unei molecule este determinată de grupurile voluminoase prezente în moleculă și de distanța dintre aceste grupuri voluminoase. Proiecția Newman este o structură simplă care arată dispunerea atomilor sau a grupurilor de atomi într-o moleculă organică. Ea poate fi utilizată pentru a determina tensiunea de torsiune a unei molecule. Principala diferență între tulpina sterică și cea torsională este că tulpina sterică nu poate fi diminuată prin rotirea moleculei în jurul unei legături, în timp ce tulpina torsională poate fi diminuată prin rotirea moleculei în jurul unei legături.
1. „Tensiune torsională”. OChemPal, disponibil aici. Accesat la 28 aug. 2017.
2. „Strain (Chemistry)”. Wikipedia, Wikimedia Foundation, 25 iulie 2017, Disponibil aici. Accesat la 28 aug. 2017.
3. „Dihedral Angle”. OChemPal, Disponibil aici. Accesat la 28 aug. 2017.
Imagine din curtoazie:
1. „Napthalene phenanthraene methyl-methyl strai” By DMacks – Own work (Public Domain) via Commons Wikimedia
2. „Steric hindrance disp” By Mwolf37 – Own work (CC BY-SA 3.0) via Commons Wikimedia
3. „Escalonada e eclipsada” By Pauloquimico – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]() .
.