INTRODUCERE
Amiloidoza este o boală de depunere cauzată de acumularea extracelulară de fibrile a căror sursă constă în proteine cu o structură instabilă care se pliază, se agregă și suferă depuneri.1 O astfel de depunere poate altera structura tisulară și poate afecta funcția diferitelor organe și sisteme.2
Fibrilele de amiloid sunt insolubile și rezistente la proteoliză și sunt de obicei colorate cu roșu Congo, prezentând o birefringență galben-verde intensă în lumină polarizată.3 Mai mult de 30 de proteine pot provoca depuneri amiloide, dar numai 5 determină depuneri semnificative în țesutul cardiac1:
- –
Catenile ușoare, care determină amiloidoza primară (AL).
- –
Transthyretin (TTR), care determină amiloidoza TTR (ATTR).
- –
Apolipoproteina A.
- –
Fibrinogen.
- –
Proteina amiloidă A din serum, care produce amiloidoza secundară.
Amiloidoza primară și ATTR sunt cele mai frecvente forme de amiloidoză cardiacă, forma AL fiind considerată, din punct de vedere istoric, mai frecventă în țările dezvoltate.3
Cele mai multe informații despre amiloidoza cardiacă s-au bazat pe AL. Cu toate acestea, deși numărul pacienților cu AL a rămas stabil, numărul de diagnostice de ATTR a crescut recent și se crede acum că ATTR ar putea fi mult mai răspândită decât AL.2
Amiloidoza cu transtiretină a fost foarte des subiectul unor diagnostice greșite sau al unor întârzieri semnificative până la diagnosticarea corectă a acesteia. Printre motive se numără eterogenitatea formelor sale, necesitatea confirmării histologice, lipsa echipamentului specializat și credința eronată a unor cardiologi că este o boală rară, fără opțiuni de tratament.2,3
Cu toate acestea, aceste aspecte sunt în curs de schimbare. Diagnosticul are implicații pentru managementul pacientului. Au fost dezvoltate terapii specifice care pot întârzia sau stabiliza depunerea și care sunt mai eficiente în stadiile incipiente. Prin urmare, diagnosticul precoce este crucial. Această trecere în revistă descrie progresele recente semnificative în diagnosticul și tratamentul ATTR, oferind speranță pentru pacienții cu această afecțiune.
AMILOIDOZA CARDIACĂ DE TRANSTRETINĂ
Transtretina este o proteină plasmatică tetramerică responsabilă de transportul tiroxinei și al proteinelor legate de retinol. Este sintetizată în principal în ficat și în mod secundar în plexul coroid și în epiteliul pigmentar al retinei.4
Transtreatina tinde să se disocieze în dimeri și monomeri, care se asamblează greșit în fibrile și suferă depuneri. Mutațiile punctiforme sau efectul vârstei pot crește această tendință, dând naștere la cele 2 forme clinice de ATTR: mutantă (ATTRm) și de tip sălbatic (ATTRwt).
AMILOIDOZA TRANSTRETINĂ MUTANTĂ
În prezent sunt cunoscute peste 120 de mutații care cauzează ATTRm. Aceste mutații prezintă un model de moștenire autosomal dominant, cu penetranță variabilă.4 Din cauza diversității sale geografice largi, este dificil de stabilit prevalența ATTR, dar este considerată a fi o boală rară, cu o prevalență mai mică de 1/100 000 de locuitori2 (Tabelul 1).
Principalele caracteristici clinice și de diagnostic ale bolii mutante și sălbatice.Type Transthyretin Cardiac Amyloidosis
| ATTRwt | ATTRm | ||
|---|---|---|---|
| Prevalență | Nu se cunoaște. Aparent foarte frecvent | ||
| Studiu genetic | Absența mutațiilor în TTR | Mutații în TTR | |
| Vârsta tipică la prezentare | > 60 de ani | Variabil în funcție de mutația cauzală | |
| Sexul | Predomină sexul masculin. 80% pacienți | Predomină sexul masculin, cu fenotip mai agresiv | |
| Manifestări extracardiacale | – Sindromul tunelului carpian (33%-49%) – Stenoza spinării lombare – Ruptura traumatică a tendonului bicepsului (32%) |
– Polineuropatia senzitivo-motorie bilaterală ascendentă – Disautonomie: hipotensiune ortostatică, diaree-constipație, disfuncție erectilă – Afectare oculară: glaucom, depunere intravitreană, pupilele solzoase |
|
| Afectare cardiacă | Constantă | Variabilă în funcție de mutația cauzală | |
| Dezvoltarea cardiacă | – Insuficiență cardiacă (53%-86%) – Tulburări de conducere – FA (43%-67%) – AoS degenerativă |
– Tulburări de conducere – Insuficiență cardiacă – FA infreventă (10%) |
|
| Tehnici de diagnostic | |||
| ECG | – Model de pseudoinfarct (63%-66%) – Tensiune joasă (22%-33%) – Sokolow LVH (6%-13%) |
– Model pseudoinfarct (18%-69%) – Tensiune joasă (2%-25%) – Sokolow LVH (3%-8%) |
|
| ECHO | – Hipertrofie moderată-severă – FEVS deprimată ușoară-moderată (30%) |
– Hipertrofie moderată – FEVS, tipic conservată |
|
| RMN cardiac | – Consolidare tardivă – T1 și EV native ridicate |
||
| Scintigrafie cu 99mTc DPD | – Grad 2-3 | – Grad 0: purtători asimptomatici – Grad 1: afectare cardiacă inițială – Grad 2-3: implicare cardiacă semnificativă |
|
AF, fibrilație atrială; AoS, stenoză aortică; ATTRm, amiloidoză de transthyretină mutantă; ATTRwt, amiloidoză de transthyretină de tip sălbatic; ECG, electrocardiogramă; ECO, ecocardiogramă; EV, volum extracelular; LVEF, fracție de ejecție ventriculară stângă; LVH, hipertrofie ventriculară stângă; TTR, transthyretină.
Primele mutații TTR au fost raportate ca polineuropatie amiloidă familială (sau boala Andrade) și, în consecință, ATTRm a fost considerată până de curând o boală neurologică. Cu toate acestea, descoperirile recente arată implicarea cardiacă în mai mult de jumătate din cazuri.3
Există o corelație puternică genotip-fenotip, mutațiile fiind asociate cu boala pur neurologică sau cu boala pur cardiacă.3 Cu toate acestea, împărțirea ATTRm în boală cardiacă sau neurologică poate fi o simplificare excesivă, deoarece există o suprapunere considerabilă între cele 2 forme clinice din spectrul bolii.
Mutația Val30Met (cunoscută acum ca Val50Met după ce 20 de poziții au fost adăugate la denumirea tradițională a mutației în ATTRm) este cea mai frecventă mutație la nivel mondial și este endemică în Portugalia, Japonia și Suedia. Incidența sa estimată în Portugalia este de 1 la 538 de locuitori.2 Mallorca (Spania) și Valverde del Camino (Huelva, Spania) sunt, de asemenea, considerate a fi zone în care ATTRm este endemică. Prevalența estimată în Mallorca la pacienții simptomatici este de 3/100 000 de locuitori.5
Mutația Val30Met cauzează o afecțiune predominant neurologică cu polineuropatie senzorio-motorie simetrică, care începe la nivelul membrelor inferioare și urmează un tipar ascendent. Ea poate fi asociată cu disautonomie cu hipotensiune ortostatică, disfuncție erectilă, incontinență urinară și simptome gastrointestinale. Debutează de obicei la sfârșitul celui de-al doilea sau al treilea deceniu de viață, iar până la 43% dintre pacienți au afectare cardiacă, care este o cauză frecventă de deces4 (tabelul 1).
De o relevanță deosebită este mutația Val122Ile (p. Val142Ile), care este prezentă la 3% până la 4% din populația de culoare din America de Nord.3 Deși penetranța sa este incompletă,3 această mutație a fost asociată cu un risc crescut cu 47% de apariție a insuficienței cardiace (IC).6 Un studiu recent a arătat că amiloidoza Val122Ile a fost a patra cea mai frecventă cauză de IC în populația afro-caribiană britanică.7 Deși până la 30% dintre pacienții cu această mutație pot avea caracteristici de neuropatie ușoară,6 fenotipul clinic este de obicei similar cu cel al ATTRwt.4 Val122Ile nu trebuie considerată o mutație exclusivă a populației de culoare, deoarece poate fi prezentă și în populația albă. De exemplu, noi am identificat această mutație în 4 familii spaniole albe fără strămoși de culoare.
AMILOIDOZA DE TRANSIRETINĂ DE TIP SĂLBATIC
Amiloidoza de tip sălbatic cu transthiretină a fost descrisă pentru prima dată în 1876. Anterior se numea amiloidoză senilă, dar diagnosticul său la pacienții cu vârste cuprinse între 40 și 60 de ani a făcut ca acest termen să devină învechit. Interesant este faptul că primul caz cunoscut al acestei mutații a fost descoperit la un pacient american în vârstă de 47 de ani.8
Prevalența exactă a ATTRwt rămâne necunoscută. Cu toate acestea, studiile sugerează că este subdiagnosticată și că ar putea fi cea mai frecventă formă de amiloidoză cardiacă.2,3 Următoarele rezultate susțin această ipoteză:
- –
La pacienții cu vârsta mai mare de 80 de ani, prevalența depunerilor de TTR este de 25% la autopsie.3
- –
La pacienții cu IC cu fracție de ejecție conservată (HFpEF), depunerea moderată-severă de TTR este de 5% la autopsie.9
- –
La pacienții cu vârsta mai mare de 60 de ani internați pentru HFpEF și hipertrofie ventriculară stângă (LVH) ≥ 12mm, grupul nostru a constatat recent o prevalență de 13%.10
În mod diferit de ATTRm, ATTRwt este o boală sporadică care debutează de obicei după vârsta de 70 de ani.4 Este întâlnită în principal la bărbați, iar seriile publicate au raportat rate cuprinse între 89% și 98%.11,12 Cu toate acestea, într-o serie recentă de pacienți diagnosticați cu ATTRwt în 2 spitale (Madrid, Spania și Bologna, Italia), grupul nostru a constatat că 20% erau femei. În plus, alte studii de autopsie au sugerat, de asemenea, că ATTRwt la femei ar putea fi mai răspândită decât s-a raportat anterior. Prin urmare, sexul feminin nu ar trebui să diminueze suspiciunea clinică de ATTRwt (tabelul 1).13
Constatările autopsiei arată că depunerea de TTR este dispersată în diferite organe în ATTRwt. Cu toate acestea, depunerea este mult mai mare în inimă datorită tropismului cardiac al TTR, iar afectarea cardiacă este principala manifestare clinică.4 Pacienții pot prezenta simptome ale depunerii extracardiacale de TTR, cum ar fi stenoza canalului lombar, ruptura atraumatică a tendonului bicepsului sau „semnul Popeye” și sindromul de tunel carpian (CTS)3 (Figura 1). Toate aceste caracteristici pot ajuta la orientarea și stabilirea promptă a diagnosticului. CTS poate însoți alte subtipuri de amiloidoză, dar este mai frecvent în cazul ATTRwt. Depunerea poate preceda manifestările cardiace cu câțiva ani.6 Poate fi folosită ca indicație la pacienții vârstnici cu LVH, mai ales dacă aceștia au CTS bilateral care nu este asociat cu activități profesionale specifice și sunt în clasa funcțională ≥ II a New York Heart Association (date nepublicate).
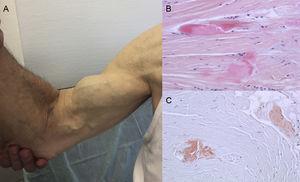
Semne și simptome ale amiloidozei cu transthiretine. A: ruptură netraumatică a tendonului bicepsului drept („semnul Popeye”). B și C: colorație cu hematoxilină-eozină (B) și roșu Congo (C), ambele ×200, a unei probe de ligament carpian care arată fascicule dense de colagen cu material necelular. Prin amabilitatea Dr. Clara Salas Antón.
DIAGNOSTICUL AMILOIDULUI TRANSTRETINIC Prezentare clinică
Amiloidul se poate infiltra în orice structură cardiacă.1 În mod obișnuit, depunerea crește grosimea peretelui ventricular, ceea ce determină o scădere treptată a distensibilității care duce la disfuncție diastolică severă. Prin urmare, ATTR a fost inclusă în mod tradițional ca o cauză de cardiomiopatie restrictivă.
Cu toate acestea, spectrul clinic al ATTR este mult mai larg și mai eterogen. Cel mai frecvent simptom al ATTR este IC. După cum s-a menționat, un studiu publicat de grupul nostru în 2015 a sugerat că un protocol bazat pe scintigrafia cu 99mTc-3,3-difosfono-1,2-propanodicarboxilic (99mTc-DPD) poate fi util pentru diagnosticul ATTRwt într-o proporție semnificativă (13%) de pacienți cu vârsta peste 60 de ani internați pentru HFpEF.10 Pe baza acestui rezultat, scintigrafia cu 99mTc-DPD a fost inclusă în ghidurile europene privind HF din 2016 ca instrument util pentru identificarea pacienților cu ATTR.14 Cu toate acestea, ATTR nu trebuie suspectată exclusiv la pacienții cu HFpEF deoarece, pe măsură ce depunerea de amiloid avansează, funcția contractilă se înrăutățește și, în consecință, ATTR poate fi asociată cu diferite grade de disfuncție sistolică.
Amidiloidoza cu transtretină este o fenopatie a cardiomiopatiei hipertrofice (HCM) și poate fi confundată cu aceasta. Un studiu multicentric francez recent a raportat că 5% dintre pacienții cu HCM au ATTRm.15 Cu toate acestea, rezultatele noastre nu sunt în concordanță cu această rată ridicată, care ar putea fi legată de populația mare de culoare din Franța.
Anomalii de conducere cardiacă pot fi prima manifestare a ATTR. Infiltrarea amiloidă a ganglionilor sinusali și atrioventriculari1 poate indica necesitatea implantării unui stimulator cardiac (tabelul 1). Studiul menționat anterior, efectuat în Spania și Italia, a constatat că tulburările de conducere au fost prima manifestare a ATTRwt la 7% dintre pacienții cu această boală.13
Aritmiile atriale sunt, de asemenea, foarte frecvente la pacienții cu ATTRwt13 (figura 2A), iar prima manifestare a bolii poate fi accidentul vascular cerebral.4 De fapt, grupul Mayo Clinic a sugerat recent că ATTRwt ar trebui să fie exclusă în cadrul unui diagnostic de fibrilație atrială (FA) non-valvulară la pacienții vârstnici.8 În schimb, FA este mult mai puțin frecventă la pacienții cu ATTRm (Tabelul 1).
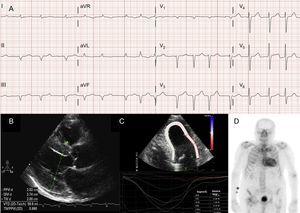
Tehnici de diagnostic în amiloidoza cardiacă cu transthyretină (ATTR). A: Electrocardiograma unui pacient cu amiloidoză transthyretină de tip sălbatic (ATTRwt), care prezintă fibrilație atrială și model pseudoinfarctar în derivațiile inferioare. B: ecocardiograma unui pacient cu amiloidoză transthyretină mutantă cu mutație Val30Met, cu hipertrofie ventriculară stângă concentrică marcată și efuziune pericardică ușoară. C: tulpina regională longitudinală a unui pacient cu ATTRwt, care prezintă valori conservate în segmentul apical și valori deprimate în segmentele bazal și medioventricular. D, scanare cu 99mTc-DPD (99mTc-3,3-difosfono-1,2-propanodicarboxilic) a unui pacient cu ATTRwt, care arată o captare biventriculară superioară captării osoase, corespunzând gradului 3 Perugini.
În final, observăm că ATTR și stenoza aortică degenerativă pot coexista la același pacient. În 2016, mai multe studii au atras atenția asupra acestei posibilități, iar un studiu prospectiv a raportat că ATTRwt a avut o prevalență de 6 % la pacienții cu vârsta peste 65 de ani care au fost supuși înlocuirii valvei aortice16. Acest studiu a sugerat că pacienții cu ambele entități au avut un prognostic postoperator mult mai rău decât cei fără ATTRwt (mortalitate 50% vs. 6,9% după o urmărire mediană de 2,3 ani).16 Un alt studiu recent cu scintigrafie cu 99mTc-DPD la 43 de pacienți cu stenoză aortică cu debit scăzut/gradient scăzut a identificat 5 pacienți cu ATTRwt (prevalență 12%). 17 Pacienții cu stenoză aortică severă și ATTRwt au același profil demografic, iar tratamentul adecvat pentru pacienții cu ambele boli nu a fost încă determinat.
Utilitatea tehnicilor de diagnosticare
Diagnosticul ATTR este o provocare în practica clinică zilnică. Deși electrocardiografia și ecocardiografia joacă un rol în diagnostic, noile tehnici neinvazive au dobândit un rol cheie în evaluarea pacienților cu ATTR.
Electrocardiograma
Asociația dintre tensiunea joasă și amiloidoza cardiacă a fost considerată de mult timp incontestabilă.3 Criteriile cele mai utilizate pe scară largă în practica clinică sunt amplitudinea QRS 1 Deși tensiunile electrocardiografice joase în contextul LVH ar trebui să stabilească suspiciunea, prevalența într-o serie contemporană de ATTR a fost de doar 20% până la 25%.3,4,13 Prevalența variază, de asemenea, în funcție de criteriile aplicate. De exemplu, utilizarea criteriului Sokolow (undă S în derivația V1 + undă R în derivația V5 sau V6
1,5 mV) poate crește prevalența calculată între 46% și 58%.13 Raportul dintre grosimea peretelui ventricular stâng și tensiunea QRS totală a fost recomandat pentru a evalua mai bine disparitățile dintre rezultatele celor 2 tehnici.2,3 Cu toate acestea, până la 20% dintre pacienții cu ATTR pot îndeplini criteriile electrocardiografice pentru LVH.2,3
În majoritatea seriilor de pacienți cu amiloidoză cardiacă, modelul de pseudoinfarct este cea mai frecventă constatare electrocardiografică2,3,13 (figura 2A). Datorită posibilei implicări a sistemului de conducere, blocurile complete sau incomplete ale ramurii de ramură sunt, de asemenea, frecvente.3
Ecocardiografie
Deși ecocardiografia este piatra de temelie a diagnosticului inițial al ATTR, nicio constatare nu este specifică.3 Amiloidoza cu transthyretină a fost de obicei asociată cu un ventricul stâng normal sau mic cu hipertrofie concentrică.3 Cel de-al 10-lea Simpozion Internațional privind Amiloidul și Amiloidoza, desfășurat în 2004, a stabilit criteriul ecocardiografic al cardiopatiei datorate AL în absența altor cauze de LVH ca fiind prezența LVH cu un cutoff de 12 mm pentru grosimea peretelui septului interventricular.4 Acest criteriu a fost ulterior extrapolat la alte forme de amiloidoză (Figura 2B), ceea ce a conferit un grad ridicat de specificitate, dar o sensibilitate scăzută.
Deși LVH concentrică a fost descrisă în mod clasic, seriile actuale sugerează că aproximativ 20% au LVH asimetrică.13
În ciuda asocierii clasice între o fracție de ejecție a ventriculului stâng (FEVS) normală sau ușor scăzută și amiloidoza cardiacă,2 intervalul FEVS este foarte variabil.8 Într-un studiu recent efectuat la Clinica Mayo, o FEVS 8, în timp ce în seria noastră o FEVS 13 În plus, utilizarea FEVS în evaluarea funcției sistolice în amiloidoza cardiacă este limitată, deoarece valorile ușor scăzute indică deja o boală cardiacă relevantă. Această limitare poate fi depășită prin utilizarea vitezelor Doppler tisular, a imagisticii de deformare și a fracției de contracție miocardică, care au fost propuse ca indici mai adecvați pentru evaluarea funcției cardiace.2
Alte semne ecocardiografice clasice sunt hipertrofia ventriculară dreaptă, dilatarea biatrială, efuziunea pericardică ușoară, îngroșarea valvei atrioventriculare, îngroșarea peretelui septului atrial și aspectul de scânteiere granulară a miocardului.3,6 Cu toate acestea, deoarece unele dintre aceste trăsături au fost observate într-o serie foarte selecționată de pacienți în stadii avansate ale bolii, nu toate trebuie să fie prezente pentru a stabili suspiciunea.1
Imagistica de deformare regională este o tehnică foarte utilă pentru diagnosticul precoce al pacienților cu ATTR. La pacienții cu ATTR, tulpina longitudinală este deprimată în segmentele bazale și medioventriculare, dar este păstrată în segmentele apicale18 (figura 2C). Acest tipar tipic poate fi util în diagnosticul diferențial al ATTR față de alte boli cardiace.4
Biomarkeri
Există mai puține date privind rolul prohormonei N-terminale a propeptidului natriuretic cerebral (NT-proBNP) și al troponinei în ATTR decât în AL.4 Nivelurile NT-proBNP în ATTR sunt de obicei mai scăzute decât în AL,4 reflectând 2 mecanisme fiziopatologice diferite: toxicitatea directă a lanțului ușor în AL vs. leziuni tisulare induse de protofibrile în ATTR.
Recent, grupul Mayo Clinic a propus un sistem de stratificare similar cu cel în vigoare pentru AL. Într-o cohortă de 360 de pacienți cu ATTRwt, ambii biomarkeri s-au dovedit a fi predictori ai mortalității. Pacienții în stadiul III (NT-proBNP > 3000 pg/mL și troponină T > 0,05 ng/mL) au avut o supraviețuire mediană de 20 de luni, în timp ce pacienții în stadiile I și II au avut o supraviețuire mediană de 66 de luni și, respectiv, 40 de luni (niciun biomarker sau doar 1 biomarker peste punctele de referință stabilite).
Rezonanța magnetică cardiacă
Rezonanța magnetică cardiacă (RMN) poate fi utilizată pentru a obține informații structurale și funcționale și pentru a caracteriza compoziția țesutului miocardic.3 CMRI este esențială în identificarea precoce a ATTR și în diagnosticul diferențial al acesteia față de alte afecțiuni cardiace.
Caracterizarea țesutului prin CMRI se bazează pe următoarele caracteristici:
- –
Îmbunătățire tardivă: Un pattern global subendocardic este practic patognomonic pentru amiloidoza cardiacă, dar este prezent doar la aproximativ un sfert dintre pacienți. Alte modele, cum ar fi transmural (cel mai frecvent) sau patch-uri, sunt de asemenea compatibile (figura 3). În ciuda sensibilității și specificității sale ridicate, trebuie ținut cont de faptul că poate exista o posibilă absență a enhancement-ului tardiv (15% dintre pacienți) și, în experiența noastră, un procent deloc neglijabil de falsuri negative din motive tehnice.3 Pattern-ul de enhancement transmural este asociat cu un prognostic mai prost și este un predictor independent de mortalitate.19
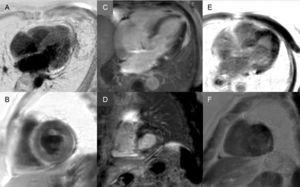 Figura 3.
Figura 3.Diversitatea modelelor de întărire tardivă prin imagistică prin rezonanță magnetică cardiacă în amiloidoza cu transthyretina. A și B: secvențe de întărire târzie, planul cu 4 camere și, respectiv, axa scurtă la nivel mediu, la un pacient cu amiloidoză transthyretină mutantă (ATTRm), care arată depunerea difuză de gadoliniu transmural patologic. C și D: secvențe de îmbunătățire târzie, planul cu 4 camere și, respectiv, axa scurtă la nivel bazal, ale unor pacienți cu ATTRm, care prezintă depuneri patologice de gadoliniu cu un model peticit, cu o zonă focală inferoseptală inferioară și inferolaterală bazală inferolaterală. E și F, secvențe de îmbunătățire târzie, planul cu 4 camere și, respectiv, axa scurtă la nivel apical, ale pacienților cu ATTRm, care arată o depunere transmurală patologică extinsă, cu excepția segmentelor bazale și anterolaterale medii. Prin amabilitatea Dr. Jesús González Mirelis.
(0.15MB). - –
Timpuri T1 lungi: Cartografierea T1 este o tehnică în care se măsoară un semnal miocardic cantitativ înainte (T1 nativ) sau după administrarea de contrast. Timpii T1 nativi sunt foarte lungi în amiloidoza cardiacă.3 Cartografierea T1 nu necesită administrarea de substanță de contrast și, prin urmare, poate fi utilizată în insuficiența renală. Timpii T1 pot fi chiar anormali înainte de observarea LVH.3 Timpii T1 sunt mai lungi în ATTR decât în HCM și la controale (1097ms ± 43 ms vs 1026ms ± 64 ms vs 9,67ms ± 34ms, respectiv; P
ms ± 68 ms; P = 0,01).20
Administrarea de contrast poate fi utilizată pentru a calcula volumul extracelular (ECV) și a evalua creșterile de spațiu extracelular. Valorile ECV în amiloidoza cardiacă sunt mai mari decât în alte afecțiuni cardiace, cu excepția zonelor de infarct miocardic.21 În 2016, grupul nostru, în colaborare cu alte centre naționale, a raportat că cuantificarea ECV poate identifica implicarea cardiacă în ATTRm și, pentru prima dată, a corelat-o cu gradul de afectare neurologică, susținând utilizarea acestei tehnici în diagnosticul precoce și urmărirea ATTRm.22
Tehnicile de cartografiere T1 cantitativă și de calcul al ECV pot fi foarte utile în ATTR pentru diagnosticarea precoce, urmărirea clinică și evaluarea răspunsului la tratament (Figura 4).
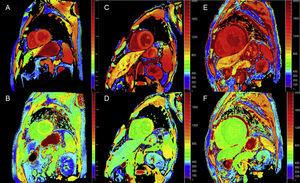
Cartografierea T1, înainte și după aplicarea contrastului, cu metoda modified look-locker inversion-recovery (MOLLI) în imagistica prin rezonanță magnetică cardiacă 3T la un control sănătos, la un pacient cu amiloidoză cu transthyretină și la un pacient cu amiloidoză primară cu lanț ușor. A și B: cartografierea T1 nativă și, respectiv, volumul extracelular (EV), la un control sănătos, care prezintă valori normale (EV = 0,214). C și D: cartografiere T1 nativă și, respectiv, EV, la un pacient cu amiloidoză transthyretină mutantă cu leziuni neurologice și implicare cardiacă incipientă, T1 nativă ridicată și EV ușor ridicat (0,361). E și F: cartografiere T1 nativă și, respectiv, EV, la un pacient cu amiloidoză cardiacă transthyretină de tip sălbatic, T1 nativă ridicată și EV foarte ridicată (0,626), reflectând o infiltrare masivă de amiloid. Prin amabilitatea Dr. Jesús González Mirelis.
Scintigrafie cardiacă
În anii 1980, observarea captării cardiace a mai multor trasori difosfonați osoși a fost corelată histologic cu prezența amiloidozei cardiace.23 Mecanismul de captare nu este bine caracterizat, dar poate fi legat de conținutul de calciu al depozitelor de amiloid.
Un studiu timpuriu realizat de grupul din Bologna folosind 99mTc-DPD a constatat captarea cardiacă la 15 pacienți cu ATTR și absența acesteia la 10 pacienți cu AL, folosind un scor bazat pe captarea biventriculară egală sau superioară celei osoase (scorul Perugini)24 (figura 2D). Constatări similare au fost raportate ulterior de grupul nostru și de alții.25 Captarea ușoară (scor 1) și moderată (scor 2) poate fi găsită la 30% și, respectiv, 10% dintre pacienții cu AL.24
Datorită sensibilității și specificității sale ridicate, această tehnică este extrem de utilă pentru stabilirea diagnosticului de ATTR și poate evidenția implicarea cardiacă chiar și atunci când rezultatele ecocardiografiei și ale RMN-ului sunt încă normale. De fapt, după scintigrafia pentru indicații oncologice sau reumatologice, descoperirile accidentale de ATTR nu sunt neobișnuite.26
Tc-DPD nu este disponibil în Statele Unite, dar au fost raportate rezultate similare cu ajutorul imagisticii cu 99mTc-PYP (pirofosfat).27
Alți radiotrasori sunt în prezent în curs de studiu. De exemplu, 18F-florbetapir, care a fost deja aprobat pentru imagistica beta-amiloidă cerebrală,4 a fost studiat la pacienții cu AL și ATTR. Rezultatele arată că 18F-florbetapir poate detecta depozitele miocardice de AL și ATTR.28 Deși datele disponibile au fost obținute în studii de caz29 și costul ridicat al acestui radiotrasor îi limitează utilizarea, sunt în curs de desfășurare mai multe studii privind avantajul potențial al utilizării sale față de cel al Tc-DPD ca tehnică de screening pentru cele mai frecvente 2 tipuri de amiloidoză.
Diagnostic invaziv
Diagnosticul definitiv al ATTR se bazează pe demonstrarea histologică a fibrilelor amiloide. Deși pot exista depuneri extracardiacale, probabilitatea de a demonstra amiloidul prin histologie variază în funcție de organ.2 Există puține studii privind raportul cost-eficiență al biopsiei extracardiacale (de exemplu, grăsime abdominală, gingivală, glande salivare, gastrointestinale) în ATTR, care este mai mare în ATTRm decât în ATTRwt. Cu toate acestea, o biopsie negativă a unui organ neafectat din punct de vedere clinic nu exclude diagnosticul de ATTR.4
Ca și în cazul ATTRwt, biopsia endomiocardică este indicată la pacienții fără afectare extracardiacă sau doar cu afecțiuni cardiace.3,4 Biopsia endomiocardică este o procedură cu risc scăzut (în special în centrele cu experiență), iar erorile de eșantionare sunt puțin probabile.6
După confirmarea histologică a amiloidozei, care uneori poate necesita interpretarea de către personal instruit,6 clasificarea corectă a subtipului este crucială.4 În prezent, clasificarea depinde de o combinație de imunohistochimie, analiză genetică și proteomică:
- –
Imunohistochimia se bazează pe utilizarea de anticorpi specifici împotriva proteinelor amiloide cunoscute. Deși rezultatele acestei tehnici sunt de obicei definitive, ea este mai puțin sensibilă în ceea ce privește recunoașterea lanțurilor ușoare.4
- –
Această limitare poate fi depășită prin utilizarea spectrometriei de masă, care oferă rezultate definitive și reprezintă criteriul standard în confirmarea subtipului amiloid. 2 Deși această tehnică este disponibilă doar în centrele de specialitate, este deosebit de utilă în cazurile neconcludente sau în cazurile care sunt pozitive pentru mai mulți anticorpi la imunohistochimie, ceea ce în experiența noastră se întâmplă în aproximativ 20% până la 30% din cazuri. 4
- –
Pentru că tehnicile clinice sau histologice nu pot distinge ATTRm de ATTRwt, studiile genetice sunt recomandate în toate cazurile de ATTR. Descoperirea unei mutații cauzale poate fi importantă pentru a oferi consiliere genetică și urmărirea purtătorilor asimptomatici, 4,30 care ar putea beneficia de viitoarele terapii care să întârzie sau chiar să prevină apariția bolii.31
Diagnostic noninvaziv
Până de curând, studiile histologice erau considerate esențiale în diagnosticul ATTR.3 Cu toate acestea, pentru a facilita diagnosticul, în 2016 un studiu multicentric internațional a propus un nou algoritm pentru diagnosticul noninvaziv al ATTR.32
Studiul a analizat rezultatele a 1217 pacienți. Prezența semnelor clasice de amiloidoză cardiacă prin tehnici imagistice, captarea Tc-DPD/PYP de gradul 2 sau 3 la scintigrafie și absența unei proteine monoclonale au avut o specificitate și o valoare predictivă pozitivă pentru ATTR de 100%32 (figura 5).
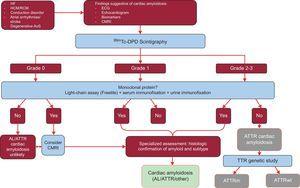
Algoritm de diagnostic pentru pacienții cu suspiciune de amiloidoză cardiacă. Sistem de clasificare a scintigrafiei cu 99mTc-DPD: grad 0, fără captare cardiacă; grad 1, captare ușor mai mică decât cea osoasă; grad 2, captare moderată egală cu cea osoasă; grad 3, captare severă superioară celei osoase. ACV, accident vascular cerebral; AL, amiloidoză primară cu lanț ușor; AoS, stenoză aortică; ATTR, amiloidoză cu transthyretină; ATTRm, amiloidoză cu transthyretină mutantă; ATTRwt, amiloidoză cu transthyretină de tip sălbatic; CMRI, imagistică prin rezonanță magnetică cardiacă; ECG, electrocardiogramă; HCM, cardiomiopatie hipertrofică; IC, insuficiență cardiacă; RCM, cardiomiopatie restrictivă; TTR, transthyretină.
O caracteristică cheie a acestui algoritm este absența unei proteine monoclonale care ar putea cauza AL la testul lanțului seric (Freelite, The Binding Site, UK) și la electroforeza prin imunofixare a sângelui și urinei. Prezența unei proteine monoclonale este o indicație pentru efectuarea unei biopsii endomiocardice pentru a face distincția între ATTR și AL.32 Până la 5% din populația cu vârsta de peste 65 de ani prezintă o gamapatie monoclonală de semnificație nedeterminată.2 La persoanele în vârstă, o creștere moderată a lanțurilor ușoare circulante nu ar trebui să conducă direct la un diagnostic de AL. S-a raportat că până la 10% dintre pacienții vârstnici cu ATTRwt și gammopatie monoclonală de semnificație nedeterminată din centrele de referință au primit anterior un diagnostic greșit de AL.3,33 Un diagnostic corect este necesar pentru a evita o chimioterapie necorespunzătoare. Interesant este faptul că spitalul nostru a documentat 2 cazuri de pacienți cu mielom multiplu și ATTRwt concomitent pe spectrometrie de masă.
TRATAMENTUL AMILOIDOZEI CARDIACALE TRANSIRETINE
Tratamentul pacienților cu ATTR are 2 obiective: asigurarea suportului medical și, dacă este posibil, oprirea sau întârzierea depunerii de amiloid prin utilizarea unor tratamente specifice.
Tratament medical
Secțiunile următoare descriu îngrijirea cardiacă de susținere pentru pacienții cu ATTR.
Managementul insuficienței cardiace
Euvolemia trebuie menținută la pacienții cu amiloidoză cardiacă. Măsurile privind dieta și stilul de viață sunt foarte importante. Diureticele sunt esențiale pentru tratamentul IC în ATTR. Cu toate acestea, deoarece utilizarea excesivă a diureticelor poate duce la hipotensiune (frecvent din cauza disfuncției autonome) și poate agrava situația clinică, în special în ATTRm, trebuie să se acorde o atenție extremă în gestionarea acesteia.
În tratamentul IC în ATTR, trebuie avut în vedere faptul că disfuncția diastolică afectată și volumul cerebral redus duc la tahicardie compensatorie pentru a menține debitul cardiac. Prin urmare, beta-blocantele trebuie utilizate cu atenție și individualizate pentru fiecare pacient. Practica standard este de a le elimina în absența dificultăților în controlul frecvenței cardiace. Această abordare este și mai importantă, dacă este posibil, în ATTRwt din cauza prezenței frecvente a tulburărilor de conducere.6 Antagoniștii de calciu și digoxina se pot lega de fibrilele amiloide și, prin urmare, sunt contraindicate în ATTR din cauza riscului de toxicitate chiar și la doze terapeutice.6
În contrast cu IC cu disfuncție sistolică datorată altor etiologii, nu există dovezi în sprijinul unui beneficiu prognostic datorat utilizării beta-blocantelor, a inhibitorilor enzimei de conversie a angiotensinei sau a antagoniștilor receptorilor de angiotensină II în amiloidoza cardiacă. De fapt, utilizarea lor poate duce la o înrăutățire clinică din cauza hipotensiunii și a debitului scăzut: o publicație recentă a raportat un prognostic mai rău în ATTRm și un efect neutru în ATTRwt.34
Managementul aritmiilor atriale
Managementul FA în ATTR este o provocare. Menținerea ritmului sinusal pe termen lung este dificilă. Cu toate acestea, cardioversia electrică poate fi încercată deoarece poate duce la o ameliorare clinică.
Riscul tromboembolic la pacienții cu ATTR este foarte ridicat. În plus, infiltrarea cronică a amiloidului poate duce la disfuncție mecanică atrială, care poate fi cauza care stă la baza apariției trombilor atriali la unii pacienți fără FA. Terapia anticoagulantă în ATTR nu ar trebui să se bazeze pe scorul CHADS2-VASC și ar trebui să fie terapia standard în FA. Evenimentele hemoragice sunt mai puțin frecvente decât în AL, astfel că unele spitale recomandă terapia anticoagulantă la pacienții cu ritm sinusal dacă există o funcție atrială deficitară conform vitezei Doppler transmisibile. Deși nu există studii comparative privind eficacitatea anticoagulantelor orale directe față de antagoniștii vitaminei K, spitalul nostru a administrat anticoagulante orale directe la pacienți selectați.
Rolul dispozitivelor
Recomandările actuale pentru implantarea stimulatorului cardiac sunt aceleași în ATTR și în populația generală. Cu toate acestea, unele grupuri favorizează implantarea profilactică, în special la pacienții cu ATTRm și tulburări de conducere.35 Noi nu favorizăm această strategie preventivă și nu am constatat o rată atât de ridicată a tulburărilor de conducere încât să justifice implantarea profilactică la pacienții cu ATTRm.
Rolul folosirii unui cardioverter-defibrilator implantabil (ICD) în ATTR nu este bine stabilit. Într-o serie mică, implantarea ICD nu a îmbunătățit semnificativ supraviețuirea, deși a avut un efect adecvat la mai mulți pacienți în primii 2 ani.36
Transplant cardiac
Transplantul cardiac a jucat un rol minor în ATTR, deoarece ATTRm poate implica diferite organe și ATTRwt afectează de obicei pacienții vârstnici. Cu toate acestea, absența implicării extracardiacale la pacienții cu ATTRwt îi face pe aceștia buni candidați pentru această procedură. Literatura de specialitate oferă exemple de transplanturi reușite la pacienți mai tineri de 70 de ani cu ATTRwt sau cu ATTRm și implicare cardiacă predominantă.4
Tratamentul specific al amiloidozei cardiace cu Transthyretin
În prezent, nu există o terapie aprobată pentru tratamentul specific al amiloidozei cardiace ATTR, deși transplantul hepatic (TxH) singur sau în combinație cu transplantul cardiac a fost utilizat în cazul ATTRm începând cu anii 1990, ca modalitate de eliminare a sursei principale de precursor TTR.4
Transplantul de ficat
Registrul mondial de transplant al polineuropatiei amiloidotice familiale37 a raportat că peste 2000 de pacienți cu ATTRm au fost supuși TxH în 20 de țări.4 Pacienții cu mutația Val30Met și un tablou clinic predominant neurologic au o rată de supraviețuire de peste 50% la 20 de ani.3 Aceste rezultate promițătoare se bazează pe o selecție strictă a pacienților în funcție de vârstă, tipul de mutație și stadiul bolii. Cea mai frecvent acceptată indicație pentru TxH este combinația dintre vârsta tânără, mutația Val30Met și stadiile incipiente ale bolii.
Cu toate acestea, principalele limitări ale acestei tehnici sunt lipsa donatorilor, necesitatea unei imunosupresii cronice, vârsta avansată la momentul prezentării și rezultatele mai slabe obținute la pacienții cu alte mutații decât mutația Val30Met.
În plus, suprimarea teoretică a producției de proteină mutantă este contracarată de depunerea progresivă de TTR nativă postimplantare,4,6 al cărei mecanism nu este complet înțeles. De fapt, depunerea cardiacă de TTR după TxH influențează morbiditatea și mortalitatea.
Nevoia de a înțelege mai bine patogeneza ATTR și limitările TxH a stimulat dezvoltarea mai multor medicamente.
Acesti noi compuși acționează în diferite puncte din cascada amiloidogenezei TTR (figura 6). Tratamentul va implica întotdeauna reducerea proteinei precursoare, deși evitarea depunerilor și eliminarea depunerilor existente vor fi la fel de importante. Prin urmare, credem că, în viitor, abordarea acestei boli va fi sub forma unui tratament combinat.
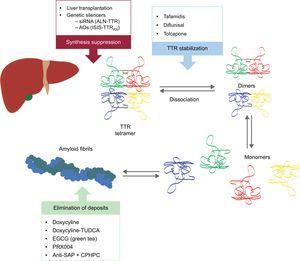
Terapii specifice în amiloidoza cardiacă cu transthyretină și principalele ținte. AntiSAP + CPHPC, antiserum amiloid P component + acid (R)-1–6-oxo-hexanoil]pirrolidin-2-carboxilic; AOs, oligonucleotide antisens; EGCG, epigallocatechin-3 gallate; siRNA, small interfering RNA; TTR, transthyretin; TUDCA, acid tauroursodeoxicolic.
Supresia sintezei transthyretinei
Două linii de cercetare sunt în curs de desfășurare privind inhibarea expresiei hepatice a TTR: utilizarea ARN mic de interferență (siRNA) și utilizarea medicamentelor cu oligonucleotide antisens (AO).
- –
SiARN-urile sunt molecule de ARN bicatenar care reduc la tăcere secvențele de ARN mesager prin legarea specifică la acestea, împiedicând formarea de proteine. S-a constatat că Patisiran (ALN-TTR02) reduce producția de TTR cu 80%.38 La pacienții cu ATTRm, reducerea TTR a fost de 87%.39 Un studiu de fază 2 a prezentat rezultate promițătoare, demonstrând parametri ecocardiografici, funcționali și analitici stabili la 12 luni și la 24 de luni.40 Rezultatele studiului neurologic de fază 3 la pacienții cu ATTRm și o subanaliză a pacienților cu afectare cardiacă sunt așteptate în 2017 (tabelul 2). Un alt medicament, revusiran (ALN-TTR01), se administrează subcutanat și diferă de patisiran prin nanoparticulele lipidice care încapsulează siRNA. Acest medicament a făcut obiectul unui studiu clinic de fază III la pacienții cu ATTRm care au afecțiuni cardiace. Studiul a fost întrerupt anul trecut din cauza unei creșteri neașteptate a mortalității în grupul de tratament (tabelul 2).
Tabel 2.Principalele studii clinice în curs de desfășurare în amiloidoza cardiacă cu Transthyretină
Mecanism de acțiune Compus Studiu Proiect Pacienți (N) și subtipul ATTR Intervenție Primary endpoints Situație/rezultate Supresia sintezei ATTR Patisiran (ALN-TTR02) NCT01961921 Studiu de fază II, multicentric 27
ATTRm (11 afecțiuni cardiace)Patisiran 0.30 mg/kg IV la fiecare 3 săptămâni timp de 2 ani Siguranță pe termen lung. Criterii secundare de evaluare: efectul asupra tulburărilor neurologice și a parametrilor cardiaci Medicament bine tolerat, cu profil de siguranță similar în fenotipul neurologic și cardiac
Troponina I, NT-proBNP și datele ecocardiografice au rămas stabile la 12 luni și la 24 luniNCT01960348 (APOLLO) Fază III, randomizat, dublu-orb, controlat cu placebo, multicentric 225
ATTRm cu afectare neurologicăPatisiran perfuzie IV vs placebo 2:1 Schimbări în mNIS+7 Așteptate în noiembrie 2017
Subanaliză a pacienților cu implicare cardiacă previzibilăNCT02510261 Studiu de extensie APOLLO Patisiran perfuzie IV vs placebo 2:1 pentru 52 de săptămâni Siguranță și efecte adverse pe termen lung În curs de desfășurare Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Faza III, randomizată, dublu-orb, controlată cu placebo 206
ATTRm cu afectare cardiacăRevusiran 500mg 5 d, apoi săptămânal timp de 2 ani față de placebo Schimbări în testul de mers pe 6 m și în valorile plasmatice ale TTR Descontinuare din cauza mortalității crescute în brațul revusiran ISIS-TTRRX NCT01737398 Faza II/III, randomizat, dublu-orb, controlat cu placebo, multicentric 172
ATTRm cu neuropatie; 50% afectare cardiacă concomitentăISIS-TTRRX 300mg SC la fiecare 12 h timp de 1 săptămână, apoi săptămânal timp de 64 wk vs placebo Schimbări în mNIS+7 și în chestionarul Norfolk privind calitatea vieții Așteptată în septembrie 2017
Cazuri de trombocitopenie severă și sângerare raportate
Analiză a parametrilor ecocardiografici și a NT-proBNP așteptați la pacienții fără hipertensiune arterială cu LVH > 12 mmTratamentul cardiomiopatiei TTR cu oligonucleotid antisens specific TTR Faza II, deschisă, non-randomizată 20
ATTRm cu afectare cardiacă și ATTRwtISIS-TTRRX 300mg SC la fiecare 12 h/săptămână Parametri ecocardiografici și RMN cardiac față de controale istorice Nici o deteriorare a tensiunii și o scădere a masei LV de aproximativ 5%
6 pacienți au completat 12 luni; 15 pacienți 6 luni; 1 pacient TxCNCT02627820 Fază II, deschis, nerandomizat 50
ATTRwtISIS-TTRRX 300mg SC la fiecare 12 h timp de 1 săptămână, apoi 1 săptămână timp de 18 săptămâni Schimbări ale tensiunii măsurate prin speckle tracking Cancelat fără inițierea recrutării pacienților Studiu de fază III cu ISIS-TTRRX pentru tratamentul cardiopatiei amiloide TTR Faza III, randomizat, dublu-orb, controlat cu placebo, multicentric 490
ATTRwt și ATTRm cu afectare cardiacăISIS-TTRRX 300mg SC la fiecare 12 h timp de 1 săptămână, apoi săptămânal timp de 16 săptămâni cu placebo, apoi săptămânal timp de 24 luni Moarte, TxC sau internare pentru cauze cardiovasculare În așteptare Stabilizarea TTR Tafamidis NCT01994889 Faza III, randomizată, dublu-orb, controlată cu placebo, multicentric 441
ATTRwt și ATTRm cu afectare cardiacăTafamidis 20mg sau 80mg pe cale orală la fiecare 24 h timp de 30 luni vs placebo Toate-mortalitate din cauze multiple și spitalizare cardiovasculară Se încheie în februarie 2018 NCT02791230 Extensie Faza III NCT01994889 330
ATTRwt și ATTRm cu afectare cardiacăTafamidis 20 mg sau 80 mg oral la fiecare 24 h timp de 60 luni Toate-mortalitate din cauze multiple și incidența efectelor adverse Așteptată în decembrie 2021 NCT00935012 Faza II, deschis, cu etichetă deschisă, de eficacitate și siguranță 31
ATTRwt sau ATTRm p.Val122Ile cu afectare cardiacăTafamidis 20mg pe cale orală Siguranță și eficacitate În curs de desfășurare până în decembrie 2021 Diflunisal NCT00294671 Fază III, randomizat, dublu-orb, controlat cu placebo, multicentric 130
ATTRm cu fenotip neurologic (50% cu afectare cardiacă)Diflunisal 250mg oral la fiecare 12 h vs placebo peste 24 luni NIS+7 la 24 luni NIS+7 diflunisal vs placebo 16.3 (P Nicio reducere a grosimii ventriculare sau a tensiunii ventriculare la pacienții cu afectare cardiacă față de placebo Eliminarea depozitelor Doxiciclină + TUDCA/UDCA NCT01171859 Faza II, deschisă, nerandomizată, prospectivă 40
ATTR (25 ATTRm, 13 ATTRwt și 2 transplantați hepatici domino)Doxiciclină 100 mg la fiecare 12 h + TUDCA 250 mg la fiecare 8 h timp de 12 luni, apoi 6 luni fără terapie Îmbunătățire 14 pacienți s-au retras
Reacții cutanate adverse, 16 pacienți
68% din cei 25 de pacienți evaluabili au îndeplinit criteriul principal de evaluare
Îmbunătățire globală a tulpinii la 12 luni și înrăutățire după 6 luni fără terapieNCT01855360 Faza II, deschisă, non-randomizată, prospectivă vs controale istorice 30
Amiloidoză cardiacă ATTR (27 ATTRwt și 3 ATTRm). Controale istorice, 14 pacienți cu ATTRwtDoxiciclină 100 mg la fiecare 12 h + TUDCA 250 mg la fiecare 8h timp de 18 luni Schimbări ale tensiunii longitudinale la fiecare 6 luni 22 de pacienți au finalizat studiul și au fost evaluabili
Deteriorare mai mare a tensiunii la controalele față de grupul de tratament
Creștere a NT-proBNP în grupul de tratament; nu a fost măsurat la martoriNCT01677286 Fază II, deschis, non-randomizat, prospectivă 25
Amidiloidoză sistemică (6 ATTRwt și 3 ATTRm)Doxiciclină 100 mg la fiecare 12 h timp de 12 luni Siguranța medicamentului
Răspunsul organelor afectateÎnrăutățirea NT-.proBNP și a funcției renale
Nici o îmbunătățire a altor parametri studiați
60% dintre pacienți au avut complicații cutanate și 30% s-au retras din cauza problemelor cutanate sau gastrointestinaleNCT01171859 Faza II, deschisă, nerandomizată, prospectivă 45
35 cu afectare cardiacă; 25 ATTRm; 5 ATTRm cu TxH; 13 ATTRwt; și 2 primitori de transplant hepatic dominoDoxiciclină 100 mg la fiecare 12 h + TUDCA 250 mg la fiecare 8 h timp de 12 luni
Faza de urmărire ulterioară fără tratament timp de 6 luniRăspunsul medicamentos definit ca un Răspuns cardiac evaluat la 25 de pacienți
68% au avut răspuns cardiac
Creșterea NT-proBNP și deteriorarea tensiunii în timpul urmăririi fără tratament
Număr mare de retrageri din cauza efectelor adverse
14 s-au retras în faza de tratament și 5 au întrerupt tratamentul în faza fără tratamentEfectul doxiciclinei + UDCA asupra ATTR Faza II, deschisă, non-randomizată, prospectiv 28
ATTR cu implicare cardiacă (27 ATTRm și 1 ATTRwt)Doxiciclină 200 mg/zi timp de 4 săptămâni, apoi suspendată 2 săptămâni, apoi UDCA 750 mg/d timp de 12 luni
Faza de urmărire ulterioară fără tratament timp de 6 luniSchimbări în NT-proBNP și scorul Kumamoto Doar 14% au finalizat studiul și 36% au finalizat 12 luni
Nici o schimbare în NT-proBNP la 6 luni și înrăutățire la 12 luni
HVS stabilă
Înrăutățirea scorului Kumamoto la 12 luniEGCG NCT01171859 Faza II, deschisă, non-randomizată, prospectivă 25
ATTRwt600 mg, EGCG timp de 12 luni Schimbări în ECHO și RMN cardiac (n = 14) Diminuarea masei LV 6% prin RMN cardiac (P = 0.03)
LVEF, grosimea miocardului și MAPSE prin ECHO neschimbateAntiSAP + CPHPC NCT03044353 Faza II, deschis, randomizat 40
Cohorta 1: amiloidoză cardiacă ATTR
Cohorta 2: amiloidoză primară după 6 luni de chimioterapieAnti-SAP + CPHPC lunar timp de 6 luni Reducerea încărcăturii amiloide prin RMN cardiac și ECHO Începem în 2017 Anti-SAP + CPHPC, component antiserum amiloid P + acid (R)-1–6-oxo-hexanoil]pirrolidin-2-carboxilic; ATTRm, amiloidoză transthyretină mutantă; ATTRwt, amiloidoză transthyretină de tip sălbatic; BNP, peptidă natriuretică cerebrală; ECHO, ecocardiogramă; EGCG, epigallocatechin-3 galat; IV, intravenos; LV, ventriculul stâng; LVEF, fracția de ejecție a ventriculului stâng; LVH, hipertrofie ventriculară stângă; MAPSE, excursie sistolică în planul inelului mitral; mNIS, Modified Neuropathy Impairment Score; MRI, imagistică prin rezonanță magnetică; NIS, Neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, amino-terminal pro-brain natriuretic peptide; SC, subcutanat; TTR, transthyretin; TUDCA, acid tauroursodeoxicolic; TxC, transplant de inimă; TxH, transplant de ficat; UDCA, acid ursodeoxicolic.
- –
AOA sunt șiruri scurte de oligonucleotide care se leagă în mod specific de ARN, împiedicând traducerea și sinteza proteinelor țintă.4 ISIS-TTRRX este un AO subcutanat, cu reduceri demonstrate, dependente de doză, ale valorilor TTR de 75% până la 90% la voluntarii sănătoși.4 Studiul de fază III la pacienții cu ATTRm și fenotip neurologic s-a încheiat în martie 2017, iar rezultatele acestuia sunt așteptate până la sfârșitul anului 2017. Cu toate acestea, US Food and Drug Administration a amânat inițierea unui studiu de fază III la pacienții cu ATTRwt și ATTRm cu afecțiuni cardiace din cauza unor cazuri de trombocitopenie severă în cadrul studiului neurologic (tabelul 2). Deoarece 50 % dintre participanții la studiul neurologic aveau afecțiuni cardiace, rezultatele acestui substudiu cardiac vor determina dacă studiul de fază III va fi reluat. Pe de altă parte, există date preliminare dintr-un studiu deschis de fază II. În acest studiu, 22 de pacienți cu ATTRwt și ATTRm cu afecțiuni cardiace au primit o injecție săptămânală de ISIS-TTRRX. Conform raportului, profilul de siguranță al medicamentului este foarte favorabil, iar datele intermediare privind progresia bolii cardiace prin CMR, NT-proBNP și testele de 6 minute sunt pozitive.41
Stabilizarea transthyretinei
Disocierea tetramerului TTR în subunități este o etapă crucială în formarea fibrilelor ATTR. Diflunisalul și tafamidis sunt 2 stabilizatori TTR cu eficacitate demonstrată în polineuropatia ATTRm.
- –
Tafamidis este o moleculă mică administrată pe cale orală care se leagă de TTR la situsurile de legare T4 stabilizând proteina și împiedicând disocierea acesteia. În urma publicării rezultatelor unui studiu dublu-orb randomizat la 125 de pacienți cu ATTRm și mutația Val30Met în stadiile inițiale ale bolii neurologice42, Agenția Europeană pentru Medicamente a aprobat utilizarea sa în 2011 ca medicament orfan pentru a întârzia progresia neurologică. Datele recente demonstrează eficacitatea medicamentului pentru obținerea unei stabilități neurologice la cel puțin 60% dintre participanți după mai mult de 4 ani de urmărire. Până în prezent, acesta are o utilizare limitată în ATTR și în bolile cardiologice. Un studiu de fază II la 21 de pacienți cu ATTRm și diferite mutații a arătat că NT-proBNP și parametrii ecocardiografici au rămas stabili la 12 luni.43 Datele unui studiu de cohortă de 5 ani au confirmat că medicamentul a fost bine tolerat la o doză de 20 mg, deși puțini pacienți cu ATTRwt au rămas stabili la 3,5 ani.44 Studiul ATTR-ACT este un studiu de fază III cu durata de 30 de luni care evaluează eficacitatea, siguranța și tolerabilitatea dozelor de 20 mg și 80 mg de tafamidis față de placebo la 440 de pacienți cu ATTRm, ATTRwt și IC. Criteriul principal de evaluare include mortalitatea și internarea în spital. Rezultatele sale sunt așteptate în 2018.3,27
- –
Diflunisalul este un agent antiinflamator nesteroidian care stabilizează moleculele TTR in vitro. Nu este disponibil în Spania, dar poate fi solicitat din punct de vedere medical din străinătate pentru utilizare compasională. Un studiu de fază III al ATTRm la pacienți cu afectare predominant neurologică, dintre care mai mult de jumătate prezentau afecțiuni cardiace, nu a constatat diferențe semnificative în ceea ce privește parametrii ecocardiografici pe parcursul perioadei de studiu (tabelul 2).45 Potențialul său de efecte adverse gastrointestinale, insuficiență renală, retenție de apă și hipertensiune îl face nepotrivit pentru pacienții cu afecțiuni cardiace. Dovezile privind diflunisalul la pacienții cu ATTR sunt foarte limitate. Există un singur studiu, dar acesta a fost limitat de faptul că a avut un design nonrandomizat într-un singur centru, cu o urmărire redusă și cu puțini pacienți (n = 13). Nu au existat internări pentru IC decompensată, dar a existat o înrăutățire semnificativă a funcției renale.46
- –
Mai recent, un grup spaniol a demonstrat că tolcapona (un inhibitor oral al catecol-O-metiltransferazei utilizat în tratamentul bolii Parkinson) are capacitatea de a se lega in vitro de TTR a pacienților cu ATTRwt și Val122Ile cu o afinitate mai mare decât alți stabilizatori.47
Eliminarea depozitelor de amiloid
Depozitele de amiloid sunt foarte stabile și se pare că organismul uman are o capacitate redusă de a le elimina. Cu toate acestea, tratamentele care împiedică producerea de nou amiloid, cum ar fi chimioterapia în AL, pot elimina treptat depozitele la diferite rate specifice fiecărui organ. Eliminarea cardiacă este deosebit de scăzută și, până în prezent, dovezile de regresie sunt rare. Mai multe molecule sunt în prezent în curs de investigare pentru a accelera eliminarea cardiacă a amiloidului în ATTR:
- –
Doxiciclina (un antibiotic utilizat în mod obișnuit) întrerupe formarea de fibrile amiloide. S-a demonstrat că efectul sinergic al doxiciclinei combinate cu acidul biliar tauroursodeoxicolic (TUDCA), care este utilizat în tratamentul bolilor hepatice, elimină depozitele de TTR în modele animale. Un studiu de fază II cu 20 de pacienți nu a arătat nicio progresie cardiacă sau neurologică după 1 an de tratament cu doxiciclină/TUDCA, cu un profil de siguranță și tolerabilitate acceptabil.4 Alte studii de fază II au încercat să confirme aceste rezultate folosind doxiciclină combinată/TUDCA, doxiciclină/acidursodeoxicolic sau doxiciclină singură.48-50 Rezultatele preliminare ale unuia dintre aceste studii sugerează un efect protector, cu o înrăutățire mai mică a funcției cardiace din cauza tensiunii în grupul de tratament. Un alt studiu dintre acestea a obținut rezultate similare la 40 de pacienți cu ATTR: parametrii NT-proBNP, clasa funcțională, FEVS și grosimea miocardului, printre alții, au rămas stabili la 12 luni (tabelul 2). Cu toate acestea, toate aceste studii au avut o rată mare de abandon (35%-44%), în principal din cauza efectelor adverse, în special hipersensibilitate solară și afecțiuni gastrointestinale (până la 30%). 48-50
- –
EGCG (epigallocatechin-3 galat) este cea mai abundentă catehină din ceaiul verde și s-a demonstrat in vitro și într-un model murin că inhibă formarea de amiloid și elimină depozitele existente. 4 CMRI a arătat că administrarea zilnică a 600 mg de EGCG a fost asociată cu stabilizarea masei ventriculare stângi la un grup de 25 de pacienți (tabelul 2). 51
- –
PrX004 este un anticorp monoclonal care acționează prin legarea la epitopi specifici monomerilor și la TTR prost pliată. El determină astfel eliminarea depozitelor prin activarea fagocitozei.52 Baza mecanismului său de acțiune este similară cu cea a unui anticorp utilizat în AL. Studiile de fază II asupra acestui anticorp prezintă rezultate promițătoare. Un studiu de fază I-II al acestui nou anticorp urmează să înceapă în 2017.
- –
Indiferent de tipul de proteină precursoare amiloidă, toate depozitele conțin componenta amiloidă serică P (SAP). Utilizând această moleculă ca țintă, s-a demonstrat că anticorpii anti-SAP provoacă o reacție mediată de macrofage și dependentă de complement care a determinat o eliminare majoră a depozitelor amiloide viscerale într-un model murin. Compusul bis-D-prolină CPHPC poate neutraliza SAP plasmatic, iar administrarea în comun cu IgG anti-SAP permite anticorpilor să ajungă la depozitele care conțin SAP în țesuturi.53 Un studiu de fază I publicat în 2015 a demonstrat eliminarea depozitelor hepatice la 15 pacienți cu amiloidoză sistemică fără afectare cardiacă, cu puține efecte adverse.53 Un studiu de fază II al pacienților cu amiloidoză cardiacă ATTR și AL urmează să înceapă în 2017 (Tabelul 2).
CONCLUZII
Amiloidoza cardiacă cu ATTR este diagnosticată cu o frecvență din ce în ce mai mare. Scintigrafia cu 99mTc-DPD și CMRI sunt exemple de tehnici care pot fi utilizate pentru identificarea simplă și precoce a pacienților cu ATTR.
În prezent, mai multe medicamente specifice ATTR se află în fazele finale de cercetare. Prin urmare, credem că amiloidoza cardiacă ATTR va fi considerată în curând o entitate tratabilă, mai degrabă decât o boală fatală.
FINANȚARE
Această lucrare a fost realizată cu sprijinul parțial al Institutului de Sănătate Carlos III și al Societății Spaniole de Cardiologie (grant de cercetare 2016 pentru E. González-López). Asistența din partea Institutului de Sănătate Carlos III este finanțată de Fondul European de Dezvoltare Regională „Another Way to Make Europe”.
CONFLICTE DE INTERES
E. González-López a participat în calitate de vorbitor la activități organizate de Pfizer. P. Garcia-Pavia a primit plăți în calitate de vorbitor în cadrul unor activități organizate de Pfizer și în calitate de consultant pentru Alnylam, Prothena și Pfizer. E. González-López, A. López-Sainz și P. Garcia-Pavia declară că Pfizer a finanțat proiecte de cercetare ale instituției lor.
.