Ce este permeabilitatea membranei celulare?
Mod de citire
Una dintre caracteristicile caracteristice ale tuturor organismelor vii este faptul că acestea conțin un amestec distinctiv de ioni și molecule mici. Compoziția nu numai că diferă de mediu, dar poate varia și în interiorul celulei. De exemplu, concentrația de ioni de hidrogen în unele compartimente celulare poate fi de 104 ori mai mare decât în altele (mitocondriile ajungând la un pH de până la 8; lizozomii cu un pH de până la 4, BNID 107521, 106074). Raportul dintre concentrațiile de ioni Ca2+ în compartimentele de lichid extra- și intracelular poate fi, din nou, de 104 ori mai mare (BNID 104083). Această diferență de concentrație este atât de mare încât transportul unui ion Ca2+ prin membrană, de la compartimentul intra- la cel extracelular, necesită energia a mai mult de un proton sau a unui ion de sodiu care curge în jos pe gradientul de forță motrice protonică. Pentru a vedea acest lucru, cititorul trebuie să își amintească regula empirică din lista noastră de trucuri ale meseriei conform căreia pentru a stabili o diferență de potențial de un ordin de mărime este nevoie de 6 kJ/mol (≈2 kBT). Această energie poate fi obținută, de exemplu, prin transportul unei sarcini electrice printr-o diferență de potențial de 60 mV. Pentru a obține un raport de concentrație de patru ordine de mărime, ar fi necesar atunci ca o sarcină să parcurgă aproximativ 240 mV de forță motrice a electronilor (de fapt, chiar mai mult datorită sarcinii duble a ionului de calciu). Acest lucru este foarte aproape de tensiunea de rupere a membranei, așa cum s-a discutat în vinieta „Care este diferența de potențial electric prin membrane?”. Într-adevăr, raportul ridicat al concentrației de Ca2+ se obține de obicei prin cuplarea cu transportul a trei ioni de sodiu sau cu hidroliza ATP, ceea ce ajută la obținerea diferenței de densitate necesară fără a energiza periculos membrana.
A doua lege a termodinamicii ne învață că, în general, prezența gradienților de concentrație va fi în cele din urmă însângerată de procesele de transport de masă, care conduc în mod constant sistemele spre o stare de echilibru. Cu toate acestea, deși a doua lege a termodinamicii ne spune natura stării finale a unui sistem (de exemplu, concentrații uniforme), nu ne spune cât timp va dura pentru a atinge această stare. Membranele au evoluat pentru a forma o barieră foarte eficientă în calea transferului spontan al multor specii ionice și moleculare. Pentru a estima scara de timp pentru egalizarea concentrațiilor, trebuie să cunoaștem ratele de transport de masă, care depind de proprietățile cheie ale materialelor, cum ar fi constantele de difuzie și permeabilitățile.
O clasă de „legi” de mare succes, care descrie comportamentul sistemelor care au suferit o mică abatere de la echilibru sunt legile de transport liniar. Aceste legi postulează o relație liniară simplă între viteza de transport a unei anumite cantități de interes și forța motrice asociată. În cazul transportului de masă, există o relație liniară între flux (adică numărul de molecule care traversează unitatea de suprafață pe unitatea de timp) și diferența de concentrație (care servește drept forță motrice relevantă). Pentru transportul prin membrane, aceste idei au fost codificate în ecuația simplă (pentru un solut neutru) j= – p-(cin-cout), unde j este fluxul net în celulă, cin și cout se referă la concentrațiile din interiorul și exteriorul regiunii delimitate de membrană, iar p este un parametru material cunoscut sub numele de permeabilitate. Unitățile lui p pot fi deduse prin observarea faptului că fluxul are unități de număr/(suprafață x timp), iar concentrația are unități de număr/volum, ceea ce implică faptul că unitățile lui p în sine sunt lungime/timp. La fel ca multe mărimi de transport (de exemplu, conductivitățile electrice ale materialelor, care se întind pe mai mult de 30 de ordine de mărime), permeabilitatea are un interval dinamic foarte mare, astfel cum este ilustrat în figura 1. După cum se vede în figură, straturile lipidice bilaterale au o gamă de permeabilități de aproape 1010 ori mai mare.
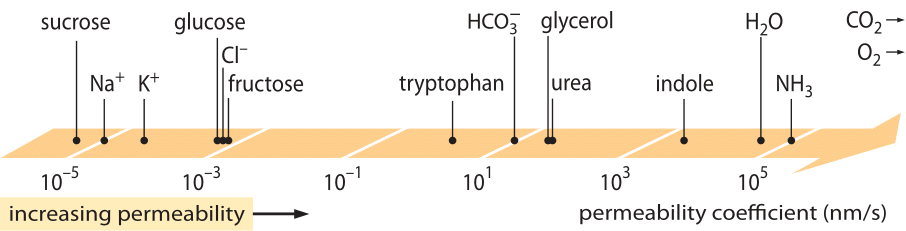
Figura 1: Gama largă de permeabilități membranare ale diferiților compuși din celulă. Membranele sunt mai permeabile la compușii neîncărcați și mai puțin permeabile la ionii încărcați. Rețineți că existența canalelor ionice va face ca permeabilitatea aparentă atunci când acestea sunt deschise să fie cu câteva ordine de mărime mai mare. Unitățile sunt alese ca nm/s, iar câțiva nm reprezintă lățimea caracteristică a membranei. Figura adaptată după R. N. Robertson, The Lively Membranes, Cambridge University Press, 1983. Valoarea pentru glucoză este mai mică decât în Robertson, pe baza mai multor surse, cum ar fi BNID 110830, 110807. Alte surse de date: BNID 110729, 110731, 110816, 110824, 110806.
Ce parametri fizico-chimici ghidează localizarea unui compus pe această scară a permeabilităților? O regulă empirică este aceea că moleculele mici au permeabilități mai mari decât moleculele mari. O altă regulă empirică este aceea că compușii neutri pot traversa membrana cu multe ordine de mărime mai repede decât compușii încărcați similari. Dintre compușii încărcați, compușii negativi (anionici) tind să aibă permeabilități mult mai mari decât compușii pozitivi (cationici). Așa-numita regulă Overton afirmă că permeabilitatea membranară crește odată cu hidrofobicitatea, unde hidrofobicitatea este tendința unui compus de a prefera un solvent nepolar unui solvent polar (apos). Regula Overton prezice că moleculele încărcate (nehidrofobe), cum ar fi ionii, vor avea tendința de a avea o permeabilitate scăzută, deoarece acestea suportă o penalizare energetică asociată cu penetrarea membranei, în timp ce gazele dizolvate, cum ar fi O2 și CO2, care sunt hidrofobe (deoarece nu sunt încărcate și sunt simetrice), vor avea o permeabilitate ridicată. Într-adevăr, permeabilitatea membranelor bistratificate lipidice la CO2 oferă valori care sunt de 0,01-1 cm/s (da, măsurătorile permeabilității au incertitudini foarte mari între diferite laboratoare, BNID 110004, 110617, 102624), mai mari decât toate celelalte valori prezentate în figura 1. Această valoare arată că bariera creată de membrana celulară este, de fapt, un obstacol mai puțin important decât bariera cauzată de stratul neaglomerat de apă care înghite membrana celulară din exterior. O astfel de deducție poate fi derivată din ecuația pentru coeficientul de permeabilitate al unui obstacol, dată de p=K x D/l, unde l este lățimea, D coeficientul de difuzie și K coeficientul de partiție între mediu și materialul obstacolului. Acesta este cunoscut și sub numele de modelul „solubilitate-difuzie” pentru permeabilitate, unde acestea denotă efectele K și D, care sunt două etape care afectează permeabilitatea. Pentru un strat de apă neaglomerat, K = 1, deoarece este foarte asemănător cu mediul, dar pentru membrană, valoarea pentru toate materialele, cu excepția celor mai hidrofobe, este de obicei cu câteva ordine de mărime mai mică decât 1. Această dependență de K se află în centrul regulii lui Overton menționată mai sus. Permeabilitatea ridicată pentru CO2 sugerează, de asemenea, că nu sunt necesare canale precum aquaporinele, care au fost sugerate ca fiind necesare pentru transportul gazelor în celulă, deoarece membrana este suficient de permeabilă. Pentru a vedea modul în care proprietățile membranei afectează compoziția chimică a metaboliților, trecem la calcularea timpului de scurgere pentru diferiți compuși
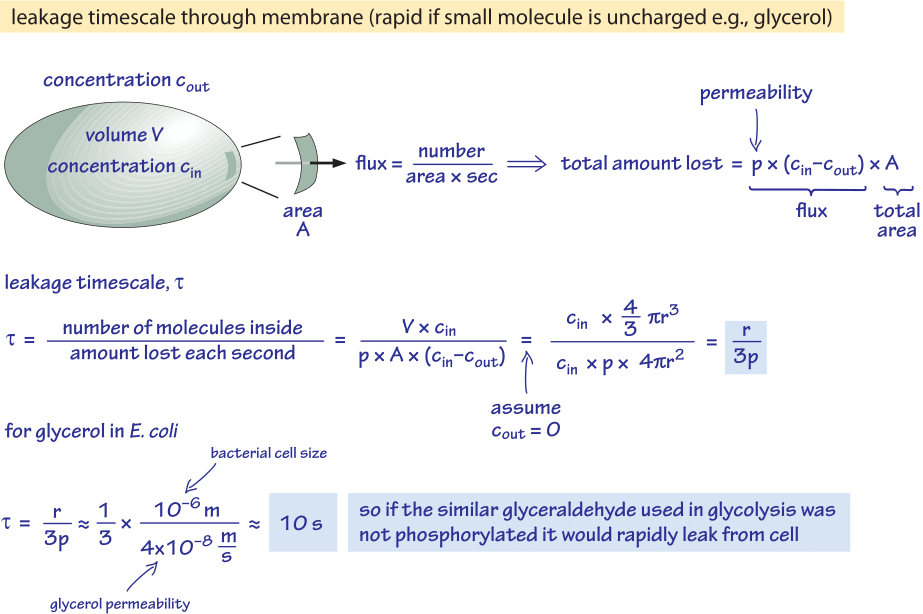
Figura 2: Calculul „back of the envelope” al intervalului de timp în care o moleculă de glucoză nefosforilată difuzează pasiv în afara unei celule bacteriene. Implicațiile funcționale sunt apoi luate în considerare pentru celula cu creștere rapidă, unde efectul este neglijabil, și pentru celulele în stare staționară, unde poate cauza o scurgere apreciabilă de resurse.
Considerăm glicerolul, de exemplu. Analiza prezentată în figura 2 oferă o estimare a timpului de scurgere a acestuia în afara celulei dacă molecula nu este fosforilată sau transformată în alt mod într-o formă mai hidrofilă. Permeabilitatea membranei celulare la glicerol este p≈10-100 nm/s (BNID 110824), după cum se poate citi din figura 1. Scara de timp pentru ca o moleculă de glicerol din interiorul celulei să scape înapoi în mediul înconjurător, presupunând că nu există un flux de întoarcere în celulă (cout=0), poate fi estimată în mod grosier prin observarea faptului că efluxul din celulă este p-A-cin, unde A este suprafața celulară. Scara de timp se găsește luând cantitatea totală din celulă, V-cin (unde V este volumul celulei sau, mai exact, volumul de apă din celulă), și împărțind la acest flux, rezultând pentru o celulă bacteriană (r≈1 μm) o scară de timp:
t =V-cin/p-A-cin =(4πr3/3)/(4πr2-3×10-6 cm/s) ≈ 10 s.
Aceasta este o estimare rudimentară, deoarece nu am luat în considerare scăderea concentrației de cin cu timpul, care va da un factor de corecție de 1/ln(2), adică o creștere de mai puțin de 2 ori. Ceea ce aflăm din aceste estimări este că, dacă intermediarii glicolitici gliceraldehidă sau dihidroxiacetonă, care sunt foarte asemănători cu glicerolul, nu ar fi fosforilați, ceea ce duce la adăugarea unei sarcini, aceștia s-ar pierde în mediu prin difuzie prin membrana celulară. În mediile de laborator, în care o sursă de carbon este furnizată din abundență, acest lucru nu reprezintă o problemă majoră, dar într-un mediu natural în care celulele așteaptă adesea în faza staționară un impuls norocos de nutrienți (E. coli se crede că trece prin luni de zile fără creștere după ce este excretată din organism înainte de a găsi o nouă gazdă), celula își poate limita pierderile asigurându-se că intermediarii metabolici sunt marcați cu o sarcină care îi va împiedica să traverseze din nou bariera prezentată de bistratul lipidic.





.