Acestea sunt notițe de la lecția 4 a cursului de biologie celulară de la Harvard Extension.
Calea secretorie se referă la reticulul endoplasmatic, aparatul Golgi și veziculele care se deplasează între acestea, precum și la membrana celulară și la lizozomi. Este numită „secretorie” pentru că este calea prin care celula secretă proteine în mediul extracelular. Dar, ca de obicei, etimologia nu spune decât o parte din poveste. Această cale procesează, de asemenea, proteinele care vor fi legate de membrană (fie în membrana celulară, fie în membranele ER sau Golgi propriu-zise), precum și enzimele lizozomiale și, de asemenea, orice proteine care își vor trăi viața în calea secretorie propriu-zisă. De asemenea, face și alte lucruri în afară de procesarea proteinelor.
Citosolul și „lumenul” (lichidul care umple calea de secreție) sunt medii chimice diferite și, în mod normal, nu se amestecă niciodată. Citosolul este reductiv (când ești în citosol, tot întâlnești molecule care vor să-ți ofere electroni), iar ER, Golgi și mediul extracelular sunt oxidative (moleculele tot vin la tine cerând electroni). Consultați redox dacă sunteți încă confuz. Acest lucru determină condiții diferite de pliere a proteinelor: de exemplu, legăturile disulfidice se formează, de obicei, numai în condiții oxidative. În plus, diferite proteine pot trăi doar în calea secretorie sau doar în citosol. Calea secretorie oferă celulei o cale prin care să se ocupe de lucruri pe care nu ar fi bine să le aibă în citoplasmă și/sau care sunt mai utile atunci când sunt ținute concentrate într-un compartiment specializat cu partenerii lor de interacțiune doriți. Hepatocitele (în ficat) sechestrează medicamente și toxine în ER neted și le descompun pentru a fi excretate din organism acolo. Calea secretorie nu este contiguă, dar fiecare mișcare între componentele sale are loc în mici microcosmosuri cu bule ale propriei sale lumi chimice, numite vezicule.
Multe proteine care trec prin calea secretorie nu ating niciodată citosolul – cu excepția părților de proteine membranare care ies în afară pe partea citosolică. Multe dintre ele au nevoie de chaperoni care să le ajute la pliere și/sau de o serie întreagă de modificări post-traducționale pentru a fi pregătite pentru funcția lor nativă, iar calea secretorie este specializată în a le oferi toate acestea.
Prelegerea de astăzi se va concentra pe modul în care proteinele sunt traduse în ER și pe modul în care acestea călătoresc (în vezicule) între ER, Golgi și alte destinații. Acest lucru este frumos descris în videoclipul Life of the Cell:
Reticulul endoplasmatic este primul pas în calea secretorie. Membrana sa este continuă cu membrana nucleară externă, deși nu este clar de ce contează acest lucru, deoarece nu este ca și cum proteinele își încep viața în nucleu. Mai degrabă, ARNm plutesc în derivă în citoplasmă până când sunt preluate de un ribozom interesat să le traducă. În „translocația posttranslațională”, noua proteină este mutată în ER după ce a fost tradusă. În cazul fenomenului mai interesant numit „translocație cotraslațională”, ribozomul începe traducerea la fel ca orice altă proteină, dar undeva între primii 16 și 30 de aminoacizi întâlnește o peptidă semnal (cunoscută și ca secvență semnal). Motivul acelui semnal este adesea 1 aminoacid încărcat pozitiv urmat de 6-12 aminoacizi hidrofobi. Acest motiv este recunoscut de particula de recunoaștere a semnalului (SRP, o „ribonucleoproteină” sau o moleculă hibridă ARN/proteină) care se leagă de el și împiedică ribozomul să continue traducerea. Traducerea este oprită până când complexul ribozom/SRP întâlnește un receptor SRP pe membrana ER. Atunci când se întâlnesc, SRP și receptorul său se leagă fiecare de câte o moleculă de GTP în membrana ER, ceea ce aparent le întărește interacțiunea. În mod fortuit, toate acestea se întâmplă adiacent unui transloccon Sec61 – un complex de proteine care formează un canal care traversează membrana ER. Transloconul este, de fapt, un complex format din trei proteine diferite (genele: SEC61A1 sau SEC61A2, SEC61B, SEC61G), dintre care subunitatea Sec61a are 10 helice A care se întind pe membrană și care formează canalul. Odată ce ribozomul este andocat la membrană, acesta continuă traducerea, împingând peptida semnal și, în cele din urmă, întreaga proteină prin canal în lumenul ER. Când traducerea se oprește, SRP și receptorul SRP își hidrolizează amândoi GTP-ul pentru a se elibera reciproc și pentru a elibera încărcătura ribozomului (acest lucru trebuie să necesite energia GTP-ului, deoarece legarea inițială a fost descendentă), o peptidază de semnal scindează peptida de semnal de pe proteina nativă, iar proteina este liberă să înceapă să se plieze în ER.
În cazul unor proteine ER mai sunt implicați și alți câțiva actori. Oligozaharide transferaza, care adaugă grupări glicozilice la asparaginele din proteina nazală, face parte din complexul translocon și realizează de fapt glicozilarea în timp ce noua proteină este încă în curs de traducere. Așadar, deși numim glicozilarea o „modificare post-translațională”, în acest caz, ea este de fapt efectuată în timpul traducerii. De asemenea, pentru a obține o structură adecvată, unele proteine trebuie să fie traduse complet înainte de a li se permite să înceapă să se plieze – dacă porțiunea N-terminală ar fi fost lăsată să înceapă să se plieze imediat ce a intrat în lumen, ar fi ajuns să aibă o structură generală greșită. Pentru a preveni acest lucru, uneori BiP, chaperonul, se leagă de proteină pentru a o menține desfășurată pentru o perioadă de timp. Imaginați-vă BiP ca un alt Pac-Man care mușcă proteina pentru a o menține liniară, precum Hsc70 în procesul de direcționare mitocondrială (vezi săptămâna trecută).
Iată un filmuleț video:
Primile două minute arată scenariul de bază descris mai sus. Apoi se trece la un scenariu mai complex pe care îl voi prezenta într-un minut. Pentru informarea dumneavoastră, videoclipul prezintă două lucruri „controversate” care nu sunt incluse în descrierea de mai sus: (1) peptida de semnal care este degradată în membrană și (2) o „proteină dop” care blochează canalul înainte/după traducere. Nu toți oamenii de știință sunt încă de acord cu privire la aceste două lucruri.
Toate proteinele despre care știm că trec prin calea secretorie au fost localizate acolo de către oameni care fac experimente de localizare pentru a vedea în ce parte a celulei se află o proteină. Un fapt ciudat despre ER este că puteți pune celula într-un blender și după aceea ER va începe pur și simplu să se reconecteze la el însuși, formând mici „microsome” care nu sunt atașate de nucleu, ci formează bule contigue de ER. Apoi puteți începe să vă jucați cu proteaze – care descompun proteinele – și cu detergenți – care solubilizează membrana ER. Presupunând că proteina care vă interesează este tradusă, puteți verifica dacă aceasta (1) supraviețuiește tratamentului cu protează, dar (2) nu supraviețuiește tratamentului cu protează + detergent, atunci este o proteină din calea secretorie. Logica este că în cazul (1) a fost protejată în interiorul ER, dar în cazul (2) ați dizolvat ER, deci a fost mâncată de protează. Toate acestea presupun că aveți un anticorp sau o altă modalitate de a detecta dacă proteina de interes se află acolo după aceste tratamente.
Oamenii au folosit astfel de tehnici și pentru a-și da seama că doar 70 de aminoacizi dintr-o nouă proteină pot fi traduși înainte de a deveni prea târziu pentru ca acea proteină să ajungă în ER. Amintiți-vă, peptida semnal se află în primii 16-30 de aminoacizi, iar translocarea în ER depinde de prezența SRP. Ribozomii traduc într-un ritm previzibil, așa că oamenii au pus ribozomii să înceapă traducerea unor ARNm și apoi au așteptat anumite perioade de timp înainte de a adăuga SRP, pentru a vedea cât de multă traducere poate avea loc înainte ca SRP să nu-și mai poată face treaba.
Receptorul SRP și proteinele Sec61 sunt proteine ale membranei ER – și există multe alte proteine ale membranei ER, ale membranei Golgi și ale membranei lizozomului, de asemenea. De fapt, chiar și proteinele membranare (a se vedea clasa 02) ale membranei celulare sunt procesate în calea secretorie. Multe dintre acestea au mai multe sau zeci de domenii transmembranare (20-25 de aminoacizi hidrofobi fiecare) care trebuie să fie inserate în ordinea și orientarea corectă (de exemplu, doriți cu adevărat ca canalele și transportorii de ioni să fie îndreptați în direcția corectă, în interiorul vs. în exteriorul celulei). În consecință, există o grămadă de mecanisme biologice sofisticate pentru ca aceste proteine să fie inserate corect în membrană. Aceasta este ceea ce descrie a doua jumătate a videoclipului de mai sus.
Atunci iată o tautologie: unele proteine au o secvență topogenică ce determină orientarea lor în membrană. Această secvență este alcătuită din două tipuri de secvențe de semnal:
- o secvență de stop-transfer (abreviată STA dintr-un motiv oarecare) este o secvență de 22-25 de aminoacizi hidrofobi undeva în mijlocul proteinei care formează o alfa-helix. Atunci când este întâlnită, aceasta este împinsă în membrană, iar apoi traducerea restului proteinei continuă în citosol. Deci, acest lucru „anulează” într-un fel translocarea către ER care a fost inițiată de peptida semnal de la începutul (terminația N) proteinei.
- o secvență de ancorare a semnalului (abreviată SA) este, de asemenea, un alpha helix hidrofob de 22-25aa, dar cu o serie de ~3 aminoacizi încărcați pozitiv în stânga sau în dreapta sa. Ca și peptida semnal, aceasta este recunoscută de SRP, care aduce ribozomul la ER. Dar, spre deosebire de peptida semnal, această secvență alfa elicoidală va fi inserată în membrana ER. Orientarea inserției este determinată de cei 3 aminoacizi încărcați pozitiv. Încărcăturile pozitive trebuie să ajungă întotdeauna pe partea citosolică, astfel încât, dacă vin după secvența hidrofobă (adică C-terminală), proteina se termină cu extremitatea sa C terminală îndreptată spre citosol, dar dacă vin înainte (adică N-terminală) de secvența hidrofobă, proteina se termină cu extremitatea sa N terminală îndreptată spre citosol.
Cu aceste două semnale ca blocuri de construcție, vă puteți imagina o proteină cu o serie de secvențe de transfer de oprire și de ancorare a semnalului pentru a crea o serie întreagă de domenii transmembranare înainte și înapoi cusute în membrană ca și cum ar fi fost cusute de o mașină de cusut. Oamenii au clasificat proteinele membranare în cinci categorii:
- Tipul I are doar o peptidă semnal și apoi un transfer de oprire în mijloc. Prin urmare, sfârșește cu terminația N (hidrofilă) în lumen, cu mijlocul (hidrofob) în membrană și cu terminația C (hidrofilă) în citosol.
- Tipul II nu începe cu o peptidă semnal. El începe ca orice altă proteină, dar în mijloc are o secvență de ancorare a semnalului, cu aminoacizii +++ venind mai întâi și seria hidrofobă după. Acest lucru face ca proteina să fie translocată la jumătatea traducerii, partea N-terminală deja tradusă ieșind în citosol (deoarece +++ trebuie să rămână citosolică) și partea C-terminală care începe să fie tradusă fiind tradusă direct în ER. Astfel, se termină transmembranar, cu terminalul C în RE și terminalul N în citosol – opusul tipului I.
- Tipul III este ca tipul II – fără peptidă semnal, doar cu o ancoră semnal în mijloc, dar în acest caz +++ vin după secvența hidrofobă, ceea ce inversează orientarea. Astfel, acesta ajunge să aibă extremitatea N în ER și extremitatea C în citosol. Opusul tipului II și, în cele din urmă, la fel ca tipul I, deși a ajuns acolo într-un mod diferit – nu are o peptidă semnal care să fie scindată în ER.
- Proteinele de tip IV sau „multipass” au o serie alternantă de secvențe semnal și secvențe de transfer de oprire. Acestea sunt în mod clar mai mult de un „tip”, dar nu sunt nici pe departe atât de diverse pe cât v-ar permite imaginația dumneavoastră combinatorică. Orientarea primei secvențe de semnal determină dacă extremitatea N terminală va ajunge în citosol sau în ER, iar numărul total de secvențe de transfer de oprire + secvențe de ancorare a semnalului determină unde va ajunge extremitatea C terminală: un număr par = aceeași parte ca și extremitatea N terminală, un număr impar = partea opusă ca și extremitatea N terminală. Secvențele STA și SA trebuie să alterneze strict, cu excepția faptului că se poate începe cu două secvențe de ancorare a semnalului dacă prima este orientată cu terminația N în citosol. Doar pentru a-și bate joc de această schemă de clasificare, oamenii au definit câteva subtipuri incomplet definite ale tipului IV, în care tipul IVa este N-terminal în citosol (deci începe ca o proteină de tip II) și tipul IVb este N-terminal în lumen (începe ca o proteină de tip III, dar apoi are o altă secvență SA care o readuce în ER). GLUT1 din clasa 02 este o proteină de tip IVa.
- Proteinele ancorate în GPI, care sunt al cincilea tip, dar nu se numesc de tip V, încep cu o peptidă semnal și se termină cu un C-terminal hidrofob care rămâne încorporat în membrană. Acest capăt hidrofob este despicat și înlocuit cu GPI, care rămâne, de asemenea, încorporat în membrană. PrP este una dintre acestea – mai multe despre asta mai târziu.
Până acum am discutat despre modul în care proteinele pot sfârși în lumenul ER sau traversând membrana ER. Majoritatea proteinelor părăsesc ER în câteva minute, fiind transportate în vezicule destinate Golgi și apoi, mai târziu, excreției, lizozomilor sau membranei celulare. Această direcție de deplasare înainte se numește anterogradă; mersul înapoi de la Golgi la ER este transport retrograd.
Ambele tipuri de transport au loc în vezicule legate de membrană. Acestea se desprind din membrana locului de unde vin și, mai târziu, fuzionează cu membrana locului spre care se îndreaptă – frumos descrisă la ~2:25 în videoclipul Life of the Cell de mai sus. Corpul din care se formează veziculele este „compartimentul donator”, iar destinația în care fuzionează ulterior este „compartimentul acceptor”.
Procesul de înmugurire necesită ca proteinele G din membrană să recruteze proteinele Coat. Mai exact, pentru transportul anterograd, proteina G Sar1 (gena: SAR1A) recrutează COPII („cop doi”); pentru transportul retrograd, o proteină G ARF recrutează COPI (pronunțat „cop unu”). Aceste proteine G sunt activate pentru a face această treabă atunci când GEF le încarcă cu GTP, înlocuind GDP.
Așa că etapele transportului anterograd, de exemplu, sunt următoarele:
- Sec12-GEF (Sec înseamnă secretor) încarcă Sar1 cu GTP. Când este legat de GDP, Sar1 doar plutește în jurul compartimentului donator, dar când este legat de GTP, suferă o modificare conformațională care face ca coada sa hidrofobă N-terminală, altfel îngropată, să iasă în afară, făcându-l să se lipească în membrană, unde proteinele COPII încep apoi să se acumuleze pentru că le place foarte mult acea coadă.
- POPII-urile încep să se polimerizeze și, datorită conformației sale, au o preferință intrinsecă pentru curbură, astfel încât acumularea lor începe să facă să se producă budding-ul. În același timp, proteinele legate de membrană care trebuie să fie transportate – identificate printr-o secvență de aminoacizi DXE (adică aspartat – orice-glutamat) care formează un situs de legare în partea lor citosolică – sunt recrutate în vezicula nou formată. Proteinele legate de membrană acționează ca niște receptori, recrutând proteinele lumenale care sunt legate pentru Golgi să stea în spațiul concav unde vor ajunge în vezicula odată ce aceasta se formează.
- După ce au sosit suficiente COPII, vezicula se desprinde, moment în care Sar1 își hidrolizează GTP-ul, furnizând energia necesară pentru a-și aspira coada hidrofobă înapoi în ea însăși, tăind COPII-urile. Vezicula este acum deconectată de la compartimentul donator.
- Acum, din motive prost explicate (sau prost înțelese?), învelișul COPII-urilor pur și simplu se dezasamblează, expunând receptorii de sub înveliș care direcționează direcționarea veziculei. Odată ce vezicula ajunge la destinație, Rab-GTP încorporat în membrana veziculei interacționează cu un efector Rab încorporat în membrana compartimentului acceptor. Se face un schimb de priviri, se stârnește interesul. În curând vezicula va fuziona cu membrana.
- Proteinele SNARE prezente atât pe veziculă, cât și pe membrana țintă (V-SNARE și, respectiv, T-SNARE) interacționează pentru a aduce membranele și mai aproape. În acest exemplu, vom considera că VAMP (genele VAMP_) este V-SNARE, iar Syntaxin (genele STX__) și SNAP25 (gena SNAP25) sunt T-SNARE. Syntaxin și SNAP25 sunt ambele proteine de membrană; Syntaxin are 1 helix alfa, iar SNAP25 are 2, toate pe partea citosolică. Elicele alfa conduc interacțiunea cu VAMP. Elicele alfa ale părților opuse au o afinitate extrem de puternică una pentru cealaltă, aducând membranele suficient de aproape pentru a fuziona. Odată ce acest lucru s-a întâmplat, pentru a separa din nou V-SNARE-urile și T-SNARE-urile este nevoie de două proteine: NSF (gena: NSF; înseamnă factor sensibil la NEM) și alfa-SNAP (gena: NAPA), o proteină solubilă de atașare a NSF. NSF este o ATPază și arde ATP pentru a conduce dezasamblarea energetică ascendentă a complexului.
Acum pentru transportul retrograd. De ce există transport retrograd? Iată o listă neexhaustivă a câtorva motive:
- Câteva proteine membranare își încep viața în RE, trebuie să fie modificate în Golgi, dar apoi trebuie să se întoarcă în RE. Ele fac acest lucru cu o secvență de aminoacizi KKXX.
- Există, de asemenea, o secvență de aminoacizi KDEL la terminația C a unor proteine lumenale care se presupune că le menține în ER, dar nu este perfectă – uneori ajung în Golgi, caz în care sunt direcționate înapoi în ER prin transport retrograd dependent de acea secvență KDEL pentru recunoaștere. Mecanismul este destul de frumos – proteinele care recunosc și se leagă de KDEL fac acest lucru numai la un pH scăzut, iar pH-ul Golgi este mai mic decât cel al RE, așa că ele se leagă de KDEL în Golgi, apoi îl eliberează atunci când se întorc în pH-ul mai neutru al RE.
- De asemenea, gândiți-vă, toate proteinele care participă la transportul anterograd – V-SNARES, Rab, etc. – trebuie să se întoarcă în ER pentru a o putea face din nou, la fel cum autobuzul trebuie să se întoarcă la depoul de autobuze la sfârșitul zilei.
- După cum vom vedea în curând, Golgi vine în mai multe etape care depind de adăugarea de enzime din aval.
Procesul de transport retrograd nu este atât de diferit de cel anterograd. El folosește ARF în loc de Sar1, COPI în loc de COPII, dar funcționează la fel: ARF încărcat cu GTP își lasă coada hidrofobă să se lipească în membrană, atrăgând atenția COPI-urilor. COPI are două componente, COPIalpha și COPIbeta, ambele interacționând cu acea secvență KKXXX pentru a recruta proteine legate de membrană destinate transportului retrograd. Unele proteine au, de asemenea, o secvență RR (oriunde în proteină) care le poate marca pentru transportul retrograd.
Aparatul Golgi nu este contiguu. Este un set stivuit de subcompartimente separate numite saci sau cisterne. Diferitele compartimente au proprietăți diferite și proteinele le vizitează într-o anumită ordine. În ordine, de la ER la membrana celulară, compartimentele Golgi se numesc rețea cis, medială, trans și trans-Golgi. Fiecare compartiment are diferite enzime care modifică proteinele, iar modificările trebuie să aibă loc într-o anumită ordine, de unde și necesitatea unui set de compartimente suprapuse.
Dar, pe măsură ce proteinele se maturizează în Golgi, nu este ca și cum ar ieși în vezicule dintr-un compartiment și s-ar muta în următorul. Mai degrabă, compartimentul în care se află deja se deplasează spre exterior și se „maturizează” pe măsură ce noi enzime sunt adăugate în el (de mai jos în lanțul Golgi) prin transport retrograd. Ciudat, nu-i așa? Este ca și cum, în loc să te muți de la o școală primară la o școală gimnazială și apoi la un liceu, ai rămâne într-o singură clădire școlară pe toată durata copilăriei și a adolescenței, iar în fiecare an se aduc manuale și profesori noi, pentru a fi în concordanță cu clasa la care tu și colegii tăi ați ajuns. Iată cum arată Golgi în timp ce se mișcă și evoluează:
Atunci nu există (puțin sau) deloc transport anterograd în Golgi, dar există o mulțime de transport retrograd pentru a aduce fiecare nouă rundă de enzime. Când proteinele au finalizat în cele din urmă întregul curriculum K-12 al rețelei Golgi, ele sunt supuse unui transport pentru a trece la destinația lor finală. Ele se desprind într-o veziculă care va merge într-unul din cele trei locuri:
- Exocitoza – fuziunea cu membrana celulară. Astfel, proteinele lumenale vor fi secretate extracelular, iar proteinele membranare vor deveni proteine ale membranei celulare.
- Vezicule secretorii – acestea rămân pur și simplu ca vezicule în celulă până când este nevoie de ele – unde „nevoie” înseamnă că în cele din urmă vor fi supuse exocitozei. La neuroni, acesta este locul unde sunt depozitați neurotransmițătorii până când un potențial de acțiune cere secreția lor în sinapsă. În stomac, celulele care produc enzimele gastrice păstrează aceste enzime în vezicule secretorii până când aportul alimentar declanșează eliberarea lor în stomac.
- Lizozomii – unde proteinele prost pliate ajung pentru a fi degradate.
Transportul din rețeaua trans-Golgi către aceste destinații este diferit de celelalte transporturi discutate mai sus și implică adesea clatrina (genele CLT__). Veziculele care înmuguresc au un înveliș cu două straturi, cu complexe de proteine adaptoare (AP) ca strat interior și clatrină ca strat exterior. Proteinele adaptoare au un semnal țintă cu un motiv YXXh (h = Φ = orice aminoacid hidrofob). Clathrina formează așa-numita formațiune „clathrin-triskelion”, prezentată aici:

(Imagine mulțumită utilizatorului Wikimedia Commons Phoebus87)
Clathrina este, de asemenea, responsabilă pentru endocitoză – dezmembrarea veziculelor de materiale extracelulare (și proteine ale membranei celulare) pentru a ajunge în celulă. Aceasta se numește endocitoză mediată de clatrină. Receptorii din membrana celulară sunt endocitați foarte frecvent: întreaga populație de receptori hormonali se schimbă cam la fiecare oră, în special atunci când se primesc hormoni. Preluarea receptorului într-o veziculă este o modalitate prin care celula taie semnalul primit până când acesta poate fi procesat.
Notele despre membrana plasmatică discută pe scurt despre fibroza chistică: CFTR este un transportor ABC responsabil de pomparea Cl- în afara celulei (lasă să intre și Na+). Mutanții cu pierdere de funcție nu pompează Cl-, ceea ce înlătură forța motrice a osmozei, îngroșând mucusul și provocând probleme de respirație. Există cel puțin 127 de mutanți CFTR cu pierdere de funcție diferiți (cel puțin, acesta este numărul de mutanți pentru care Natera face teste) care (dacă ambele alele sunt dezactivate) provoacă fibroză chistică. Cea mai frecventă mutație este ΔF508, care reprezintă ~3% din toate alelele CFTR europene și aproximativ 70% din cele mutante. Pierderea acelei singure fenilalanine schimbă conformația CFTR astfel încât codul de ieșire di-acidă (aminoacizii D565 și D567) care direcționează CFTR pentru veziculele exocitotice nu mai este expus corect și proteina nu ajunge niciodată la membrana celulară .
secțiune de discuție
În secțiune citim Hu 2009, care a arătat că proteinele atlastin sunt implicate în crearea rețelei tubulare ER. Dovezile au provenit aproape în întregime din interacțiunile proteină-proteină. Am fost surprins că această lucrare a fost un lucru important, deoarece au existat un milion de lucrări care au arătat interacțiuni proteină-proteină pentru huntingtină și nimeni nu le crede cu adevărat pe toate și nu ne-au adus neapărat mai aproape de a ști ce face huntingtina sau ce merge prost în boala Huntington. Dar se pare că Hu a reușit să demonstreze destul de clar că interacțiunile atlastinelor cu reticulonii implică un rol în formarea ER. Ajută faptul că Hu a reușit să demonstreze o „interacțiune genetică” în plus față de o interacțiune fizică (de legare). O „interacțiune genetică” (a trebuit să o caut) înseamnă atunci când „Uneori, mutațiile în două gene produc un fenotip care este surprinzător în lumina efectelor individuale ale fiecărei mutații. Acest fenomen, care definește interacțiunea genetică, poate dezvălui relații funcționale între gene și căi.” .
PrP
Aceasta este veche de un deceniu, astfel încât unele lucruri pot fi depășite, dar am găsit revizuirea lui Harris 2003 (ft) a biologiei celulare PrP extrem de clară și utilă. Kim & Hegde 2002 a fost, de asemenea, util. PrP este o proteină a căii secretorii. Primii săi 22 de aminoacizi (MANLGCWMLVLFVATWSDLGLC) sunt o peptidă semnal care determină translocarea cotraslațională în ER. În mod normal, PrP se leagă doar de GPI la extremitatea sa C și este ancorată pe partea exoplasmatică a membranei. Dar aminoacizii 111-134 (HMAGAAAAGAVVVGGLGGYMLGSAM) sunt un fel de secvență de ancorare slabă a semnalului (tip II, cu aminoacizii +++ venind înainte de ancorarea semnalului) care uneori, dar nu întotdeauna, devine un domeniu transmembranar, inversând terminația C în lumen. Chiar și mai derutant este faptul că această secvență poate sfârși uneori ca un domeniu transmembranar fără inversiune, astfel încât terminația N se află în lumen. Așadar, există trei topologii membranare ale PrP: vechea și obișnuita ancorare GPI și două orientări transmembranare, așa cum este descrisă în Harris 2003 Fig 3:
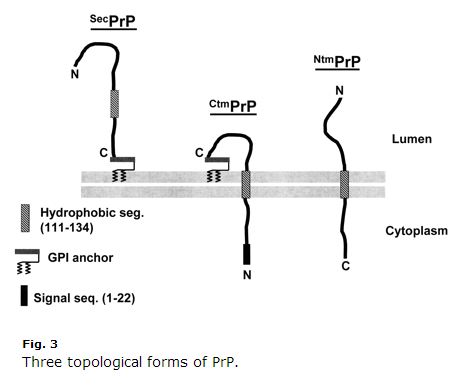
Rețineți cât de ciudat este CtmPrPrP. Este transmembranară, dar și ancorată în GPI, iar peptida semnal N-terminală nu este niciodată scindată. În mod normal, formele transmembranare reprezintă < 10% din totalul PrP. În unele condiții de laborator, procentul este mai mare, iar două dintre mutațiile care cauzează GSS (A117V și P105L) cresc, de asemenea, fracțiunea de CtmPrP la 20-30% din totalul PrP. Dintre aceste trei forme, există o cantitate bună de dovezi că CtmPrP este toxică și că ar putea juca un rol în formarea prionului, deși majoritatea mutațiilor genetice ale bolii prionice (inclusiv FFI D178N) nu par să afecteze topologia membranară a PrP sau fracțiunea de CtmPrP.
După ce PrP trece prin Golgi, ea este direcționată către membrana celulară. Dar, potrivit lui Harris, nu stă pur și simplu acolo – trece frecvent prin endocitoza mediată de clathrin și face cicluri prin celulă la fiecare ~60 de minute, unele molecule fiind scindate la fiecare ciclu. Cuprul stimulează această endocitoză a PrP. Majoritatea mutațiilor genetice ale bolilor prionice modifică localizarea PrP – de obicei, atunci când este prezentă o mutație, se găsește mai puțină PrP la suprafața celulară, acumulându-se mai multă PrP în ER.
.