După cum am văzut, dieta noastră include mulți carbohidrați și v-ați putea întreba dacă există o modalitate de a analiza o mostră pentru a spune dacă este zaharoză, sau unul dintre îndulcitorii sintetici, cum ar fi sorbitolul sau siropul de porumb cu conținut ridicat de fructoză, sau chiar un compus cum ar fi vitamina C, care este sintetizată din zaharuri și, ca și acestea, conține doar C, H și O. Există o astfel de modalitate, iar aceasta este una dintre cele mai importante forme fundamentale de analiză, numită analiză elementară. Este una dintre primele metode pe care le folosesc cercetătorii pentru a identifica un compus nou.
Până în acest moment am obținut toate raporturile stoichiometrice din coeficienții ecuațiilor chimice echilibrate. Cu toate acestea, formulele chimice indică, de asemenea, cantități relative de substanță, iar raporturile stoichiometrice pot fi derivate și din acestea. De exemplu, formula CO2 ne spune că, indiferent cât de mare este mostra de dioxid de carbon pe care o avem, vor exista întotdeauna 2 moli de atomi de oxigen pentru fiecare mol de atomi de carbon. Adică, din formula CO2 avem raportul stoichiometric
\
Am putea determina, de asemenea, că pentru CO2
\
\
\
(Reciprocele acestor rapoarte stoichiometrice sunt valabile și pentru CO2.)
Raporturile stoichiometrice derivate din formule în loc de ecuații sunt implicate în cel mai comun procedeu de determinare a formulelor empirice ale compușilor care conțin doar C, H și O. O cantitate cântărită din substanța care urmează să fie analizată este plasată într-un tren de combustie și încălzită într-un curent de O2 uscat. Tot H din compus se transformă în H2O(g) care este captat selectiv într-un tub de absorbție cântărit în prealabil. Tot C se transformă în CO2(g) și acesta este absorbit selectiv într-un al doilea tub. Creșterea masei fiecărui tub indică, respectiv, cât H2O și cât CO2 au fost produse prin arderea probei
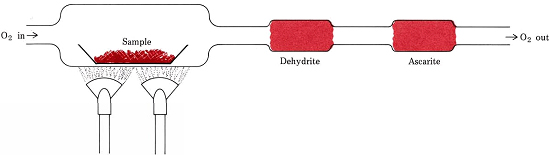
Figura \(\PageIndex{1}\) Un tren de ardere. H2O și CO2, produse prin combinarea O2 cu H și C în probă, sunt absorbite selectiv de tuburile care conțin Dehidrită și ascarit (NaOH pe azbest).
Exemplu \(\PageIndex{1}\): Formula empirică a acidului ascorbic
Un eșantion de 6,49 mg de acid ascorbic (vitamina C) a fost ars într-un tren de combustie. S-au format 9,74 mg de CO2 și 2,64 mg de H2O. Determinați formula empirică a acidului ascorbic.
Soluție Trebuie să cunoaștem cantitatea de C, cantitatea de H și cantitatea de O din probă. Raportul dintre acestea dă indicele din formulă. Primele două pot fi obținute din masele de CO2 și H2O folosind masele molare și raporturile stoichiometrice
\
\
Astfel
\
Compusul poate să fi conținut și oxigen. Pentru a vedea dacă da, calculați masele de C și H și scădeți din masa totală a probei
Acum avem
și
Ratele cantităților de elemente din acidul ascorbic sunt așadar
Din moment ce nC:nH:nO este 3 moli C:4 moli H:3 moli O, formula empirică este C3H4O3.
Aici este prezentat un desen al unei molecule de acid ascorbic. Puteți determina, numărând atomii, că formula moleculară este C6H8O6 – exact dublul formulei empirice. Este, de asemenea, evident că există mai multe lucruri de știut despre o moleculă decât doar câți atomi de fiecare fel sunt prezenți. În cazul acidului ascorbic, ca și în cazul altor molecule, modul în care atomii sunt conectați între ei și dispunerea lor în spațiul tridimensional sunt destul de importante. O imagine care arată ce atomi sunt conectați cu care se numește formulă structurală. Formulele empirice pot fi obținute din compoziția procentuală sau din experimentele cu trenul de combustie și, dacă se cunoaște greutatea moleculară, formulele moleculare pot fi determinate din aceleași date. Pentru a găsi formulele structurale sunt necesare experimente mai complicate. În exemplul 2, am obținut masa de O scăzând masele de C și H din masa totală a probei. Acest lucru a presupus că erau prezenți doar C, H și O. Uneori, o astfel de presupunere poate fi incorectă. Atunci când penicilina a fost izolată și analizată pentru prima dată, nu s-a observat faptul că aceasta conținea sulf. Această greșeală a fost descoperită abia după un timp, deoarece greutatea atomică a sulfului este aproape exact dublă față de cea a oxigenului. Doi atomi de oxigen au fost substituiți în locul unui atom de sulf în formulă.
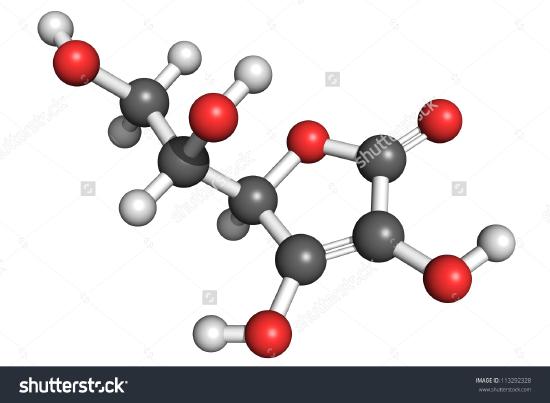
Figura \(\PageIndex{2}\) O reprezentare 3D a acidului L-ascorbic 1
De la ChemPRIME: 3.4: Analiza compușilor
.