Introducere
Poate prima referire din istoria omenirii la absorbția fierului și a alcoolului datează din anul 1200 î.Hr. o legendă din Tesalia povestește cum Apolodor de Iphycus, stând pe câmp și privindu-l pe tatăl său cum castrează mieii, a fost amenințat cu aceeași pedeapsă; când a devenit adult, Apolodorus a rămas impotent. Un vrăjitor pe nume Melampus, inspirat de un vultur, l-a vindecat pe Apolodorus făcându-l să bea într-un pahar de vin rugina cuțitului cu care tatăl său castra mieii și cu care fusese amenințat.
Numeroasă este populația de bolnavi alcoolici văzuți în spitalul nostru, precum și cei care necesită spitalizare, ținând cont de toate entitățile morbide care o însoțesc.
Scopul nostru prin această comunicare este de a reaminti una dintre patologiile hematologice prezente în alcoolism care poate retrograda adesea doar cu abstinența: anemia sideroblastică și hemosideroza.
Bjorkman a descris în 1956 patru pacienți cu anemii cronice refractare și inele sideroblastice cu colorație cu albastru de Prusia a celulelor măduvei osoase.
Prima dovadă că aceste inele sideroblastice sunt asociate cu alcoolul a fost propusă de Mac Gibbon și Mollin în 1965, de atunci alcoolismul a devenit cea mai frecventă cauză a acestei patologii.
În 1969 Hines (înlocuind i-ul cu 1) a descris în alcoolismul cronic apariția unei anemii sideroblastice reversibile datorate abstinenței.
Efectele alcoolului
Efectele patologice multiple ale alcoolului(a se înlocui cu 2) asupra țesutului hematopoietic pot fi împărțite în:
Cele care rezultă din efectul direct al alcoolului
Cele care rezultă din efectele secundare deficiențelor nutriționale
Cele cauzate de boli hepatice
Anemia este o cauză frecventă la alcoolici.(înlocuiți cu 3) Dintre acestea, cele mai frecvente sunt anemia megaloblastică și anemia sideroblastică.
Aceasta din urmă ar fi legată de factori nutriționali și de tulburări în metabolismul vitaminei B6.
A fost demonstrată o scădere a capacității piridoxinei de a se transforma în fosfat de piridoxal, forma activă a vitaminei B6, ca urmare a inhibării activității piridoxal fosfokinazei eritrocitare.
S-a sugerat, de asemenea, că etanolul poate acționa ca un stimulent al fosfatazei alcaline membranare prin accelerarea degradării fosfatului de piridoxal celular (a se înlocui cu 4). Această alterare a metabolismului piridoxinei este coroborată de o scădere a excreției urinare a acidului piridoxic 4-piridoxic, care este un metabolit al piridoxinei, și de o scădere a fosfatului de piridoxal seric.
Fosfatul de piridoxal acționează, de asemenea, ca un factor adjuvant în sinteza acidului delta-aminolevulinic, care este unul dintre precursorii fracțiunii de hemoglobină care conține fier, adică haemo.
Alte studii au arătat că etanolul acționează nu numai direct, ci și prin metabolitul său acetaldehida. Acetaldehidei i s-a atribuit, de asemenea, creșterea degradării fosfatului de piridoxal, ceea ce duce la o scădere a fosfatului de piridoxal seric și la înrăutățirea formării fosfatului de piridoxal în globulele roșii umane in vitro prin accelerarea degradării compușilor fosforilați ai vitaminei B6.
Când se folosesc metode de colorare a fierului (colorația cu albastru de Prusia și cu perle), granulele metalice care nu conțin fier hematic, probabil sub formă de hemosiderină sau feritină, tind să formeze un inel în jurul nucleului eritroblastelor. Acestea se numesc inele sideroblastice sau sideroblaste inelare.
Microscopia electronică a arătat că aceste sideroblaste au depozitele de fier la nivelul mitocondriilor sau al corpurilor citoplasmatice.
Aceste anomalii morfologice sunt asociate cu toate caracteristicile eritropoiezei ineficiente: hiperplazie eritroidă, absorbție crescută a fierului de către precursorii eritroizi din măduva osoasă, încorporare subnormală a fierului în hemoglobina circulantă cu reflux de fier în circulație, ceea ce determină hiperferremie, distrugerea intramarfă a normoblastelor, anemie și reticulocitopenie.
Frecvența inelului sideroblastic în măduva eritroidă este mai frecventă la bolnavii cronici și la pacienții alcoolici malnutriți.
Dovezile clinice și experimentale sugerează că un factor nutrițional este important în patogeneza anemiei sideroblastice la pacienții alcoolici.
Administrarea cronică experimentală de alcool la voluntari umani a produs modificări sideroblastice în măduva osoasă.
Când alcoolul a fost administrat cu o dietă săracă în piridoxină și folat, inelele de
sideroblaste s-au dezvoltat după câteva săptămâni la majoritatea subiecților studiați.
În 1970, Hines și Cowan menționează o alterare a fosforilării piridoxinei în fosfat de piridoxal, confirmând astfel tulburarea metabolismului piridoxinei prin trei linii de investigație:
Diminuarea fosfatului de piridoxal și a inelelor sideroblastice au fost produse la 2 din 3 subiecți care au fost menținuți cu diete sărace în folat cu suplimentarea cu alcool. Aceștia au prezentat apoi un răspuns hematologic în urma administrării de fosfat de piridoxal, dar nu și în cazul acidului folic sau al terapiei cu piridoxină.
În urma administrării de piridoxină la alcoolicii bolnavi cronic, există un deficit de formare a fosfatului de piridoxal în comparație cu martorii.
Ei descriu o reducere in vitro a conversiei piridoxinei în fosfat de piridoxal de către o enzimă eritrocitară la subiecții alcoolici. Acest lucru duce la postularea suprimării directe a piridoxinei fosforilazei eritrocitare de către alcool. Cu toate acestea, o explicație alternativă pentru scăderea fosfatului de piridoxal sugerează că acetaldehida, principalul metabolit al alcoolului, stimulează activitatea fosfatazei membranare și reduce, de asemenea, cantitatea de fosfat de piridoxal transferată de la globulele roșii la compartimentul plasmatic.
Cu toate acestea, indiferent de mecanism, rezultatul este același, toate conducând la o creștere a cantității de Fe conținută în eritroblaste (sideroblaste)
Sideroblastoza presupune o slabă încorporare a fierului în globulele roșii, ceea ce duce la hipocromie, eritropoieză ineficientă și sideremie crescută.
Hemosideroza la alcoolici(a se înlocui cu 5) O mare varietate de cauze de supraîncărcare cu fier la alcoolici au fost implicate singure sau împreună, inclusiv creșterea semnificativă a fierului din unele băuturi alcoolice (în special vinuri), creșterea secreției gastrice de acid clorhidric gastric indusă de etanol, hemoliză, pierderi de sânge gastro-intestinale, deficit de acid folic, absorbție intestinală crescută datorită leziunilor hepatice și leziunilor pancreatice, ceea ce crește și mai mult sideremia și duce la hemosideroză.
Diverse studii documentează niveluri crescute ale feritinei serice la pacienții alcoolici, reflectând creșterea depozitelor de fier.
După administrarea de chelatori de fier, cum ar fi desferroxamina, și măsurarea ulterioară a sideruriei, depozitele de fier pot fi evaluate semicantitativ. La alcoolici excreția de fier după acești chelatori este, de asemenea, crescută în raport cu martorii.
Cu toate acestea, alte studii arată la pacienții alcoolici spitalizați că atât concentrațiile serice de fier și/sau feritină sunt în limite normale sau mai rar ridicate. Aceste diferențe se pot datora alegerii pacienților incluși în studiu; dacă pacienții au hemoragii gastrointestinale din cauza varicelor esofagiene, este posibil ca aceștia să aibă rezervele de fier epuizate, chiar dacă înainte de hemoragie acestea erau peste nivelul normal.
În cele din urmă, trebuie remarcat faptul că în majoritatea studiilor efectuate pentru măsurarea fierului seric, acestea s-au dovedit a fi întotdeauna ridicate la alcoolici, existând o corelație între depozitele de fier și cantitatea de alcool consumată, ceea ce sugerează că acest element este cauza siderozei.
Absorbția fierului
Aproximativ 5 până la 15 mg de fier ingerat zilnic, doar 10% este absorbit.
Factorii care influențează absorbția fierului pot interveni la trei niveluri: intraluminal, mucosal și general.
La nivel intraluminal, se știe că absorbția fierului depinde de interacțiunea diferitelor alimente, astfel încât unele, cum ar fi aminoacizii, facilitează absorbția, iar altele o pot diminua. Absența secrețiilor digestive poate fi un factor care modifică absorbția.
În încercarea de a explica hemosideroza, s-a crezut mai întâi că dieta bolnavilor alcoolici era foarte bogată în acest element. Această observație s-a bazat pe ceea ce se numește hemosideroză bantus sau hemosideroză bantus. Studiile efectuate de sud-africani asupra acestor triburi au constatat că o băutură preparată de aceștia, numită kefir, un fel de bere, era preparată în vase de fier, cu un conținut de fier cuprins între 30 și 100 mg la litru. Conținutul de alcool al băuturii era foarte scăzut, iar ei consumau cantități mari, până la 1000 mg de fier pe zi. Fabricarea chefirului nu se mai realizează, cu consecința dispariției hemosiderozei în acest trib.
Cantitățile de fier prezente în diferitele băuturi alcoolice sunt foarte variabile, ajungând în unele cazuri până la 350 mg pe litru (România), deși în general se poate considera că vinul (alb, claret sau roșu) este bogat în acest metal.
Dar există, de asemenea, mulți alcoolici a căror băutură principală nu este vinul, ci whisky-ul, berea sau altele, care conțin cantități neglijabile de fier.
Pe de altă parte, în ciuda studiului asupra banturilor, un exces de fier în alimentație nu este un motiv suficient pentru a dezvolta hemosideroză. Astfel, în Etiopia, baza alimentației este teff-ul, o sămânță care conține o cantitate mare de fier, cu un aport zilnic de 300 până la 500 mg din acest metal. În ciuda acestui aport, depozitele nu sunt crescute, iar frecvența anemiei prin deficit de fier nu diferă de cea a populației generale.
Este evident, deci, că cantitatea de fier din alimente nu are nicio valoare.
Până acum s-ar părea că alcoolul nu joacă nici un rol la nivel intraluminal în absorbția fierului.
La nivel general se știe că starea depozitelor de fier va condiționa absorbția acestora; dacă acestea sunt diminuate, absorbția crește și invers. Eritropoieza este, de asemenea, implicată la acest nivel, crescând absorbția sa atunci când crește. Alcoolul nu pare să accelereze transformarea fierului plasmatic, ceea ce ar putea explica creșterea absorbției acestuia.
La nivelul mucoasei, cantitatea de fier conținută în mucoasă, precum și nivelul de sinteză a proteinelor, pot influența absorbția fierului. S-a demonstrat că deficitul de acid folic în urma ingestiei de alcool poate fi responsabil de creșterea absorbției de fier și de sideroza ulterioară, care agravează efectele nocive ale alcoolului asupra parenchimului și mai ales asupra ficatului.
În studiile pe animale s-a demonstrat că administrarea cronică de alcool poate fi însoțită de o creștere a absorbției intestinale de fier, al cărei mecanism este necunoscut.
În ultimul deceniu au fost demonstrate cel puțin trei mecanisme implicate în translocarea fierului prin mucoasa duodenală:
Transportator mediat(reglementat)
Mecanism pasiv mediat de acizii grași neesterificați
Intrare paracelulară (nereglementată)
Studii in vivo și in vitro au arătat o permeabilitate intestinală crescută la alcoolicii cronici, oferind un posibil mecanism pentru absorbția intestinală a fierului.
Alte studii sugerează că ar putea exista o creștere a capacității intrinseci a mucoasei intestinale a pacienților alcoolici de a absorbi fierul.
S-a observat că la cei cu fier seric crescut, măsurătorile de fier au scăzut în prima săptămână de spitalizare cu dezvoltarea reticulocitelor. De asemenea, s-a observat că modificările sideroblastice au fost reversibile, în acord cu alți autori. Inelele caracteristice au dispărut din măduvă în prima săptămână de spitalizare, deși unele au persistat timp de 12 zile.
Recent(a se înlocui cu 6) au fost găsite niveluri serice crescute de asialotransferrină la pacienții cu alcoolism cronic; aceasta arată o capacitate crescută de eliberare a fierului către țesuturi, în special către hepatocite, în comparație cu variantele normale de transferrină.
S-a subliniat faptul că poate exista, de asemenea, o relație puternică între modificările sideroblastice și deficiențele de folat. Se sugerează că această deficiență poate fi precondiția necesară pentru exprimarea modificărilor sideroblastice la alcoolici, deși alți autori nu sunt de acord, deoarece, în ciuda anemiei pronunțate, aceștia nu au prezentat modificări megaloblastice în măduvă și nici macrocitoză sau hipersegmentare neutrofilică în sângele periferic, iar concentrațiile de folat seric și eritrocitar au fost normale.
Este important de menționat că la pacienții alcoolici, anemia bolilor cronice datorată tuberculozei, bolilor maligne sau insuficienței renale este adesea asociată cu anemia sideroblastică, care este foarte frecventă la această populație.
În rezumat, consumul de alcool împreună cu o dietă inadecvată este probabil să ducă la apariția anemiei sideroblastice și a hemosiderozei a căror patogenie nu este încă stabilită, iar factorii probabili includ:
Efectul toxic al alcoolului asupra uneia sau mai multor etape ale sintezei hematiilor.
Asociere cu o stare nutrițională deficitară care duce la depleția de fosfat de piridoxal și catabolism accelerat cauzat de acetaldehidă, boală hepatică sau ambele
Deficiență exacerbată de folat și în care retragerea și înlocuirea nutrițională joacă un rol major.
Caz clinic:
Un pacient de sex masculin în vârstă de 55 de ani s-a internat cu edeme ale membrelor inferioare (1/6 suprapatelare, 2/6 infrapatelare) și ale sacrului de consistență moale, distensie abdominală, paloare a mucoaselor cutanate, astenie și adinamie progresivă de trei luni.
Antecedente:
Alcoolism cronic (2 sau 3 litri de vin și/sau bere pe zi) și fumat (40 de țigări pe zi), ambele în ultimii 30 de ani.
Rezultatele studiilor efectuate pe secție:
Radiografie toracică: efracție de sinus costodiafragmatic drept. Indicele cardiotoracic ușor crescut.
Paracenteză: caracteristici exsudative.
Transfuzii: Din cauza HTO. este indicată transfuzia a 2 unități de hematii deplasmatizate.
Diagnostic prezumtiv:
Etiologie: etilism cronic. Fumător.
Pathofiziologic: sindromul ascitic-edematos. Sindromul ascitic-edematos. Sânge ascitic-edematos. Anemică. Efuziune pleurală. Insuficiență hepatică.
Anatomopatologic: Hepatomegalie. Cardiomegalie.
Rezultatele studiilor efectuate în timpul spitalizării:
FEDA: Gastrită cronică.
Colon clismă cu dublu contrast: tranzit intestinal păstrat.
Ecocardiogramă: Revărsat pericardic moderat.
Ecopleural: Revărsat pleural drept.
Ecoabdominal: Ficat compatibil cu ficat gras.
Serologie: negativ pentru VDRL, Chagas, Hepatita B și C.
PAMO și BMO: Măduvă osoasă cu dispoieză severă a seriei roșii.
Perls: se observă creșterea granulelor de fier intra- și extracelulare.
PBH: materialul obținut a fost slab reprezentativ pentru o concluzie diagnostică.
Laborator
Hematocrit (%): a variat de la 11.8 până la 19
Globule roșii (x10E12/l): a prezentat o variație de la 1,1 la 1,94
Globule albe (x10E9/l): a prezentat o variație de la 7,7 la 9.2
Hemoglobina (g/dL): a variat de la 4,4 la 6.8
Plachetele (x10E9/l): a variat de la102 la 346
Ferremia (mg/dl): a variat de la248 la 75
Feritina ( ng/dl): 594
TIBC (Total Iron Binding Capacity) (mg/dl): 360
Procentul de saturație a transferinei: a prezentat o variație de la 95 la 24
Bilirubina totală (mg/dl): a prezentat o variație de la 1.6 la 0,51
Bilirubina directă (mg/dl): a prezentat o variație de la 1,92 la 0,18
Bilirubina indirectă (mg/dl): a prezentat o variație de la 2,99 la 0,33
Tratament medical:
Dieta hiposodică și săracă în proteine. Restricție de apă.
PHP la 21 de picături pe minut alternativ. Albumină o fiolă în paralel la fiecare 8 ore, urmată de o fiolă de furosemid. Spironolactona un comprimat la fiecare 12 ore. Fitomenadionă (Konakion) o fiolă la fiecare 12 ore.
Lactuloză (Lactulon) o lingură la fiecare 6 ore. Complex de vitamina B un comprimat la fiecare 12 ore.
Datorită răspunsului bun al pacientului, se continuă tratamentul medical oral cu diuretice și complex B. Lactuloza și fitomenadionul au fost întrerupte.
Pacientul a prezentat o evoluție clinică favorabilă pentru starea sa ascitică edematoasă, motiv pentru care a fost externat, fiind medicat cu vitamina B și sfătuit să nu consume alcool.
Continuarea controlului său medical de către ambulatoriul Clinicii Medicale a Spitalului nostru și de către Serviciul de Hematologie al Spitalului Álvarez..
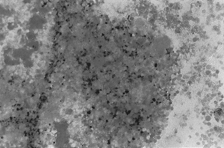
PAMO X 100
– Colorația Perls. Se remarcă o tumoare medulară cu depunere intensă de fier extracelular.
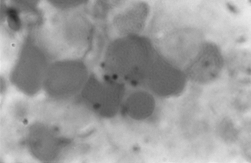
PAMO X 1000
– Colorație Perls. Se observă depunerea intraeritroblastică de fier.
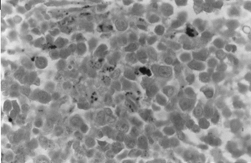
BMOX100
– Colorație Perls. În cazul în care se observă acumulări dense de fier intra- și extra-eritroblastic.
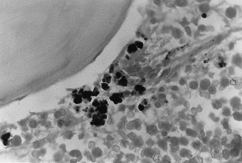
BMO X 1000
– Colorație Peris. În cazul în care se observă acumulări dense de fier intra- și extraroblastic.
Pacientul a avut o evoluție bună post-internare. La șaizeci de zile i s-a făcut o analiză de sânge cu următoarele rezultate: HTO 43%, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/zi, Plaq.354 X10E9/L, cu doar complianță la tratament.
După o sută douăzeci de zile a fost monitorizat din nou cu aceleași rezultate ale analizelor de sânge.
După o sută douăzeci de zile a fost monitorizat din nou cu aceleași rezultate ale analizelor de sânge.
După o sută douăzeci de zile a fost monitorizat din nou cu aceleași rezultate ale analizelor de sânge.
După o sută douăzeci de zile a fost monitorizat din nou cu aceleași rezultate ale analizelor de sânge.