Principiul cel mai general care guvernează puterea unui acid poate fi enunțat astfel: acizii puternici au baze conjugate relativ stabile. În general, cu cât baza conjugată este mai stabilă, cu atât acidul este mai puternic. Un lucru important de reținut este că stabilitatea și reactivitatea sunt inverse. Cu cât o substanță este mai stabilă, cu atât este mai puțin reactivă, și viceversa. Prin urmare, un alt mod de a enunța regula de mai sus este de a spune că acizii puternici au baze conjugate slabe. HCl și H3O+ sunt acizi puternici. În consecință, bazele conjugate corespunzătoare, Cl- și H2O, sunt slabe (foarte stabile). Ionul clorură este stabil deoarece sarcina negativă rezidă pe un atom foarte electronegativ. Molecula de apă este una dintre cele mai stabile substanțe cunoscute.
Cum putem ști care proton este cel mai acid într-o moleculă (cum ar fi acidul acetic) care conține mai multe tipuri de protoni? Amintiți-vă că, cu cât este mai mare gradul de caracter pozitiv al protonului, cu atât acesta este mai acid. Examinarea unui tabel pKa relevă unele tendințe pentru protonii acizi. Următoarele orientări pot fi folosite pentru a prezice aciditatea.
1. Hidrogenii atașați direct la atomi foarte electronegativi, cum ar fi oxigenul, sulful și halogenii, poartă un grad substanțial de aciditate.
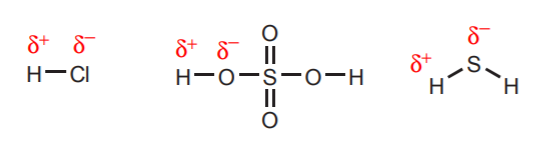
2. Hidrogenii atașați la un azot, oxigen sau sulf încărcat pozitiv sunt acizi. Electronegativitatea ridicată a acestor atomi îi face incomozi cu sarcina pozitivă. Ei caută să difuzeze sarcina între atomii vecini prin retragerea densității electronice de la aceștia. Acest lucru poate fi demonstrat prin desenarea structurilor de rezonanță, așa cum se arată.
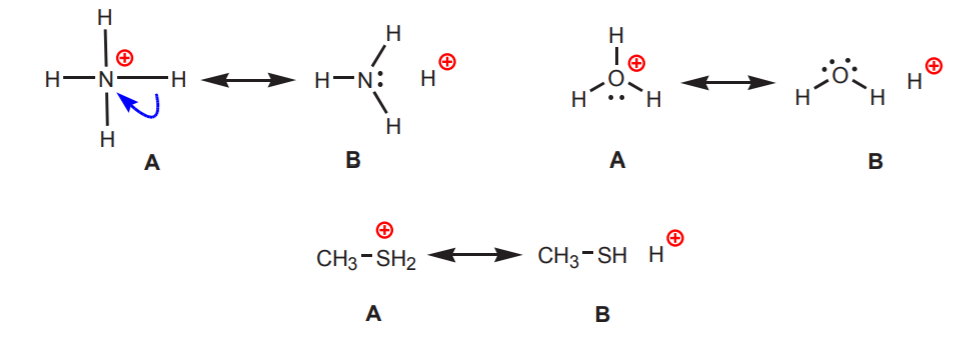
În toate cazurile, structura B relevă caracterul pozitiv al hidrogenului și, prin urmare, natura sa acidă.
3. Așa cum reiese din valorile pKa ale alcanilor și alchenelor, hidrogenii legați de carbon au o aciditate foarte scăzută. În mod normal, astfel de substanțe nu sunt considerate deloc acizi. Cu toate acestea, unele hidrocarburi pot fi slab acide dacă bazele lor conjugate sunt ioni stabili. Acest lucru se poate întâmpla în următoarele cazuri:
a) Există unul sau mai mulți atomi electronegativi în apropierea protonului considerat. Efectul de inducție al acestor atomi electronegativi lasă hidrogenii din vecinătate lipsiți de densitate de electroni și, prin urmare, cu caracter parțial pozitiv.
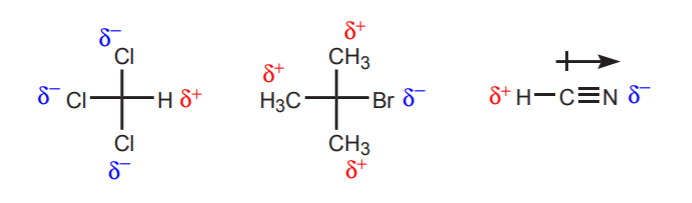
b) Un atom de hidrogen legat de un carbon care la rândul său este legat de un alt carbon care poartă o sarcină pozitivă parțială sau totală este acid.
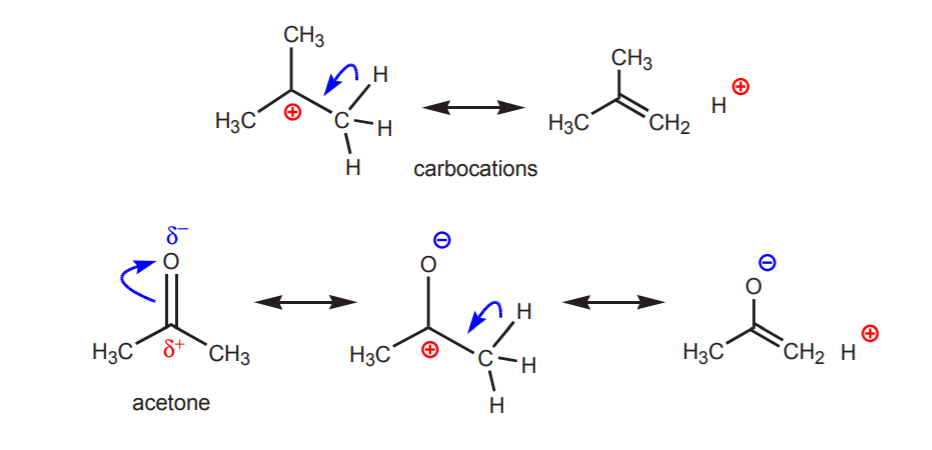
Aciditatea protonilor arătați devine evidentă în reacțiile de eliminare (capitolul 6) și în chimia enolilor (capitolul 22), când prezența unei baze conduce la formarea de alchene sau de ioni enolat prin intermediul unei etape care implică un transfer de protoni.
c) Baza conjugată este stabilizată prin rezonanță. Acest efect este mai important atunci când există un alt factor care sporește aciditatea, cum ar fi prezența unui dipol sau a unui atom electronegativ (ca în cazul grupei funcționale nitril, -CN). În caz contrar, stabilizarea prin rezonanță singură nu este suficientă pentru a crește dramatic aciditatea unui hidrogen atașat la carbon (ca în toluen, unde pKa este de numai 40).
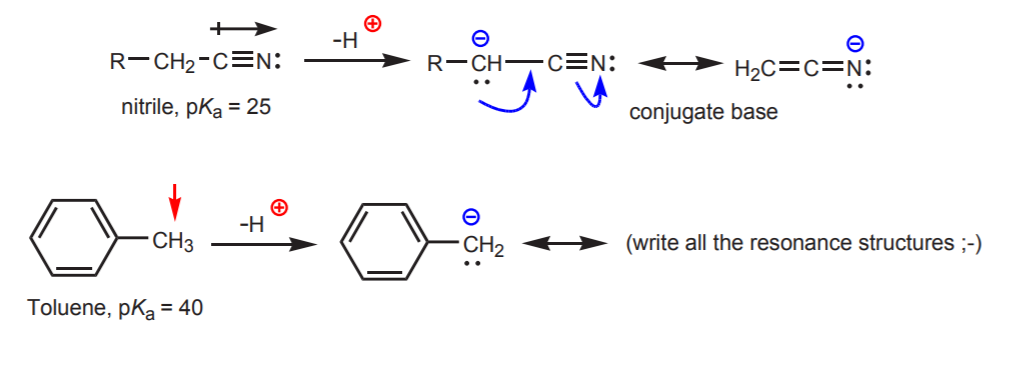
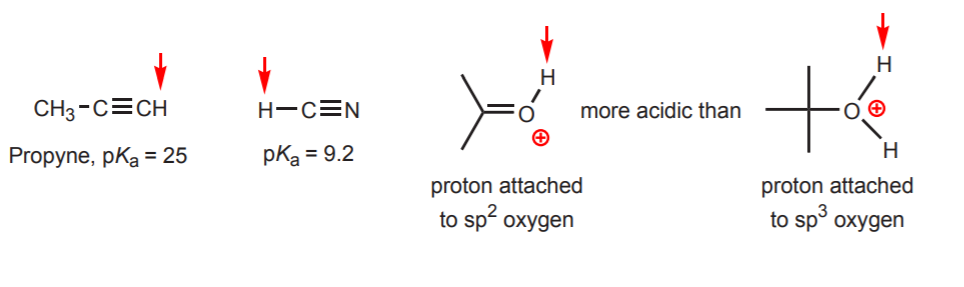
d) Hidrogenul este atașat la un carbon sp-hibridat. Efectele hibridizării asupra acidității sunt discutate în capitolul 9. Tendințele de hibridizare pot fi extinse și la oxigen și azot pe lângă carbon, ca în exemplul din dreapta.
.