14.1 Introdução aos neuropeptídeos e óxido nítrico
Os neurotransmissores clássicos (por exemplo, glutamato e ACh) funcionam pela transferência direcional de informações entre os locais de liberação pré-sináptica e os clusters de receptores pós-sinápticos. O processo é geralmente bem organizado espacialmente com alguns, mas muito limitado, “respingos” de transmissores entre sinapses vizinhas. A situação é bastante diferente para transmissão mediada por neuropeptídeos e óxido nítrico (NO). Estas moléculas ignoram a direcionalidade do fluxo de informação e, em vez disso, influenciam um volume de área a partir de seu ponto de liberação. Esta característica é vagamente análoga à liberação de hormônios peptídeos na corrente sanguínea, que podem ser levados a locais distantes para produzir seus efeitos. Por exemplo, NÃO pode ser produzido em um neurônio pós-sináptico e difundir de volta para o neurônio pré-sináptico ou para outros neurônios vizinhos, afetando a liberação subsequente do transmissor. Esta propriedade é denominada transmissão retrógrada, uma vez que o sinal viaja na direção oposta (pós a pré) em comparação com a direcionalidade clássica da neurotransmissão.
14.2 Neuropeptídeos
Muitos neuropeptídeos foram originalmente descritos como hormônios (por exemplo, somatostatina e colecistoquinina), embora uma vez caracterizados eles foram posteriormente também encontrados em neurônios dentro do SNC. Os neuropeptídeos tipicamente produzem respostas neuronais com início lento e longa duração (Figura 14.1), e cada receptor de neuropeptídeo caracterizado cai na classe GPCR (G-protein coupled receptor). Para comparação, a Figura 14.1 mostra respostas típicas produzidas pela ação de um neurotransmissor clássico (glutamato) agindo em um receptor ionotrópico e um neuropeptídeo. Um potencial de ação desencadeado no neurônio 1 (em verde), um neurônio que libera glutamato, produz o EPSP rápido (5 msec) típico da transmissão sináptica mediada pelo glutamato. Em contraste, um potencial de ação eliciado no neurônio 2 (roxo) que libera neuropeptídeo produz um EPSP de início lento (5 seg a pico) e de longa duração (10 seg). Esses EPSPs lentos são típicos das ações neuropeptídicas, uma vez que todos os receptores neuropeptídicos são acoplados à proteína G.
Figure 14.1
Além disso, muitos neuropeptídeos não produzem uma mudança eletrofisiológica óbvia no neurônio pós-sináptico. Por exemplo, um potencial de ação no neurônio 3 (Figura 14.1; rosa) não produz nenhuma resposta no neurônio pós-sináptico, embora se possa confirmar por outros meios que os neuropeptídeos foram liberados. Entretanto, ocorreram mudanças no neurônio pós-sináptico como revelado no exemplo mostrado nos painéis com o rótulo “C”. Se uma primeira medição da resposta do glutamato (C1) for feita estimulando o neurônio 1, uma resposta típica é vista. A estimulação do neurônio 3 não produz nenhuma resposta (C2) como antes. Entretanto, se o neurônio 1 for estimulado novamente após a estimulação do neurônio 3, o EPSP medido no neurônio pós-sináptico é aumentado (C3) (o EPSP original é a linha sólida e o EPSP após a estimulação do neurônio 3 é a linha tracejada). Assim, o neuropeptídeo liberado do neurônio 3 alterou a resposta do neurônio pós-sináptico a outro neurotransmissor. Esses neuropeptídeos são chamados de neuromoduladores, uma vez que seus efeitos são potenciar ou deprimir os efeitos de um segundo transmissor. Outros exemplos de tal plasticidade heterossináptica são descritos no Capítulo 7, Parte 2.
14.3 Classificação dos Peptídeos pelas Famílias
Os neuropeptídeos podem ser agrupados em famílias com base em semelhanças nas suas sequências de aminoácidos (Tabelas I e II).
Tabela I
Neuropeptídeos Famílias
Tacininas: substância P, bombesina, substância
Insulinas: insulina, factores de crescimento semelhantes à insulina
Somatostatinas: somatostatina, polipeptídeo pancreático
Gastrinas: gastrina, colecistoquinina
Opioides: opiocortinas, enkephalins, dinorfina
Por exemplo, os opiáceos são agrupados como uma família devido à sequência de aminoácidos idênticos Tyr-Gly-Gly-Phe–(Tabela II) encontrada no N-terminus de cada um.
| Tabela II Opiate Family-Sequence Identity in Italics |
|
| Nome | Sequência de aminoácidos |
| Leu-enkephalin | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkephalin | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorphin | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Leu-Trp-Asp-Asn-Gln-OH |
14.4 Biossíntese e regulação
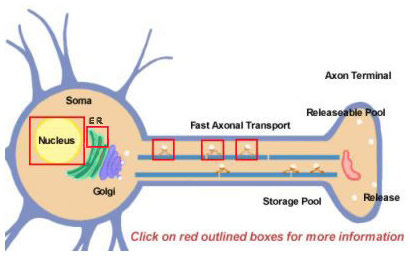
Figure 14.2
Neuropeptídeos são derivados de precursores maiores por processamento proteolítico. Todos eles são sintetizados inicialmente dentro do soma (Figura 14.2). Os precursores são inicialmente formados por tradução em poli-ribossomos ligados ao retículo endoplasmático próximo ao corpo celular. A partir daí, eles progridem através do aparelho de Golgi onde outras modificações ocorrem, incluindo a glicosilação. Em seguida são embalados em grânulos secretos que são transportados para terminais por transporte rápido axonal. Rápido é um termo relativo, porém, e devido às distâncias relativamente longas que alguns neuropeptídeos devem percorrer. O reabastecimento do pool de neuropeptídeos liberáveis pode requerer muitas horas. Durante o transporte para o terminal nervoso, proteases que são embaladas dentro da vesícula começam a clivar o neuropeptídeo precursor em sua forma madura final. Esse processamento é essencial para a ativação dos neuropeptídeos, já que os precursores são biologicamente inativos. Pelo menos três tipos de processamento ocorrem dentro das vesículas (Figura 14.2; clique nas caixas para mais detalhes). Primeiro, uma endopeptidase cliva o precursor para gerar dois novos produtos (Primeira caixa em axônio). Para muitos precursores, esta clivagem ocorre após resíduos básicos (como Lys e Arg) e é realizada por proteases tipo tripsina. Em seguida, embora não para cada neuropeptídeo, uma carboxipeptidase cliva os resíduos básicos do termo C do novo peptídeo (Segunda caixa no axônio). Finalmente, uma terceira enzima converte o grupo COOH (carboxi) de um resíduo Glídico, encontrado no termo C de muitos neuropeptídeos, para um grupo NH2 (amida) para produzir a forma madura e ativa do neuropeptídeo.
14.5 Mecanismos Múltiplos são Utilizados para Produzir a Diversidade de Neuropeptídeos
A maioria das proteínas são produzidas a partir de moléculas de mRNA que são emendadas a partir de RNAs precursores em suas formas finais no núcleo. A emenda diferencial é uma forma que um neurônio utiliza para diversificar a produção de diferentes tipos de neuropeptídeos. Um exemplo bem conhecido é a substância P mRNA que normalmente também inclui a substância codificadora do mRNA K. A substância K do mRNA pode ser emendada diferentemente para que o mRNA resultante possa produzir apenas a substância P (clique na caixa sobre o núcleo na Figura 14.2)
Figure 14.3
Neuropeptídeos são produzidos a partir de uma proteína precursora mais longa por processamento proteolítico. Um excelente exemplo é a família de peptídeos opióides (por exemplo, o processamento de proopiomelanocorticotropina, POMC e Enkephalin; ver Figura 14.3). Como observado, o processamento proteolítico ocorre dentro das vesículas de transporte e ocorre mais freqüentemente pela clivagem do precursor no lado N-terminal dos resíduos básicos (arginina e lisina), embora outros locais de clivagem também tenham sido identificados. Em alguns casos, como a proteína precursora da Enkephalin, estão presentes múltiplas cópias do mesmo peptídeo bioactivo final. A única molécula precursora apresentada no topo da Figura 14.3 contém seis cópias de Met-enkephalin (ME) e uma cópia de Leu-enkephalin (LE).
Diversidade pode assim ser gerada alterando a sequência dos sítios de clivagem através da emenda diferencial, produzindo e/ou embalando diferentes proteases (reconhecendo diferentes sequências para clivagem) nas vesículas de transporte, ou escondendo um sítio proteolítico através de modificações pós-tradução. Um exemplo deste último é que um local específico de clivagem pode ser escondido pela adição de uma cadeia lateral de carboidratos que bloqueia esterilmente o acesso da protease a esse local. Outra descoberta comum é que uma única molécula precursora conterá vários neuropeptídeos diferentes (ver Figura 14.3) e, portanto, os tipos de processamento que ocorrem acabam por determinar qual neuropeptídeo é liberado pelo neurônio. A proteína precursora de POMC pode ser clivada para formar ACTH (laranja) e β-lipoproteína (azul claro) que cada uma pode ser clivada para gerar neuropeptídeos bioativos adicionais (Figura 14.3). Por exemplo, a β-lipoproteína (azul-claro) pode ser clivada ainda mais em γ-lipoproteína (listras verdes) e β-endorfina (azul-escuro). Novamente, dependendo do processamento que ocorre, a mesma proteína precursora pode ser modificada para produzir neuropeptídeos com respostas biológicas dramaticamente diferentes.
14.6 Liberação
Figure 14.4
Peptídeos são liberados por exocitose dependente do cálcio com algumas diferenças importantes da liberação dos neurotransmissores clássicos. Tipicamente, as vesículas que liberam neuropeptídeos são muito maiores que aquelas que contêm pequenos neurotransmissores moleculares (por exemplo, glutamato) e não requerem uma especialização pré-sináptica para liberação (ver a micrografia eletrônica na Figura 14.4). Em contraste com as pequenas vesículas que contêm glutamato, as grandes vesículas não aparecem ancoradas na membrana. Esta observação é consistente com a idéia de que os neurotransmissores de pequenas moléculas produzem efeitos breves e locais (em conexões sinápticas), enquanto os neuropeptídeos produzem efeitos lentos e duradouros, muitas vezes abrangendo uma área significativa ao redor do local de liberação. Lembre-se também que, como os neuropeptídeos são sintetizados no soma celular e não localmente na sinapse, se o seu suprimento se esgotar com a liberação sustentada pode levar várias horas para reabastecer as piscinas liberáveis. Por exemplo, um neurônio motor, com seu corpo celular na medula espinhal e a sinapse no pé, tem um axônio de até um metro de comprimento. Utilizando transporte axonal rápido, levaria potencialmente mais de um dia para que um neuropeptídeo recém-sintetizado chegasse a esta sinapse a partir do soma. Também deve ser evidente que neuropeptídeos endógenos analgésicos, como a beta-endorfina, poderiam ser “usados” em momentos de estimulação persistente levando a situações onde a dor não pode mais ser controlada por mecanismos endógenos.
Um neurônio maduro típico liberará freqüentemente um pequeno neurotransmissor molecular e um ou mais neuropeptídeos (como no exemplo mostrado na Figura 14.4). Se mais de um neuropeptídeo for liberado, eles geralmente vêm da mesma molécula precursora única. Um exemplo é a co-liberação de ambos ACh e peptídeo relacionado ao gênero calcitonina de neurônios motores espinhais. CGRP ativa a adenilato ciclase, elevando os níveis de AMPc, e potencia a força de contração produzida pela ativação ACh do receptor ACh nicotínico. Neste caso, o neuropeptídeo é modulatório, como descrito na Figura 14.1. Entretanto, neste caso, o efeito potencializa a contração muscular em vez de aumentar a magnitude do EPSP. Em ambos os exemplos, a resposta potencializada é devida ao aumento da sensibilidade do sistema a uma quantidade constante de neurotransmissor liberado.
14.6 Terminação da ação
Os neuropeptídeos são lentamente removidos do espaço extracelular; uma característica que também contribui para os seus efeitos relativamente duradouros. A inactivação ocorre tanto por difusão como pela decomposição por proteases extracelulares. Não foram encontradas evidências de recaptação do peptídeo como meio de pôr termo à sua acção.
14.7 Os receptores são todos ligados à proteína G
Todos os receptores neuropeptídicos conhecidos produzem seus efeitos alterando os níveis de segundos mensageiros intracelulares. Estes receptores são sete proteínas transmembranas que são ligadas através de proteínas G (GPCRs) para alterar a ativação de outras enzimas celulares. Esta propriedade é consistente com neuropeptídeos que induzem uma resposta mais lenta e é bem adequada para um papel modulatório. Uma importante distinção entre transmissores de moléculas pequenas e neuropeptídicas é que os receptores neuropeptídicos têm uma alta afinidade de ligação (nanomolar) em oposição às afinidades micro ou milimolares medidas para neurotransmissores de pequenas moléculas (como o glutamato). Como os neuropeptídeos não são liberados direcionalmente no volume confinado de uma sinapse, suas concentrações não atingem níveis muito altos e os receptores devem então ter afinidades altas para reagir a essas pequenas concentrações. Essa alta afinidade retarda a dissociação do neuropeptídeo de seu receptor e também contribui para os efeitos persistentes dessas moléculas.
14.8 Óxido Nítrico (NO)
O óxido nítrico ganhou uma atenção generalizada como membro fundador de uma nova classe de moléculas de mensageiros gasosos. NO é a molécula ativa que a nitroglicerina sublingual produz para aumentar a vasodilatação no alívio da angina. Outros importantes efeitos biológicos do NO são agora reconhecidos. Por exemplo, no sistema nervoso, o NO é importante na regulação do fluxo sanguíneo cerebral, na modulação da neurotransmissão, e na toxicidade associada a vários estados patológicos.
14.9 Características do NO
Resumo das propriedades do NO
- Gás que se difunde livremente através das membranas
- De curta duração com meia-idadevida medida em segundos
- Radical livre altamente reactivo
- Tóxico em concentrações elevadas
NO é um gás de curta duração a não confundir com o relativamente estável óxido nitroso gasoso anestésico (gás do riso). O NO é na realidade um radical livre e é portanto um composto altamente reactivo. Alguns de seus efeitos tóxicos são provavelmente devidos à reação do NO com superóxido para produzir o peroxinitrato radical destrutivo. O NO é considerado um neurotransmissor não convencional porque não é liberado pela exocitose e sua ação não ocorre através de moléculas receptoras convencionais.
Como mencionado anteriormente, a descrição típica da comunicação neuronal considera a transmissão como unidirecional. Um neurotransmissor pré-sináptico é liberado que produz mudanças no neurônio pós-sináptico. Vários compostos (como neuropeptídeos e NO) produzidos em neurônios pós-sinápticos se difundem no ambiente local e afetam as células circundantes. Como o NO é um gás livremente difusível, ele tem o potencial de viajar rapidamente em qualquer direção a partir de seu ponto de produção. Por exemplo, se produzido em uma célula pós-sináptica devido à estimulação do receptor de glutamato, o NO pode ser liberado no ambiente local e enviar um sinal de volta ao neurônio pré-sináptico (Figura 14.5). Esse tipo de atividade é chamado de sinalização retrógrada, uma vez que o sinal viaja em uma direção retrógrada do neurônio pós-sináptico para o neurônio pré-sináptico.
Figure 14.5
Figure 14.6
Figuras 14.5, 14.6 e 14.7 resumem os principais aspectos da síntese de NO. Neste exemplo, o glutamato é liberado do terminal pré-sináptico que se liga aos receptores NMDA na membrana pós-sináptica, fazendo com que eles se abram e permitindo o fluxo de Ca2+. O Ca2+ ativa a calmodulina que se liga e ativa a enzima óxido nítrico sintetase (NOS). Usando arginina como substrato, a NOS produz NO e um produto de segunda reação citrulina. O NO é então livre para se difundir no ambiente e interagir com o terminal pré-sináptico que inicialmente liberou o glutamato ou qualquer outra célula no ambiente local. Reconhecer que qualquer processo que eleva o Ca2+ intracelular irá potencialmente ativar a NOS. A ativação do glutamato dos receptores NMDA é apenas um exemplo bem documentado.
Figure 14.7
14.10 Síntese por óxido nítrico sintase (NOS) e liberação
NO é produzido pela enzima óxido nítrico sintase (NOS). Esta enzima é encontrada em uma subpopulação de neurônios (1-2% dos neurônios no córtex) e é encontrada em quase todas as células endoteliais. Pelo menos uma forma de NOS nestas células é dependente de cálcio e calmodulin para ativação como indicado nas Figuras 14.5, 14.6, e 14.7. Ela também contém cofactores semelhantes ao citocromo P-450. Esses cofatores são NADPH (nicotinamida adenina dinucleotídeo fosfato, FAD (flavin adenina mononucleotídeo) e FMN (flavin mononucleotídeo). Esses cofatores são essenciais para a transferência de elétrons que produzem o produto instável e de curta duração NO. O substrato nesta reação é o aminoácido comum arginina e os produtos são citrulina e NO (Figura 14.5). Devido à curta vida útil do NO, é extraordinariamente difícil medir diretamente. Entretanto, em preparações experimentais, existe uma excelente correlação entre a aplicação de NMDA, que aumenta o Ca2+ intraneuronal e ativa a NOS, com a produção do produto adicional da atividade enzimática da NOS, a citrulina (ver Figura 14.8). A produção de citrulina é um indicador confiável da produção de NO. Também é possível bloquear a produção de citrulina (e NO) através da alimentação das células do substrato não metabolizável para a NOS denominada metil arginina (Figura 14.9), e tais compostos têm sido usados para reduzir a produção de NO e terminar seus efeitos biológicos.
|
Figure 14.8 |
Figura 14,9 |
14.11 “Receptores” para NO
Figure 14,10
Um dos principais alvos para o NO parece ser a enzima guanylyl ciclase. Essa descoberta foi feita indiretamente pelo monitoramento do acúmulo do produto NOS citrulina, enquanto também o monitoramento para a produção de cGMP, o produto da enzima guanilil ciclase (Figuras 14.8 e 14.9). Neste experimento, o NMDA foi adicionado a uma preparação neuronal para ativar a NOS. NOS utiliza arginina como substrato para produzir NO e, como mencionado, se um análogo não hidrolisável como a metil-arginina é adicionado ao sistema, verificou-se que o acúmulo de citrulina e cGMP termina da mesma forma dose-dependente. Essas fortes correlações levaram à descoberta de que a guanylyl ciclase é um alvo principal de NO.
Guanylyl cyclase é uma enzima incomum porque tem um anel de heme com uma molécula de ferro associada como parte de sua estrutura. NO ativa essa enzima ligando-se ao ferro no heme, iniciando a produção de GMP cíclico a partir de GTP (Figura 14.10) através de mudanças conformacionais na enzima. cGMP então ativa uma proteína quinase dependente de cGMP e outras enzimas descritas abaixo. O espectro de efeitos produzidos pela ativação da proteína quinase dependente do GMPc só agora está se tornando compreendido.
14.12 Efeitos biológicos do NO
O NO produz uma grande variedade de efeitos biológicos. Infelizmente, nós ignoramos particularmente o papel do NO na modulação dos processos celulares no sistema nervoso. O papel do NO na regulação da vasculatura está bem documentado e parece desempenhar um papel igualmente importante no sistema nervoso.
14.13 Vasodilatador
Figure 14.11
Clique aqui para ver uma visão ampliada desta imagem.
Em circunstâncias normais, o NO contribui para o controle do fluxo sanguíneo através da cerebrovasculatura. Um mecanismo de feedback rápido existe necessariamente para fornecer as áreas mais activas do cérebro com os nutrientes necessários. Este mecanismo é necessário devido à fraca reserva de reservas de energia do cérebro. NO é produzido em neurônios contendo NOS que estão sofrendo atividade sustentada. Estas condições favorecem a ativação dos receptores de NMDA, que é conhecido por causar a produção de NO. O NO se difunde dessas áreas localizadas de alta atividade neuronal para a microvasculatura circundante (Figura 14.11) causando vasodilatação e aumento do fluxo sanguíneo.
Embora os mecanismos exatos pelos quais o NO produz vasodilatação ainda não estejam definidos, sabe-se que a ativação da proteína quinase dependente de cGMP nas células musculares lisas causa um relaxamento dos vasos. Uma vez que um dos principais alvos do NO é a guanilil ciclase (que produz cGMP e ativa a proteína cinase dependente do cGMP), presume-se que um dos principais caminhos para as ações vasodilatadoras do NO é através da proteína cinase dependente do cGMP. A ativação dessa cinase leva indiretamente à diminuição dos níveis de Ca2+ nas células musculares lisas e, posteriormente, à desfosforilação do aparelho contrátil da miosina, que causa relaxamento (Figura 14.12). Nas células musculares lisas, o NO também parece hiperpolarizar diretamente as células possivelmente ativando os canais de K+, levando ao fechamento secundário dos canais de Ca2+, o que também produz relaxamento muscular. Em conclusão, uma das principais funções do NO parece ser integrar o nível de atividade neuronal com alterações locais no fluxo sanguíneo cerebral para manter a perfusão adequada do tecido metabolicamente ativo.
Figure 14.12
14.14 Neuromodulador
Pensa-se que o NO também actua como um mensageiro localmente difusível. Ele é produzido por qualquer ação que eleva Ca2+ em células contendo NOS, como a estimulação do glutamato dos receptores NMDA. Através da ativação subsequente da guanylyl ciclase e produção de cGMPc, a produção de NO influencia uma variedade de processos secundários. Estes incluem a modulação direta dos canais iônicos, estimulação da proteína quinase dependente do cGMP e a regulação tanto para cima quanto para baixo da cAMP-fosfodiesterase. Os efeitos a jusante são então numerosos e incluem regulação para cima e para baixo dos canais de Ca2+, aumento da excitabilidade (aumenta a taxa de disparo neuronal), aumento ou diminuição da libertação de neurotransmissores, e alterações na morfologia dos neurónios.
14,15 Toxicidade
NO em excesso é tóxico para as células. Entretanto, existe um paradoxo para a toxicidade do NO. As células que produzem altos níveis de NO são resistentes aos seus efeitos tóxicos. Por exemplo, NO toxicidade é usado por macrófagos e neutrófilos como um mecanismo para matar células tumorais e bactérias. Contudo, nenhum dos tipos de células que produzem NO é susceptível aos seus efeitos nocivos. Este achado também é verdadeiro para os neurônios do sistema nervoso central. O excesso de glutamato induz neurotoxicidade no cérebro e é considerado a principal causa de morte neuronal em doenças como Huntington ou Alzheimer ou após acidente vascular cerebral agudo ou trauma. Pensa-se que a produção excessiva de NO tem algum papel nesta perda neuronal devido à sua toxicidade quando produzida em excesso. Curiosamente, as células que mancham positivo para a enzima NOS são poupadas em áreas degeneradoras do cérebro afetadas por essas doenças. A resistência destas células parece ser semelhante à resistência das células imunitárias descritas acima.
Test Your Knowledge
- Question 1
- A
- B
- C
- D
- E
Neuropeptídeos estão presentes em terminais sinápticos porque estão:
A. Sintetizados no terminal.
B. Transportados por transporte rápido axonal
C. Transportado por difusão
D. Transportado por transporte axonal lento
E. Extraído do espaço extracelular
Neuropeptídeos estão presentes em terminais sinápticos porque são:
A. Sintetizados no terminal. Esta resposta é INCORRECT.
A maquinaria sintética necessária para a síntese de peptídeos e proteínas não é encontrada no terminal axon.B. Transportado por transporte axonal rápido
C. Transportado por difusão
D. Transportado por transporte axonal lento
E. Extraído do espaço extracelular
Neuropeptídeos estão presentes em terminais sinápticos porque são:
A. Sintetizados no terminal.
B. Transportados por transporte axonal rápido Esta resposta é CORRETO!
Neuropeptídeos estão sintetizados no corpo celular e são processados em vesículas que são transportados para terminais axonais ao longo de microtubos por meio de transporte axonal rápido.C. Transportados por difusão
D. Transportado por transporte axonal lento
E. Extraído do espaço extracelular
Neuropeptídeos estão presentes em terminais sinápticos porque são:
A. Sintetizados no terminal.
B. Transportados por transporte rápido axonal
C. Transportado por difusão Esta resposta é INCORRETO.
A. Além disso, a difusão é um excelente mecanismo para mover moléculas em curtas distâncias (alguns microns), mas é ineficiente para mover moléculas em distâncias que tipicamente separam o soma neuronal dos terminais axonais.D. Transportado por transporte axonal lento
E. Extraído do espaço extracelular
Neuropeptídeos estão presentes em terminais sinápticos porque são:
A. Sintetizados no terminal.
B. Transportados por transporte rápido axonal
C. Transportado por difusão
D. Transportado por transporte axonal lento Esta resposta é INCORRETO.
Ainda, é importante repor o mais rapidamente possível o fornecimento de neuropeptídeos para os terminais. Neste caso, mais rápido é melhor.E. Extraídos do espaço extracelular
Neuropeptídeos estão presentes nos terminais sinápticos porque são:
A. Sintetizados no terminal.
B. Transportados por transporte rápido axonal
C. Transportado por difusão
D. Transportado por transporte axonal lento
E. Retirada do espaço extracelular Esta resposta é INCORRECT.
Não há nenhum mecanismo conhecido de captação para remover neuropeptídeos do espaço extracelular. Seu mecanismo de ação é terminado por difusão e por degradação enzimática por proteases extracelulares.
- Pergunta 2
- A
- B
- C
- D
- E
Óxido Nítrico:
A. Tem uma longa vida útil:
B. É permeável à membrana.
C. Não é reactiva
D. É também conhecido como gás do riso.
E. Não é tóxico para as células.
Óxido Nítrico:
A. Tem uma longa vida útil Esta resposta é INCORRECT.
NO tem uma meia-vida medida em segundos e é altamente instável.B. É permeável à membrana.
C. Não é reactiva
D. Também é conhecido como gás do riso.
E. Não é tóxico para as células.
Óxido Nítrico:
A. Tem uma longa vida útil
B. É permeável à membrana. Esta resposta é CORRETA!
NO é livremente permeável às membranas e afecta todas as células dentro de algum raio a partir do seu ponto de produção.C. Não é reactivo
D. É também conhecido como gás do riso.
E. Não é tóxico para as células.
Óxido Nítrico:
A. Tem uma longa vida útil
B. É permeável à membrana.
C. Não é reactivo Esta resposta é INCORRECT.
NO é um radical livre altamente reactivo. Ele reagirá com proteínas, lipídios e ácido nucléico e tem uma afinidade particularmente alta para metais reduzidos (como Fe2+ no grupo heme da guanilila ciclase).D. É também conhecido como gás do riso.
E. Não é tóxico para as células.
Óxido Nítrico:
A. Tem uma longa vida útil
B. É permeável à membrana.
C. Não é reactiva
D. É também conhecido como gás do riso. Esta resposta é INCORRECT.
Gás risonho é óxido nitroso e não óxido nítrico. Não é reactivo e não tóxico, mas afecta as propriedades da membrana.E. Não é tóxico para as células.
Óxido Nítrico:
A. Tem uma longa vida útil
B. É permeável à membrana.
C. Não é reactiva
D. É também conhecido como gás do riso.
E. É não tóxico para as células. Esta resposta é INCORRECT.
NO é altamente tóxico para as células quando produzido em excesso. Na verdade, pensa-se que a produção excessiva de NO causa certas doenças neurodegenerativas. O NO também é produzido por macrófagos como o produto tóxico para matar bactérias invasoras.