O elemento químico hidrogênio é classificado como um não-metal. Ele pode tornar-se metálico a pressões muito elevadas. Foi descoberto em 1766 por Henry Cavendish.
 >
>Zona de dados
| Classificação | O hidrogênio é um não-metal. Ele pode tornar-se metálico a pressões muito elevadas. |
| Cor | Incolor |
| Peso atómico | 1.0079 |
| Estado | Gás |
| Ponto de fusão | -259.14 oC, 14.01 K |
| Ponto de enchimento | -252.87 oC, 20.28 K |
| Electrões: | 1 |
| Protões: | 1 |
| Neutrons no isótopo mais abundante: | 0 |
| Electrões | 1 |
| Configuração electrónica | 1s1 |
| Densidade a 20oC | 0.0000899 g/cm3 |
Mostrar mais, incluindo: Aquecimento, Energias, Oxidação,
Reações, Compostos, Raios, Condutividades
| Volume atômico | 14.4 cm3/mol |
| Estrutura | hcp: embalagem hexagonal fechada (como sólido a baixas temperaturas) |
| Dureza | – |
| Capacidade térmica específica | 14.304 J g-1 K-1 |
| Calor de fusão | 0,117 kJ mol-1 de H2 |
| Calor de atomização | 218 kJ mol-1 |
| Calor de vaporização | 0.904 kJ mol-1 de H2 |
| 1ª energia de ionização | 1312 kJ mol-1 |
| 2ª energia de ionização | kJ mol-1 |
| 3ª energia de ionização | 11815.0 kJ mol-1 |
| Afinidade electrónica | 72.7711 kJ mol-1 |
| Número mínimo de oxidação | -1 |
| Mín. oxidação comum no. | -1 |
| Número máximo de oxidação | 1 |
| Nº máximo de oxidação comum. | 1 |
| Electronegatividade (escala de Pauling) | 2.18 |
| Volume de polarização | 0.7 Å3 |
| Reacção com ar | vigorosa, ⇒ H2O |
| Reacção com 15 M HNO3 | nenhum |
| Reacção com 6 M HCl | nenhum |
| Reacção com NaOH 6 M | nenhum |
| Óxido(s) | H2O |
| Hidreto(s) | H2 |
| Cloreto(s) | HCl |
| Raio atómico | 25 pm |
| Raio iónico (1+ião) | – |
| Raio iónico (2+iões) | – |
| Raio iónico (3+iões) | – |
| Raio iónico (1- ião) | – |
| Raio iónico (2-ião) | – |
| Raio iónico (3-ião) | – |
| Condutividade térmica | 0.1805 W m-1 K-1 |
| Condutividade eléctrica | – |
| Ponto de congelação/congelação: | -259.14 oC, 14.01 K |

Nasa imagem: Vastas quantidades de hidrogénio em galáxias remotas.

Theophrastus Paracelsus – A primeira pessoa a gerar hidrogénio: “O ar surge e parte-se como um vento.”
Descoberta do Hidrogénio
Uma experiência química escolar favorita é adicionar um metal como o magnésio a um ácido. O metal reage com o ácido, formando um sal e liberta hidrogénio do ácido. O gás hidrogênio borbulha do líquido e os estudantes coletam-no em pequenas quantidades para outros experimentos, como o ‘pop-test’.’
A primeira instância registrada de hidrogênio feito pela ação humana foi na primeira metade dos anos 1500, por um método similar ao usado nas escolas atualmente. Ele é relatado como tendo dito da experiência: “O ar surge e quebra como um vento”. Ele não descobriu, entretanto, nenhuma das propriedades do hidrogênio.(1)
Turquet De Mayerne repetiu o experimento de Paracelsus em 1650 e descobriu que o gás era inflamável.(2) Nem Paracelsus nem De Mayerne propuseram que o hidrogênio poderia ser um novo elemento. Na verdade, Paracelsus acreditava que havia apenas três elementos – a tria prima – sal, enxofre e mercúrio – e que todas as outras substâncias eram feitas de combinações diferentes destes três. (3) (A Química ainda tinha um longo caminho a percorrer!)
Em 1670, o cientista inglês Robert Boyle adicionou ferro ao ácido sulfúrico. Ele mostrou que o gás resultante (hidrogênio) só queimava se houvesse ar e que uma fração do ar (agora chamaríamos de oxigênio) era consumida pela queima.(4)
O hidrogênio foi reconhecido pela primeira vez como um elemento distinto em 1766 pelo cientista inglês Henry Cavendish, quando ele o preparou reagindo o ácido clorídrico com zinco. Ele descreveu o hidrogênio como “ar inflamável de metais” e estabeleceu que era o mesmo material (por suas reações e sua densidade) independentemente de qual metal e qual ácido ele utilizava para produzi-lo.(1) Cavendish também observou que quando a substância era queimada, produzia água.
O cientista francês Antoine Lavoisier mais tarde chamou o elemento hidrogênio (1783). O nome vem do grego ‘hidro’ que significa água e ‘genes’ que significam formação – o hidrogênio é um dos dois elementos formadores de água.
Em 1806, com o hidrogênio bem estabelecido como um elemento, o químico inglês Humphry Davy empurrou uma forte corrente elétrica através da água purificada.
Ele encontrou hidrogénio e oxigénio formados. O experimento demonstrou que a eletricidade podia separar substâncias em seus elementos constituintes. Davy percebeu que as substâncias estavam ligadas entre si por um fenómeno eléctrico; ele tinha descoberto a verdadeira natureza da ligação química.(5)
Visit Chemicool’s Cool Hydrogen Facts Page.

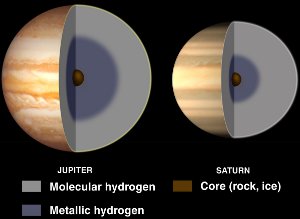
Interiores de Júpiter e Saturno, com hidrogénio metálico líquido. Cortesia NASA/JPL-Caltech.

Nasa: O tanque de combustível externo do Space Shuttle (laranja) cheio com hidrogénio líquido e oxigénio.

Carros de hidrogénio emitem água em vez de poluentes.

Electrólise laboratorial da água. A energia elétrica é utilizada para dividir a água. O hidrogênio se reúne em um tubo de ensaio, o oxigênio no outro.
>
Aspecto e Características
Efeitos nocivos:
O hidrogênio é altamente inflamável e tem uma chama quase invisível, que pode levar a queimaduras acidentais.
Características:
O hidrogênio é o elemento mais simples de todos, e o mais leve. É também, de longe, o elemento mais comum no Universo. Mais de 90% dos átomos do Universo são hidrogénio.
Na sua forma mais comum, o átomo de hidrogénio é feito de um próton, um electrão e nenhum neutro. O hidrogênio é o único elemento que pode existir sem nêutrons.
O hidrogênio é um gás incolor e inodoro que existe, à temperatura e pressão padrão, como moléculas diatômicas, H2.
Queima e forma misturas explosivas no ar e reage violentamente com oxidantes.
Na Terra, a maior localização do hidrogênio está na água, H2O. Há pouco hidrogênio livre na Terra, porque o hidrogênio é tão leve que não é retido pela gravidade do planeta. Qualquer hidrogênio que se forma eventualmente escapa da atmosfera para o espaço.
Embora o hidrogénio seja geralmente um não-metal, torna-se um metal líquido quando lhe são aplicadas enormes pressões.
Tais pressões são encontradas dentro de planetas gigantes como Júpiter e Saturno. Acredita-se que o alto campo magnético de Júpiter (14 vezes o da Terra) seja causado por um efeito dínamo resultante de hidrogênio metálico eletricamente condutor que circula enquanto o planeta gira.
Usos de hidrogênio
Grandes quantidades de hidrogênio são usadas no processo Haber (produção de amônia), hidrogenação de gorduras e óleos, produção de metanol, hidrocraqueamento e hidrogenodessulfurização. O hidrogênio também é usado na refinação de metais.
O hidrogênio líquido é usado como combustível para foguetes, por exemplo, acionar o içamento e a subida em órbita do Ônibus Espacial. O hidrogênio líquido e o oxigênio são mantidos no grande tanque de combustível externo do Vaivém. (Veja imagem à esquerda.)
Os dois isótopos mais pesados do hidrogênio (deutério e trítio) são usados na fusão nuclear.
A economia do hidrogénio foi proposta como um substituto para a nossa economia actual baseada em hidrocarbonetos (petróleo, gás e carvão).
A base da economia do hidrogénio é que a energia é produzida quando o hidrogénio entra em combustão com oxigénio e o único subproduto da reacção é a água.
Neste momento, no entanto, o hidrogénio para automóveis movidos a hidrogénio é produzido a partir de hidrocarbonetos. Somente quando as energias solar ou eólica, por exemplo, podem ser utilizadas comercialmente para dividir a água em hidrogênio e oxigênio, será possível uma verdadeira economia de hidrogênio.
Abundância e Isótopos
Abundância da crosta terrestre: 1400 partes por milhão em peso (0,14%), 2,9% por moles
Abundância do sistema solar: 75% em peso, 93% por moles
Custo, puro: $12 por 100g
Custo, a granel: $ por 100g
Fonte: O hidrogénio é preparado comercialmente através da reacção do vapor superaquecido com metano ou carbono. No laboratório, o hidrogênio pode ser produzido pela ação dos ácidos sobre metais como zinco ou magnésio, ou pela eletrólise da água (mostrado à esquerda).
Isótopos: O hidrogênio tem três isótopos, 1H (protium), 2H (deutério) e 3H (trítio). Os seus dois isótopos mais pesados (deutério e trítio) são utilizados para a fusão nuclear. O protium é o isótopo mais abundante, e o tritium o menos abundante. O trítio é instável com uma meia-vida de cerca de 12 anos e 4 meses. O hidrogénio natural é uma mistura dos dois isótopos 1H e 2H com abundâncias naturais de 99,99% e 0,01%, respectivamente.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet., (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s “The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time”, (2007) p62. Libraries Unlimited.
Cite esta página
Para criar um link online, por favor copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
ou
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Para citar esta página em um documento acadêmico, por favor use a seguinte citação compatível com a MLA:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.