Estrutura, Dinâmica e Função dos Aquaporins
 Vencedor do Desafio da Visualização em Ciência e Engenharia de 2004,
Vencedor do Desafio da Visualização em Ciência e Engenharia de 2004, Organizado pela Fundação Nacional da Ciência e Revista Science. (Ver o artigo relacionado com Ciência),
O nosso filme de permeação da água e o prémio Nobel 2003 de Química
A Arte do Transporte de Água em Aquaporins
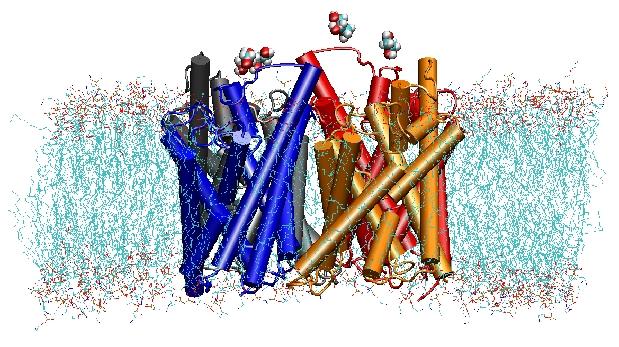
Aquaporins são canais de água de membrana que desempenham papéis críticos no controlo do conteúdo de água das células. Estes canais estão amplamente distribuídos em todos os reinos da vida, incluindo bactérias, plantas e mamíferos. Mais de dez aquaporinas diferentes foram encontradas no corpo humano, e várias doenças, tais como cataratas congénitas e diabetes insípido nefrogénico, estão ligadas à função deficiente destes canais. Elas formam tetrâmeros na membrana celular e facilitam o transporte de água e, em alguns casos, de outros pequenos solutos através da membrana. Entretanto, os poros da água são completamente impermeáveis às espécies carregadas, como os prótons, uma propriedade notável que é crítica para a conservação do potencial eletroquímico da membrana, mas paradoxal ao mesmo tempo, uma vez que os prótons podem ser facilmente transferidos através de moléculas de água. Os resultados de nossas simulações agora proporcionaram uma nova visão do mecanismo subjacente a esta fascinante propriedade. As moléculas de água que passam pelo canal são forçadas, pelas forças eletrostáticas da proteína, a girar no centro do canal (veja a animação), quebrando assim o arranjo alternativo doador-ceptor que énecessário para a translocação do próton (leia a história completa em nossoSciencepaper).

Functional Implication of a Peculiar Protein Architecture
No ano 2000, o laboratório de Stroud na UCSF conseguiu resolver a primeira estrutura de alta resolução de uma aquaporina por radiografia de cristalografia. A estrutura estudada foi a do E. coliglycerol uptake facilitator (GlpF), que é uma aquagliceroporina, ou seja, o canal também é permeável a pequenas moléculas lineares de açúcar, como o glicerol. As simulações MD de GlpF tetramérico em uma mancha hidratada de bocal lipídico de POPE caracterizaram o caminho completo de condução do substrato no canal. A análise das interações do substrato de hidrogênio com o interior do canal também explicou pela primeira vez porque esses canais incorporam em sua arquitetura dois loops característicos, incluindo elementos de estrutura secundária energeticamente desfavoráveis, que são conservados em toda a aquaporinfamília (Jensenet al., Estrutura, 2001).
Energética da Permeação do Açúcar
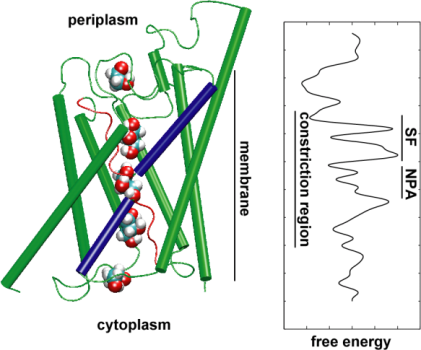
Depois, explorámos a energia do transporte para compreender que barreiras um substrato precisa de ultrapassar durante a sua passagem pelo canal. Para descrever o perfil de energia livre, calculamos o potencial de força média para o evento de condução completa a partir das trajetórias em que o movimento de glicerol através do canal foi acelerado pela aplicação de forças externas. Esta técnica, conhecida como dinâmica molecular dirigida (DME), permite observar eventos lentos na escala de tempo acessível das simulações MD. No entanto, devido à natureza não-equilibrada das trajetórias, na análise dos resultados, enfrenta-se o problema do trabalho irreversível que tem de ser contado. Usando a identidade de Jarzinsky, a igualdade entre a energia livre e o trabalho em sistemas não-equilibrios, poderíamos descrever completamente a energética do transporte de glicerol através do canal. O potencial calculado de força média captura os principais locais de ligação e barreiras no canal, de acordo com os resultados das simulações de MD de equilíbrio e a estrutura cristalina. Além disso, apresenta uma pronunciada assimetria na sua forma, sugerindo que a estrutura assimétrica da proteína pode ser funcionalmente importante para uma absorção eficiente das moléculas nutrientes do ambiente. (Jensen, etal., PNAS, 2002).
What Makes an Aquaporin a Glycerol Channel
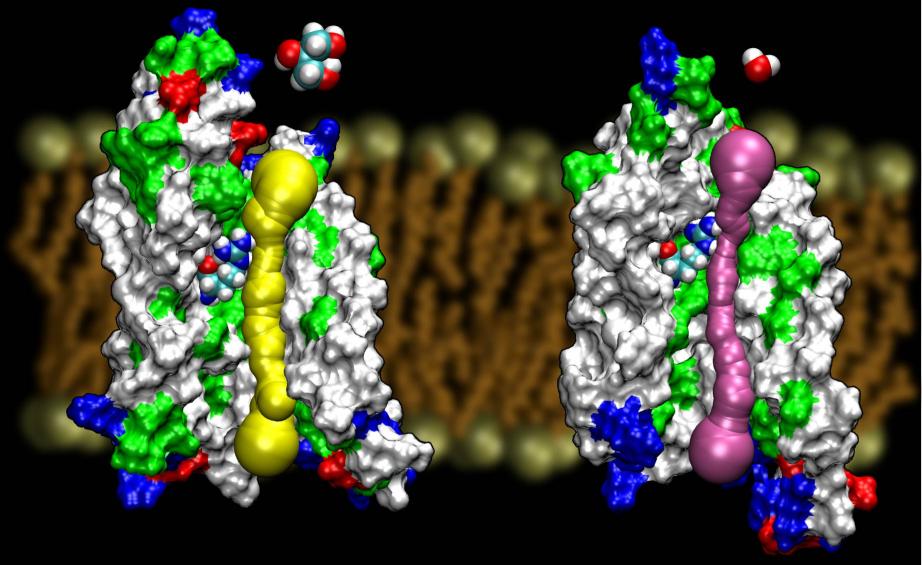
Aquaporins are a very lucky family of membrane proteins,which are notoriously resistant against structure determination. Possuímos estruturas de alta resolução de vários AQPs: GlpF, AQP1, AQP0, eAqpZ. Espera-se o surgimento de mais estruturas em breve. A disponibilidade de duas estruturas de AQPs de E. coli, uma que é um canal de água pura (AqpZ) e outra que é um canal de glicerol (GlpF) nos deu uma oportunidade única de entender os princípios de seletividade empregados pela natureza no uso de dois canais genéticos e estruturalmente altamente homogêneos para o tráfico de membranas de diferentes materiais. De facto, o poro é mais estreito que o GlpF (ver figura abaixo). Parece que a natureza se voltou para um mecanismo muito básico, nomeadamente a afinação do tamanho do poro do canal, de modo a fazer com que duas proteínas da mesma família exponham propriedades de condução diferentes. Leia a história completa em Wang, etal., STRUCTURE, 2005.
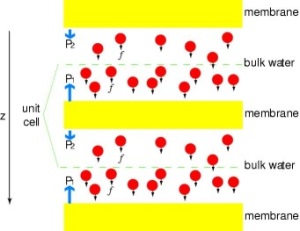
Pôr os canais sob pressão
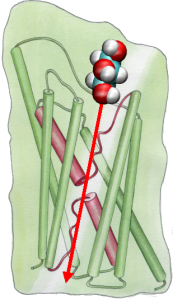
Para comparar directamente os resultados das simulações MD com as medições bioquímicas da condutividade dos canais de água da membrana, em que são utilizados gradientes de pressão osmótica para induzir o fluxo de água através da membrana, desenvolvemos uma nova metodologia para simulações MD. Aplicando pequenas forças sobre as moléculas de água na região de massa (ver figura), é gerado um gradiente de pressão hidrostática através da membrana. O gradiente de pressão induz taxas de redução que podem ser estudadas com simulações MD, que são normalmente limitadas a alguns nanossegundos. O método tem sido aplicado na simulação da permeação da água através do GlpF, e resultou em uma correlação linear entre a pressão aplicada e o fluxo (Zhu et al.,Biophys. J., 2002).
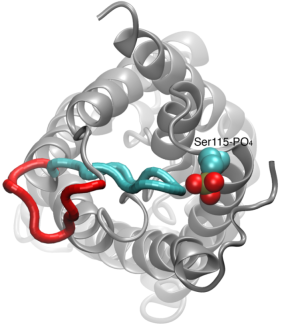
Aquecimento dos canais de água
A permeação da água através das aquaporinas é um processo passivo que segue a direcção da pressão osmótica através da membrana. Embora muitas aquaporinas funcionem como canais sempre abertos, um subgrupo de aquaporinas, particularmente nas plantas, desenvolveu um mecanismo molecular sofisticado através do qual o canal pode ser fechado em resposta às condições adversas do ambiente, sob o qual a troca de água pode ser prejudicial para o organismo. Exemplos de tais condições são o stress da seca e inundações, que desencadeiam certos sinais celulares (desfosforização e mudança de pH) que resultam no encerramento do canal. Uma estrutura recentemente resolvida de um aquaporin de espinafre foi simulada sob diferentes condições para investigar o mecansim molecular de canais de membrana. Foi descoberto que um laço citoplasmático alongado em aquaporinas com comportas oclui fisicamente a entrada do poro de água no canal fechado e bloqueia o acesso das moléculas de água ao poro. O deslocamento desta alça em resposta à fosforilação, como observado nas simulações, remove a alça da entrada citoplasmática do poro. Além disso, um aminoácido hidrofóbico que está conformavelmente ligado a esta alça será puxado de volta do canal como resultado do movimento da alça. Juntos, esses eventos moleculares resultam em um canal aberto que é permeável por moléculas de água. O estudo apareceu na Nature2006.

Aquecimento e Condutividade de Íons do Poro Tetramérico
AQPs são geralmente conhecidos pela sua alta permeabilidade à água. No entanto, o seu envolvimento noutras funções celulares, incluindo a permeação de pequenas moléculas que não a água, bem como a comunicação celular, tem sidosugida. A tetramerização é uma característica estrutural comum dos AQPs. O fato de que os quatro monômeros formam cada um um poro de água funcionalmente independente, mas requerem uma organização tetramérica para a função, sugere um benefício sinérgico da oligomerização e, portanto, obriga a uma análise adicional do papel potencial do poro central nos AQPs. Uma proposta interessante é o possível envolvimento da condução do íon do poro central na ativação do GMPc. Utilizando simulações MD de modelos de membrana embutidos de AQP1, temos investigado esta propriedade do AQP1, para determinar como, e sob quais condições de conformação e hidratação, o poro central pode conduzir e como a condutividade é regulada. Um dos citoplasmicloops, nomeadamente o loop D rico em arginina, foi sugerido pelas nossas simulações para desempenhar um papel fundamental na activação mediada por cGMP do poro central. O papel sugerido da alça D foi verificado experimentalmente por um projeto de mutante da alça D mostrando uma perda completa da condutividade iônica ( Yu et al.,Structure, 2006 ) .
Gas Molecules Commute into Cell
Todas as manhãs, muitas pessoas dirigem para o trabalho, enquanto outras podem pedalar, pegar o ônibus ou o metrô. Por exemplo, para atravessar a membrana celular, pequenas moléculas de gás hidrofóbico se difundem através da camada lipídica, enquanto moléculas de água passam através de aquaporinas (AQPs), Além da difusão através de deslizamentos, oxigênio e dióxido de carbono também podem passar por AQPs. No entanto, os caminhos que essas moléculas de gás tomam permanecem esquivos. Usando a dinâmica molecular realizada com NAMD, temos investigado a gaspermeabilidade do AQP1 com dois métodos complementares (simulação explícita de difusão de gás e amostragem de ligantes implícita). Os resultados da simulação sugerem que enquanto os poros fonoméricos do AQP1 funcionam como canais de água, o poro central do AQP1 pode servir como um caminho para moléculas de gás atravessarem a membrana (Wang et al., Journal of Structural Biology, 2007 ).
Molecular Obstacle Course
Células biológicas protegem seu interior através de suas membranas celulares, mas dependem da importação de nutrientes. Elas evoluíram para esta importação de canais de condução rápida que incluem pontos de verificação confiáveis que distinguem compostos desejáveis e indesejáveis. Um ponto de verificação coloca um verdadeiro percurso de obstáculos que só os compostos certos podem passar rapidamente. A compreensão do desenho do canal é difícil devido à falta de dados experimentais detalhados sobre a dinâmica dos nutrientes. Actualmente, a informação mais detalhada vem da visualização computacional da dinâmica do canal, a partir de estruturas cristalográficas estáticas. Um estudo recente investigou como gliceróis, pequenas moléculas de nutrientes necessárias por algumas bactérias, passam por pontos de verificação realizados através do canal de glicerol GlpF. GlpF fornece quatro canais paralelos que foram monitorados computacionalmente usando NAMD e um novo algoritmo que explora a energia do canal suficientemente rápido para ser metodologicamente viável nos computadores de hoje. Os resultados mostram como as características físicas do glicerol, sua capacidade de formar as chamadas ligações de hidrogênio, seus momentos dipolo elétricos, sua mobilidade difusiva e sua flexibilidade intrínseca são sondados ao longo do canal (Henin et al, Biophysical Journal, no prelo ).
A nossa pesquisa Aquaporin nas Notícias
|
Equipa Aquaporin
|
Publicações
-//W3C//DTD XHTML 1.0 Transitional///EN” “http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Difusão de glicerol através de Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, e Christophe Chipot. Jornal Biofísico, 94:832-839, 2008. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, e Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mecanismo de alimentação e condutividade iônica de um possível poro tetramérico em Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, e Emad Tajkhorshid. Estrutura, 14:1411-1423, 2006. Mecanismo estrutural do aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, e P. Kjellbom. Nature, 439:688-694, 2006. O que faz de uma aquaporina um canal de glicerol: Um estudo comparativo de AqpZ e GlpF.Yi Wang, Klaus Schulten, e Emad Tajkhorshid. Estrutura, 13:1107-1118, 2005. Teoria cinética e simulação de transporte de água monocanal.Emad Tajkhorshid, Fangqiang Zhu, e Klaus Schulten. Em S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Holanda, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, e Klaus Schulten. Em Boris Martinac e Andrzej Kubalski, editores, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Modelo de difusão coletiva para permeação da água através de canais microscópicos. Fangqiang Zhu, Emad Tajkhorshid, e Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 páginas). Estudos computacionais dos canais de membrana.Benoit Roux e Klaus Schulten. Estrutura, 12:1343-1351, 2004.